應變率成像評價孤立性陣發性房顫患者左心房主動泵血功能
黃國倩 舒先紅 周京敏 潘翠珍 陳灝珠
孤立性陣發性房顫(paroxysmal atrial fibrillation,PAF)是臨床上最常見的心血管疾病之一,經導管射頻消融是近年來發展起來的一項新的房顫治療技術,可使部分房顫(atrial fibrillation,AF)患者達到臨床治愈。許多臨床研究均顯示,該手術可以有效地恢復竇性心律,逆轉左心房(left atrial,LA)重構,但對LA主動泵血功能的影響尚不明確。LA的主動泵血功能對于AF的發生及預后具有重要的影響,但受技術限制,一直未得到深入的研究。在組織速度成像(tissue velocity imaging,TVI)基礎上衍生的應變率成像(strain rate imaging,SRI)技術可定量研究心肌運動和變形功能,問世后一直用于左心室功能評價,用于LA功能的研究較少。本研究采用SRI技術對PAF射頻消融手術前后的LA主動泵血功能進行隨訪,旨在了解孤立性PAF患者LA泵血功能及導管射頻消融的影響,指導臨床治療和預后評價。
1 資料和方法
1.1 研究對象
包括20例成功接受首次經導管射頻消融術治療并維持竇性心律半年以上的孤立性PAF患者(常規超聲心動圖上無明確的器質性心臟病,無其他器質性心臟病病史)。剔除左室射血分數(left ventricle ejection fraction,LVEF)<55%、隨訪期間AF復發的患者、因頻發早搏或透聲條件差等原因影響圖像質量的患者。其中男性9例,女性11例,平均年齡(59±11)歲,平均LVEF(65.65%± 5.79%)。選取20例無AF及其他心臟病史,無心臟疾病相關癥狀體征,常規超聲心動圖及心電圖檢查正常的患者作為對照組,其中男性6例,女性14例,平均年齡(58±10)歲,平均LVEF(67.60%± 6.44%)。
1.2 超聲心動圖檢查
患者分別在射頻消融術前、術后3個月和半年隨訪常規超聲心動圖、LA的TVI及SRI。采用GE Vivid 7彩色多普勒超聲成像儀(M4S探頭)采集連續3個心動周期的動態圖像,數字化存儲以供脫機分析。測量LA主動泵血功能指標如下(3個心動周期的平均值):
于心尖四腔觀運用Simpson法測量收縮末期(T波結束)的最大LA容積(LAV max)、P波前LAV(LAV-preP)、舒張末期(Q波前)的最小LAV(LAV min); 計算LA主動射血分數AAEF=(LAV-preP - LAV min )/ LAV-preP×100%。測量二尖瓣血流圖舒張晚期A波的峰值流速(MV-A)以及肺靜脈血流圖Ar波的流速 (PV-Ar)。
于心尖四腔觀進行TVI及SRI成像,取樣門寬(3~5 mm)置于LA側壁及房間隔中段,記錄LA心肌舒張晚期的運動速度(Am)和應變率(SR-A); 心房肌總位移(T total)、總應變(εtotal)及心電圖P波前心房收縮產生的主動位移(T-P)和主動應變(ε- P),并計算后者占總位移或應變的百分比(%T-P = T-P/T total ×100%; %ε- P = ε- P/εtotal×100%)。以房間隔及側壁對應位點各指標的平均值代表LA的測值(圖1)。
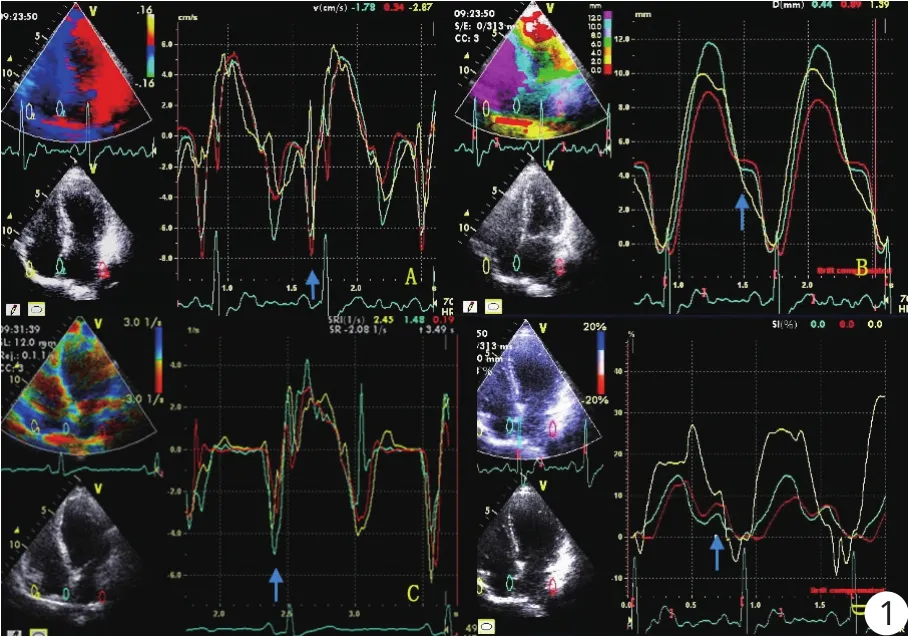
圖1 運用TVI及SRI技術測量正常人心房中部的心肌運動和變形功能A:組織運動曲線; B:組織位移曲線; C:組織應變率曲線; D:組織應變曲線。黃色、綠色及紅色分別代表右房側壁、房間隔、LA側壁。藍色箭頭指示的是心電圖P波時心房主動收縮所產生的舒張晚期速度、主動位移、舒張晚期應變率及主動應變
1.3 統計學處理
采用SPSS 11.5軟件進行統計分析。對于正態分布參數采用表示,PAF與正常對照組之間參數比較采用獨立樣本t檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 術前PAF患者的LA重構與功能(表1、2)
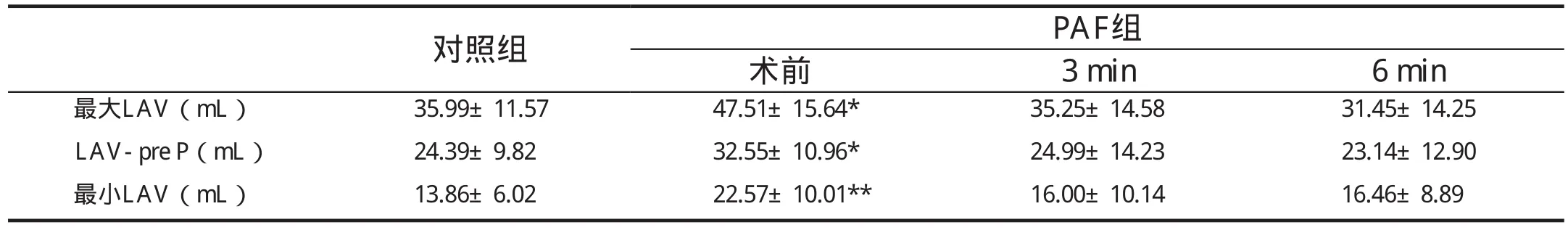
表1 PAF患者射頻消融術后LA重構逆轉
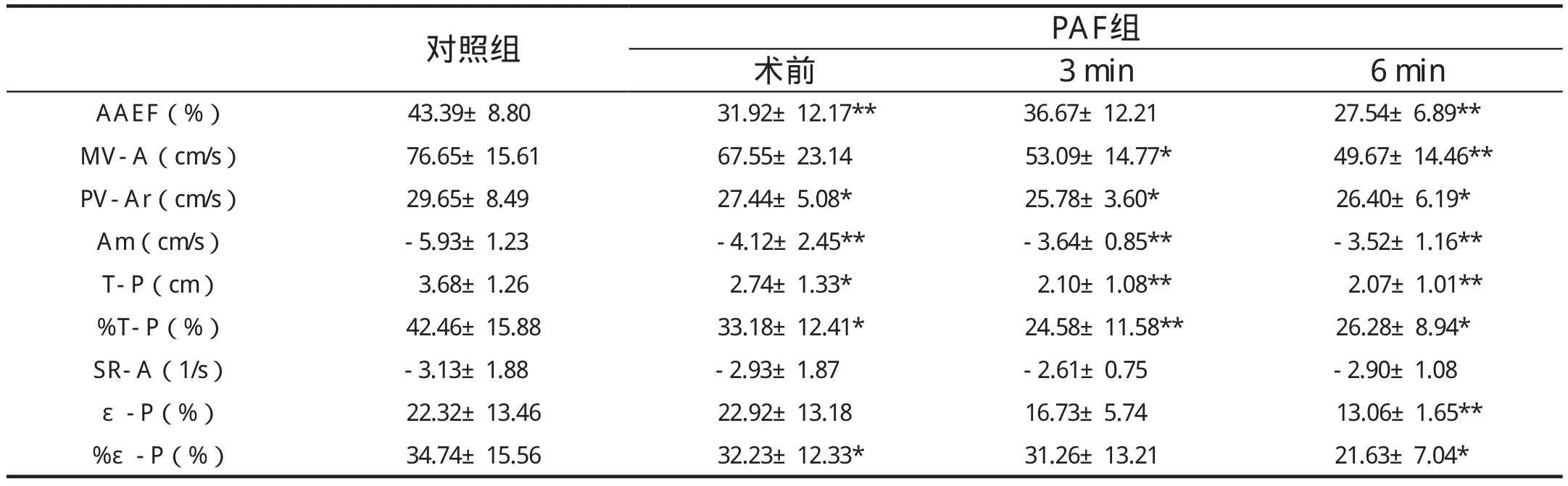
表2 PAF患者心房肌主動收縮功能指標
與正常對照組相比,PAF患者術前LA明顯擴大(P均<0.05); LA的主動收縮功能明顯降低,AAEF及PV-Ar低于正常組(P分別為0.002、0.037)。
心房肌的運動、位移、應變率和應變呈規律的曲線(圖1)。心房肌的運動和位移與心室同向,變形則與心室肌反向。PAF患者舒張晚期心房肌速度、心房肌主動位移及主動位移分數均較正常組降低(P分別為 P=0.006、0.030和0.049),反映了PAF患者LA主動運動功能的減退; 同時,心房肌的主動應變分數較正常組也明顯下降(P=0.046),反映了LA主動變形功能的減退。
2.2 射頻消融術后LA泵血功能的變化
術后3個月,各時相的LAV較術前顯著縮小(與術前相比,P均<0.05),與正常組差異消失。盡管如此,LA主動泵血功能未見明顯改善,術后6個月AAEF、二尖瓣血流A峰速度、心房肌舒張晚期速度、主動位移及應變、主動位移及應變分數等指標仍明顯低于正常組。
3 討論
LA功能包括儲血、傳輸及泵血功能,其中泵血功能又稱為心臟的助力泵,對于維持正常左室排血具有重要意義,尤其是老年人或左心室功能處于代償邊緣的患者,一旦LA失去主動收縮,可導致心功能的惡化,誘發或加重心衰。LA的主動收縮可以避免LA內血栓形成,降低腦卒中的發生,此外,LA的大小及泵血功能對于預測AF發生或復發具有重要意義[1-3],可幫助臨床決定是否需要預防性使用抗心律失常藥物及繼續抗凝治療。傳統的評價LA泵功能方法主要包括:LA主動面積變化分數和AAEF、二尖瓣血流A波流速、肺靜脈血流Ar波速度及左心耳血流的峰值排空速度等。這些傳統方法耗時費力,觀測者間變異大,易受左室功能以及年齡、心率及前負荷等因素的影響。TVI及衍生的SRI技術可評價局部心肌的運動和變形功能,已被廣泛應用于左心室的功能評價,但將其運用到評價心房功能的研究仍然較少。國外的研究顯示,心房的應變反映了LA的收縮功能,較少受到心室功能的影響[4]; 慢性AF中,LA的應變及應變率明顯降低[5-7]; 心肌梗死患者的心房應變率曲線變鈍,峰值延遲[4]; 導管消融后,LA應變和應變率較高的患者術后長期維持SR的可能性更大[8]。本研究發現PAF患者不僅LA明顯擴大,LA主動運動和變形功能也受到損害,心房肌舒張晚期運動速度、主動位移,主動位移和應變分數均顯著降低。二尖瓣血流圖上A峰速度雖有降低,但差異無統計學意義,提示組織速度和應變可能較二尖瓣血流圖更加敏感。
恢復竇性心律可以逆轉心房重構,但對于LA主動泵血功能是否得到改善,目前存在爭議。有研究顯示,AF電復律后71%的患者可發生LA頓抑,通常持續28 d后恢復到基礎狀態; 但也有報道復律6個月后心房功能仍存在不同程度的損害[9]。這些研究大多針對慢性AF,而PAF患者在導管消融術后心房主動功能的改變研究較少。射頻消融術本身是否會對心房的功能產生影響也存在爭議[9-11]。本研究顯示:盡管PAF患者射頻消融術后3個月LA即可縮小至正常,但LA主動收縮功能并未得到明顯提高,術后6個月大多數反映LA泵血功能的指標仍低于正常,提示主動泵血功能異常持續存在,是否與射頻消融損傷有關仍需要進一步研究。
由于AF初發大多隱匿,因此本研究未對既往發作情況進行量化和比較。AF患者常合并高血壓、糖尿病、冠心病等基礎疾病,盡管本研究選擇的病例無明顯心臟結構和LVEF異常,但無法排除上述疾病的早期階段及其對心房肌功能可能造成的影響。盡管如此,本研究顯示應變率成像技術可用于定量評價心房的運動和變形功能,對于孤立性的PAF患者,射頻消融可有效地改善LA重構,但LA主動泵血功能的異常可能在術后長期存在,提示長期隨訪的必要。
[1]Fatema K,Barnes ME,Bailey KR,et al.Minimum vs.maximum left atrial volume for prediction of first atrial fibrillation or flutter in an elderly cohort:a prospective study [J].Eur J Echocardiogr,2009,10(2):282-286.
[2]Casaclang-Verzosa G,Barnes ME,Blume G,et al.C-reactive protein,left atrial volume,and atrial fibrillation:a prospective study in high-risk elderly [J].Echocardiogr,2010,27(4):394-399.
[3]Osranek M,Fatema K,Qaddoura F,et al.Left atrial volume predicts the risk of atrial fibrillation after cardiac surgery:a prospective study [J].J Am Coll Cardiol,2006,48(4):779-786.
[4]Donal E,Raud-Raynier P,Racaud A,et al.Quantitative regional analysis of left atrial function by Doppler tissue imagingderived parameters discriminates patients with posterior and anterior myocardial infarction [J].J Am Soc Echocardiogr,2005,18(1):32-38.
[5]Kosior DA,Szulc M,Opolski G,et al.Long-term sinus rhythm maintenance after cardioversion of persistent atrial fibrillation:is the treatment's success predictable? [J].Heart Vessels,2006,21(6):375-381.
[6]Inaba Y,Yuda S,Kobayashi N,et al.Strain rate imaging for noninvasive functional quantification of the left atrium:comparative studies in controls and patients with atrial fibrillation[J].J Am Soc Echocardiogr,2005,18(7):729-736.
[7]Kuppahally SS,Akoum N,Burgon NS,et al.Left atrial strain and strain rate in patients with paroxysmal and persistent atrial fibrillation:relationship to left atrial structural remodeling detected by delayed enhancement-MRI [J].Circ Cardiovasc Imaging,2010,3(3):231-239.
[8]Schneider C,Malisius R,Krause K,et al.Strain rate imaging for functional quantification of the left atrium:atrial deformation predicts the maintenance of sinus rhythm after catheter ablation of atrial fibrillation [J].Eur Heart J,2008,29(11):1397-1409.
[9]Thomas L,Thomas SP,Hoy M,et al.Comparison of left atrial volume and function after linear ablation and after cardioversion for chronic atrial fibrillation [J].Am J Cardiol,2004,93(2):165-170.
[10]Delgado V,Vidal B,Sitges M,et al.Fate of left atrial function as determined by real-time three-dimensional echocardiography study after radiofrequency catheter ablation for the treatment of atrial fibrillation [J].Am J Cardiol,2008,101(9):1285-1290.
[11]Verma A,Kilicaslan F,Adams JR,et al.Extensive ablation during pulmonary vein atrium isolation has no adverse impact on left atrial function:an echocardiography and cine computed tomography analysis [J].J Cardiovasc Electrophysiol,2006,17(7):741-746.

