18F-FDG的穩定性及提高穩定性的方法
張錦明,李云剛,劉 健,張曉軍,田嘉禾
(中國人民解放軍總醫院 核醫學科,北京 100853)
18F-FDG在高能γ射線作用下會產生輻射自分解,導致18F-FDG放化純度降低[1-2]。我國國家食品藥品監督管理局18F-FDG暫行標準規定,18F-FDG的有效期為合成后6 h[3]。但高濃度的18F-FDG由于輻射分解,合成后在6 h內其放化純度低于90%。如果不對其進行分離直接注入體內,會導致骨的放射性攝取升高。為了減少18F-FDG的輻射分解,降低骨的攝取,文獻采用防輻射分解試劑如抗壞血酸、乙醇等,以延長18F-FDG的有效期,但仍有少量18F-FDG分解[5-6]。本研究小組的初步研究[4]表明,使用再純化方法處理已分解的18F-FDG,可以將其放化純度從90%提高到99%以上,使不合格的18FFDG成為合格產品。但再純化處理的回收率與放化純度相關,回收率低,放化純度也低,影響了18F-FDG的使用效率。本工作在進一步研究18F-FDG穩定性的基礎上,擬利用乙醇的穩定作用,并結合再純化方法,探索有效的提高18FFDG穩定性方法,以保證放化純度>95%,并提高18F-FDG的利用率。
1 主要實驗材料
1.1 試劑與儀器
H218O:豐度97%,江蘇華益化工有限公司產品;無水乙腈、氨基聚醚 K2.2.2以及 K2CO3:美國Aldrich公司產品;Sep-Pak C18及Al2O3柱:美國Waters公司產品;IC-H柱:美國 Alltech公司產品;USP級乙醇:美國 Milliper公司產品;三氟甲基磺酰基甘露糖(FDG前體):德國ABX公司產品。NaOH和 HCl均為北京化工廠產品。
Sumitomo HM-20S加速器:日本駐友株式會社;18F-FDG自動化合成模塊:派特(北京)科技有限公司;BioScan-3000放射性薄層掃描儀:美國 BioScan公司產品。HPLC系統:配 515泵、410示差檢測器、Bio-Scan Flow Count,Waters公司產品。eXPlore VistaMicro PET/CT成像系統:美國GE公司產品。
1.2 實驗動物
Wister大鼠:200 g,2只,清潔級,中國人民解放軍軍事醫學科學研究院動物所提供。
2 實驗方法
2.1 18F-FDG的自動化合成[7]
采用國產18F-FDG自動化合成模塊,步驟如下:(1)Sumitomo HM-20S加速器生產的18F-被QMA捕獲后,經K2CO3乙腈水溶液洗脫進入反應管,共沸除水至干,再加入2 mL乙腈共沸除水至干。(2)反應管內加入1 mL無水乙腈溶解的20 mg三氟甘露糖,83℃加熱5 min,除乙腈后加入 14 mL水稀釋。(3)混和物過Sep-Pak C18柱,中間體吸附在柱上,用10 mL水沖洗該柱二次,向柱上加入1 mL 2 mol/L的NaOH,常溫水解2 min。(4)水解產品依次過IC-H柱、Sep-Pak C18(合成前用5 mL乙醇活化該柱進行預處理)及 Al2O3柱純化,再用10 mL水沖洗,最終產品過無菌濾膜即可。整個合成過程占時22 min,不校正合成效率為60%。
2.2 18 F-FDG穩定性及加入乙醇后穩定性[6]
按常規方法合成18F-FDG,按體積分數為0.1%向產品收集瓶中加無水乙醇。室溫下靜置,用TLC或HPLC法測量不同放射性濃度下添加0.1%乙醇前后及放置不同時間18F-FDG的放化純度。
2.3 已分解18F-FDG的再純化[4]
取TLC測量已輻射分解的18F-FDG,直接經Sep-Pak Al2O3柱、Sep-Pak C18柱純化后過無菌濾膜,用少量水沖洗柱和無菌濾膜,測量收集的純化產品和Sep-Pak Al2O3柱上的放射性活度,計算純化后18F-FDG的放化純度。
2.4 18 F-FDG放化純度分析[8]
分別采用HPLC和 TLC分析產品的放化純度。
HPLC法:分析軟件為Millennium32,流動相為85%的乙腈,流速為2 mL/min,分離柱為碳水化合物柱(10μm,3.9 mm×300 mm)。
TLC法:取18F-FDG點樣于硅膠板上,用85%的乙腈水溶液上行展開,用 BioScan-3000放射性薄層掃描儀掃描。產品的Rf=0.45,雜質的R f=0。
2.5 大鼠Micro PET/CT顯像
取200 g Wister大鼠 2只,尾靜脈注射18.5 MBq18F-FDG,60 min后腹腔注射5%的水合氯醛麻醉。將大鼠置于eXplore Vista Micro PET/CT上進行全身掃描,先進行PET掃描,再用CT進行定位,確定放射性濃集部位。
3 結果與討論
3.1 18 F-FDG放化純度
18F-FDG的放化純度一般采用 TLC方法,也可以采用HPLC方法。兩者相比,TLC更方便、快速,但TLC受點樣影響,測量沒有HPLC準確。采用HPLC可以更清楚地了解18F-FDG分解后所形成的副產物。因此,本工作采用TLC和HPLC兩種方法對新合成的18F-FDG進行分析,結果示于圖1。新合成的18F-FDG TLC譜圖中僅有一個R f為0.45峰,HPLC譜圖中僅出現一個保留時間為5.4 min峰。
而圖1HPLC譜顯示,分解后的18F-FDG主要副產物僅有一個,是保留時間為3.95 min的F-,與TLC譜圖中原點雜質峰一致。
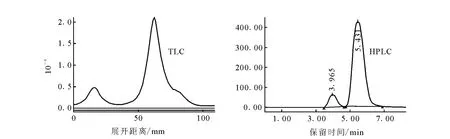
圖1 TLC及HPLC測量輻射分解的18 F-FDG
本研究初始產物僅一個峰,但高濃度產品存貯4 h后,TLC和HPLC檢測均發現了雜質峰,且TLC結果和HPLC結果一致,以下實驗中均采用TLC分析其放化純度。
3.2 18F-FDG的穩定性
濃度為0.74~1.85 TBq/L(n=100)18FFDG產品室溫放置6 h,TLC沒有觀察到原點有放射性增加。濃度為4~12 TBq/L的18FFDG產品,室溫放置4 h,TLC檢測其放化純度,結果示于圖2。由圖2可見,隨著濃度增大,產品放化純度下降很快。無穩定劑時,放置4 h后,濃度為6 TBq/L的產品放化純度平均約為95%,濃度為8 TBq/L的產品放化純度平均只有92%,已不能滿足臨床要求[3]。產品濃度(x)與放置4 h后放化純度(y)之間存在負線性關系,相關方程為:y=-0.394 9x+97.5,R2=0.179。該結果與Jiménez[1]的產品中游離的 F-與18F-FDG濃度呈正比關系一致。該結果提示,18F-FDG濃度增大,放置一定時間后放化純度下降很快;濃度大于6 TBq/L的產品有效期小于4 h。為了提高18F-FDG的穩定性,可用生理鹽水將其濃度稀釋至小于2 TBq/L。但存放期間稀釋18F-FDG,存在后期注射體積較大的不足。
18F-FDG輻射分解的原因是高能射線產生自由基將水分解成自由的質子、羥基和雙氧水,這些羥基和質子進一步破壞FDG的骨架,從而引發一系列分解。HPLC分析證實,分解的FDG中存在過氧化氫,濃度達2 mg/L[5]。而還原劑抗壞血酸和自由基萃滅劑乙醇等可以防止過氧化氫的產生,從而提高18F-FDG的穩定性。

圖2 濃度與放化純度的關系及加乙醇對18 F-FDG產品穩定性的影響◆——加0.1%乙醇放置4 h;□——加0.1%乙醇放置6 h;▲——無穩定劑放置4 h
3.3 乙醇對18F-FDG的穩定作用
在18F-FDG產品中加添加少量乙醇,使乙醇的體積分數為0.1%,并用生理鹽水調18F-FDG產品的濃度,室溫放置。分別于4 h和6 h測其放化純度,結果示于圖 2。圖2顯示,添加0.1%乙醇后,18F-FDG的分解速度明顯減緩。但仍有少量分解,分解速度與濃度和放置時間呈正比;不加穩定劑時,18F-FDG濃度為5~15 TBq/L,室溫放置4 h后,起始濃度與放化純度之間存在負線性關系,線性方程為:y=-0.065 6x+98.1,R2=0.015 4,放置6 h后線性方程為:y=-0.136 8x+99.5,R2=0.186 4。
Kiselev等[9]首先提出體積分數為0.1%乙醇作為18F藥物的穩定劑。他們認為,對于18FFDG濃度大于10 TBq/L的藥物,添加0.1%的乙醇可維持其放化純度>90%。Jacobson等[6]通過測量產品自身乙醇含量發現,制備過程中帶入乙醇(自身乙醇)的體積分數為0.004%~0.001%時,高濃度(10 TBq/L)18F-FDG分解很快,10 h時游離F-濃度>20%,而當自身乙醇質量分數大于0.05%時,即使濃度>10 TBq/L,10 h時游離F-濃度<5%。本研究結果與Jacobson的結果一致,即通過外加乙醇,可以明顯提高18F-FDG 穩定性;與Fawdry等[5]的結果則有差異,他們認為,在 11.4 TBq/L濃度下,加乙醇與否對放化純度無影響,可能是其對照組自身含乙醇所致。由圖2也可以看出,無穩定劑時,相同濃度不同批次18F-FDG穩定性也有較大差別,可能是自身乙醇濃度差異所致。
3.4 再純化已分解的18F-FDG
將已分解的18F-FDG過 Sep-Pak C18和Al2O3柱進行再純化,結果顯示,Sep-Pak C18柱上沒有放射性,放射性主要吸附在Sep-Pak Al2O3柱上,說明分解產物中沒有脂溶性的雜質,主要是水溶性的離子雜質。用 HPLC和TLC法對再純化后18F-FDG藥液進行分析,其放化純度>99%。Sep-Pak Al2O3柱吸附的放射性與放化純度的關系示于圖3。
分析圖3可知,放化純度與柱上吸附的放射性存在負線性關系,其相關方程為 y=-1.740 4x+173.6,R2=0.639 3。放化純度低時,分解的雜質主要是F-,因此Al2O3柱上吸附的放射性高。TLC和HPLC分析表明,再純化后18F-FDG的放化純度>99%。再純化后18F-FDG回收率約為80%(n=50),放射性除吸附在Al2O3柱上外,還有部分吸附在無菌濾膜和注射器上。
3.5 提高穩定性的方法
用體積分數為0.1%的乙醇作穩定劑可減緩其輻射分解,但4 h后仍有少量分解。再純化效果明顯,但FDG的損失較大,且再純化后放置2~4 h,放化純度仍會出現明顯下降。為了提高18F-FDG利用率,保持高的放化純度,將外加體積分數為0.1%的乙醇作穩定劑和再純化結合使用:先在高濃度(15 TBq/L)18F-FDG產品中添加乙醇,室溫下放置約4 h,之后再對其進行純化。檢測結果顯示,產品的放化純度>98%。
綜上所述,常規生產18F-FDG時,產品合成后即加入體積分數為0.1%的乙醇,室溫放置3 h后每隔1 h測其放化純度,如果<95%,采用再純化方法對其處理,可以保證使用時18F-FDG的放化純度>95%。產品合成后即添加乙醇和放化純度低于95%后進行再純化這兩種方法的組合,既保證了臨床使用18F-FDG的放化純度,又減少了18F-FDG的損失。
3.6 大鼠的Micro PET/CT顯像
經Wister大鼠尾靜脈注射新鮮制備的18FFDG,60 min后行全身PET顯像,結果顯示,放射性主要濃集于心肌和肌肉。
將已出現分解、放化純度低于90%的18FFDG由尾靜脈注入Wister大鼠體內,其注射后60 min的PET和CT顯像結果示于圖4。由圖4可以看出,分解后的18F-FDG顯像質量下降;股骨明顯顯像,同時也可見脊柱等顯像。股骨明顯攝取放射性也進一步證實18F-FDG分解的放射性雜質是F-。
對放化純度<90%已發生分解的18F-FDG進行再純化。將純化后的18F-FDG注入大鼠體內,其PET和CT顯像結果示于圖5。圖5顯示,純化后的18F-FDG在大鼠體內的放射性分布與新鮮制備的18F-FDG一致,股骨和脊柱不顯像,PET圖中脊柱左側位置的放射性不是骨攝取,CT對應不在脊柱上。Micro PET/CT顯像說明再純化可以有效去除輻射分解的放射性雜質,提高圖像質量。
Buriova[10]在研究低濃度(0.4~0.6 TBq/L)18F-FDG時發現,18F-FDG存貯6~48 h后,TLC檢測始終僅有一個18F-FDG峰,沒有發現其他峰;HPLC分析則發現了多個放射性峰,主要分解產物為2-氟-葡萄糖酸和2-氟-葡萄醛酸。但本研究經動物顯像證實,18F-FDG分解后的主要雜質是游離的F-,它主要濃集于骨內(圖4);分解后的18F-FDG經純化柱處理后再注入大鼠體內,骨內無攝取(圖5),說明雜質已除去。本工作結果與Buriaova的結果不同,可能是由于18F-FDG濃度不同,其分解產物也有一定差異。
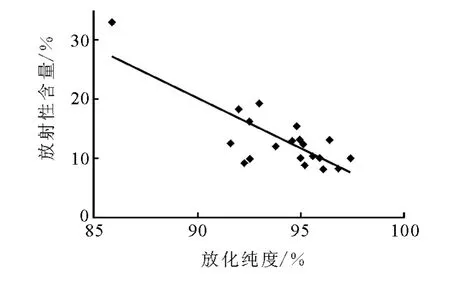
圖3 Al2 O3柱上殘留的放射性與放化純度的關系
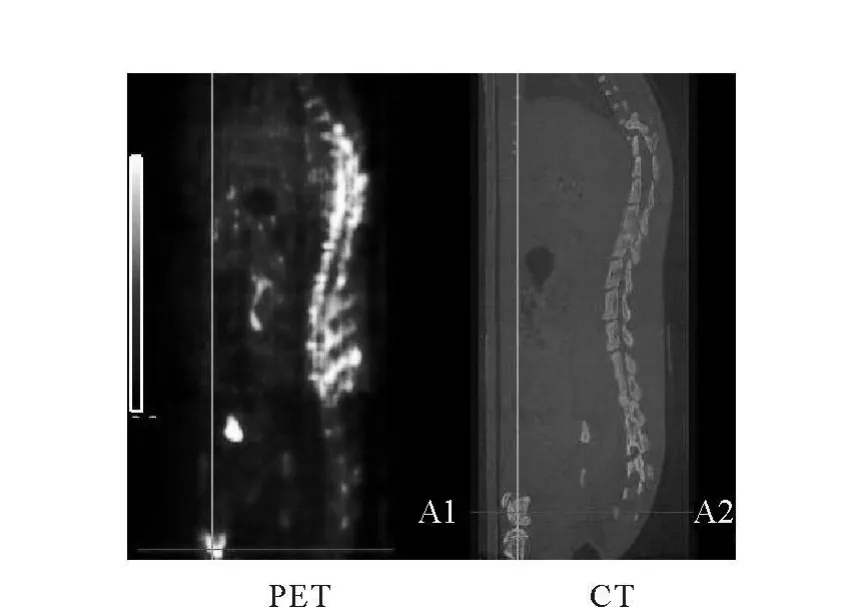
圖4 放化純度低于90%的18 F-FDG在大鼠體內micro-PET/CT顯像
4 結 論
1)高濃度(6 TBq/L)的18F-FDG產品室溫下體外穩定性小于4 h。
2)18F-FDG產品中添加體積分數為0.1%的乙醇,可明顯增加18F-FDG的體外穩定性。
3)再純化處理可以將已輻射分解的18FFDG放化純度提高到99%以上。
4)高濃度(6 TBq/L)的18F-FDG可采用先外加體積分數為0.1%的乙醇,4 h后再純化的方法,以保證18F-FDG的放化純度和利用率。
18F-FDG合成后加入體積分數為0.1%的乙醇及再純化方法聯合使用,已成為本科處理輻射分解18F-FDG的常規技術。
[1] Jiménez IR,Roca EM,Campos AF,et al.Inf luence of radioactive concentration and storage time on radiochemical purity of18F-FDG[J].Rev Esp Med Nucl,2006,25:20-25.
[2] Karwath P,Sartor J,Gries W,et al.Steam sterilization and automatic dispensing of[18F]fludeoxyglucose(FDG)for injection[J].Appl Radiat Isot,2005,62(4):577-586.
[3] 國家食品藥品監督管理局.YBH05262005氟[18F]脫氧葡糖注射液質量標準(暫行)[S/OL].[2010-04-09]http://www.sfda.gov.cn.
[4] Zhang JM,Li YG,Liu J,et al.The analysis of radiolysis impurities in18F-FDG and methods of repurification[J].J Radioanal Nucl Chem,2010,283:565-569.
[5] Fawdry RM.Radiolysis of 2-[18F]fluoro-2-deoxyd-glucose(FDG)and the roleof reductant stabilisers[J].Appl Radiat Isot,2007,65:1 193-1 201.[6] Jacobson MS,Dankwart HR,Mahoney DW.Radiolysis of 2-[18F]fluoro-2-deoxy-β-glucose([18F]FDG)and the role of ethanol and radioactive concentration[J].Appl Radiat Isot,2009,67:990-995.
[7] 劉曉飛,張錦明,田嘉禾,等.固相柱水解和IC-H柱中和法制備18F-FDG及放射性損失分析[J].國際藥學研究雜志,2008,35(1):1-4.
[8] 張錦明,田嘉禾,陳英茂.18F-FDG放射化學純度快速測量[J],中華臨床醫學雜志,2004,16(5):11-12.
[9] Kisleve M,Tadino V.Stabilization of radiopharmaceuticals labeled with18F:US,2004/0223910 A 1[P].2004-02-23.
[10]Buriova E,Medova M,M acasek F,et al.Separation and detection of oxidation productions of f luorodeoxyglucose and glucose by high-performance liquid chromatography-electrospray ionization mass spectrometry[J].J Chromatogr A,2004,1 034:133-137.

