薏苡仁注射液(康萊特)聯(lián)合順鉑對(duì)人肺腺癌細(xì)胞A549抑制作用及機(jī)制
呂品田, 周 坤, 王亞珍, 劉 斌
(1.河北省人民醫(yī)院腫瘤科,河北石家莊 050051;2.河北醫(yī)科大學(xué)第二醫(yī)院心內(nèi)科,河北石家莊 050000)
肺腺癌是臨床常見(jiàn)的惡性度較高的腫瘤之一,發(fā)現(xiàn)時(shí)已多處于進(jìn)展期,很難依靠手術(shù)達(dá)到根治目的。化療作為肺腺癌綜合治療的重要手段,在肺腺癌治療中發(fā)揮重要作用,但腫瘤多藥耐藥性(Multidrug resistance,MDR)的存在導(dǎo)致化療效果并不理想。故尋找新型藥物并逆轉(zhuǎn)腫瘤的MDR表型對(duì)提高化療效果、改善預(yù)后意義重大[1]。薏苡仁注射液(康萊特)以中藥薏苡仁提取物為主要成分,近期用于臨床肺腺癌治療已取得明顯效果,且該藥與化療藥物聯(lián)合應(yīng)用具有抑制腫瘤的協(xié)同作用[2-3],但關(guān)于該藥具體調(diào)節(jié)肺腺癌MDR表型的機(jī)制報(bào)道很少。因此,本研究應(yīng)用康萊特及肺腺癌常用化療藥物順鉑(CDDP)作用于人肺腺癌細(xì)胞A549,對(duì)其對(duì)腫瘤細(xì)胞的抑制情況及調(diào)節(jié)腫瘤MDR的作用機(jī)制進(jìn)行了探討。
1 材料與方法
1.1 材料
人肺腺癌細(xì)胞株A549購(gòu)自中國(guó)科學(xué)院上海細(xì)胞研究所,細(xì)胞置于含10%新生牛血清的RPMI 1640培養(yǎng)液中培養(yǎng),2~3 d傳代1次。正常細(xì)胞系人腦微血管內(nèi)皮細(xì)胞HBMEC(Human brain microvascular endothelial cells)由本院科研中心保存。康萊特由浙江康萊特藥物有限公司提供;注射用順鉑粉針(CDDP,齊魯制藥有限公司),調(diào)整藥物濃度為0.5μg/mL。將處于對(duì)數(shù)生長(zhǎng)期的細(xì)胞經(jīng)消化分散后計(jì)數(shù),制成細(xì)胞懸液,各200μL/孔接種于96孔板內(nèi),分為康萊特組、CDDP組、康萊特+CDDP組及A549對(duì)照組,預(yù)培養(yǎng)24 h后,實(shí)驗(yàn)各組分別加入康萊特及CDDP各20μL。每組設(shè)6個(gè)復(fù)孔;并設(shè)空白對(duì)照(RPMI 1640培養(yǎng)液)和正常對(duì)照孔(生理鹽水),置于37°C,5%CO2培養(yǎng)箱培養(yǎng)48 h后進(jìn)一步實(shí)驗(yàn)。
1.2 SRB顯色法體外藥物敏感性實(shí)驗(yàn)
培養(yǎng)結(jié)束后每孔加入預(yù)冷的50%的三氯醋酸(TCA)50μL,4℃放置1h以固定細(xì)胞,倒掉固定液,用超純水洗5遍,干燥后每孔加入100 μL SRB液,室溫避光放置10 min。棄去SRB,未與蛋白結(jié)合的SRB用1%醋酸液洗5遍,空氣干燥,結(jié)合的SRB用150 μL 10 mmol/L非緩沖Tris堿液(pH10.5)溶解,545 nm處測(cè)定每孔OD值。腫瘤細(xì)胞平均抑制率(IR)=(1-給藥孔平均OD值/對(duì)照孔平均OD值)×100%。
1.3 逆轉(zhuǎn)錄-聚合酶鏈反應(yīng)(RT-PCR)法檢測(cè)各MDR因子mRNA的表達(dá)
Trizol Reagent購(gòu)自華美生物工程公司(Invitrogen公司產(chǎn)品),一步法提取組織總RNA,以1.5%瓊脂糖凝膠(含EB)電泳鑒定RNA完整性,紫外分光光度法測(cè)定RNA的純度及含量。取2 μg RNA用于逆轉(zhuǎn)錄,20 μL 反應(yīng)體系包括 Oligo(dT)0.1 μg,2 mmol/L dNTPs2.5 μL,Rnasin 0.1 μg 和 MMLV 200 U,反應(yīng)條件42℃1 h,95℃5 min。每樣本分別取1μL逆轉(zhuǎn)錄產(chǎn)物建立40 μL PCR反應(yīng)體系。以GAPDH作為內(nèi)參照基因。PCR反應(yīng)參數(shù)如下:96℃預(yù)變性4 min;然后94℃ 變性30 s,58℃退火30 s,72℃延伸30 s,進(jìn)行30個(gè)循環(huán);最后72℃延伸反應(yīng)5 min。各因子引物序列如下:MDR1(438bp):引物(F)5’-CGCCAATGATGCTGCTCAAG-3’,(R)5 ’- ACCAAGTAGGCTCCAAACCG-3 ’;Bcl-2(373bp):引物 (F)5’-AGAGGGGCTACGAGTGGGAT-3’,(R)5’-TCAAAGAAGGCCACAATCCTCC-3’;Bax(353bp):引 物 (F)5 ’-TTGCTTCAGGGTTTCATCCAG-3’,(R)5’-AAGTCCAATGTCCAGCCCAT-3’。RT-PCR 產(chǎn)物經(jīng) 2% 瓊脂糖凝膠電泳,EB染色,通過(guò)凝膠掃描儀進(jìn)行DNA電泳條帶分析,各產(chǎn)物與GAPDH的比值作為表達(dá)水平的參數(shù),進(jìn)行PCR產(chǎn)物相對(duì)定量。
1.4 Western blot法檢測(cè)增殖、凋亡因子蛋白的表達(dá)
P-gp、Bcl-2、Bax 一抗及辣根過(guò)氧化物酶標(biāo)記的二抗均為美國(guó)Santa Cruz公司產(chǎn)品。收取每組107個(gè)對(duì)數(shù)生長(zhǎng)期的腫瘤細(xì)胞,分別加入細(xì)胞裂解液100 μL,冰浴 20 min,使細(xì)胞充分裂解。4℃,8 000 r/min離心10 min,收集上清,Bradford法測(cè)定蛋白濃度。每組取40μg蛋白樣品,10%SDS聚丙烯酰胺凝膠電泳分離,電轉(zhuǎn)移至PVDF膜。5%脫脂奶粉室溫封閉90 min,分別加入400倍稀釋的一抗,4℃過(guò)夜。加入二抗,漂洗后暗室曝光,常規(guī)顯影、定影。用BioRad圖像分析系統(tǒng)分析,以蛋白條帶的平均吸光度值(A值)表示蛋白表達(dá)的相對(duì)強(qiáng)度。
1.5 統(tǒng)計(jì)學(xué)處理
實(shí)驗(yàn)數(shù)據(jù)用SAS8.0統(tǒng)計(jì)分析軟件分析。組間強(qiáng)度比值使用t檢驗(yàn),以P<0.05為檢驗(yàn)有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 康萊特聯(lián)合CDDP對(duì)A549細(xì)胞的體外抑制作用
各組細(xì)胞中,與對(duì)照組比較,康萊特組、CDDP組、康萊特 +CDDP組 OD值明顯降低(均P<0.05),以康萊特+CDDP組OD值降低最為明顯(P<0.01);康萊特對(duì)正常細(xì)胞系HBMEC則無(wú)明顯抑制作用(P>0.05)。見(jiàn)表1、圖1。

表1 康萊特、順鉑對(duì)A549細(xì)胞和正常細(xì)胞的體外抑制作用

圖1 各組細(xì)胞MDR1、Bcl-2、Bax mRNA表達(dá)水平
2.2 各組細(xì)胞 MDR1、Bcl-2、Bax mRNA 表達(dá)強(qiáng)度的比較
RT-PCR結(jié)果顯示,與對(duì)照組比較,康萊特組、CDDP 組、康萊特 +CDDP 組 P-gp和 Bcl-2 mRNA 強(qiáng)度均較空白對(duì)照組降低(均P<0.05),而B(niǎo)ax mRNA強(qiáng)度則明顯升高(P<0.05);以康萊特+CDDP組變化最為顯著(均P<0.01)。而康萊特對(duì)正常細(xì)胞系HBMEC的4種因子mRNA則無(wú)明顯影響(均P>0.05)。見(jiàn)圖1。
2.3 組細(xì)胞 P-gp、Bcl-2、Bax Western Blot檢測(cè)結(jié)果的比較
Western Blot檢測(cè)結(jié)果顯示,與對(duì)照組比較,康萊特組、CDDP組、康萊特 +CDDP組 P-gp和 Bcl-2蛋白水平均較對(duì)照組降低(均P<0.05),而B(niǎo)ax蛋白水平則明顯升高(P<0.05);以康萊特+CDDP組變化最為顯著。而康萊特對(duì)正常細(xì)胞系HBMEC的3種MDR因子蛋白水平則無(wú)明顯影響(均P>0.05)。見(jiàn)圖2。
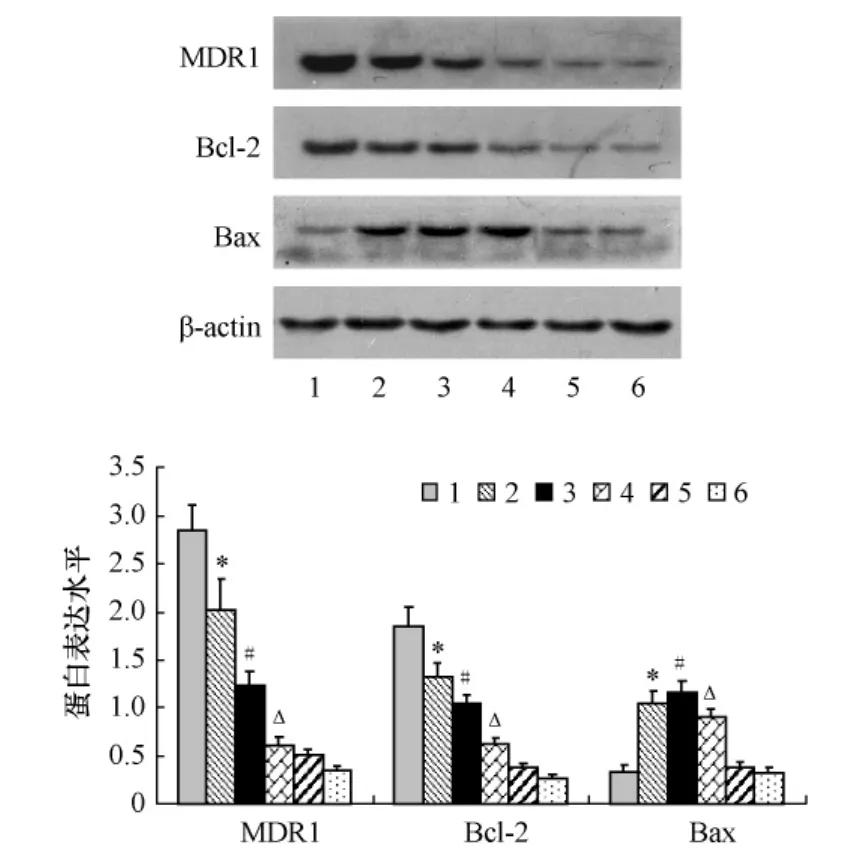
圖2 Western blot法檢測(cè)各組細(xì)胞MDR1、Bcl-2、Bax蛋白表達(dá)水平
3 討論
康萊特主要成分為薏苡仁提取物,具有益氣養(yǎng)陰,消癖散結(jié)等功能,適用于氣陰兩虛,脾虛濕困型原發(fā)性非小細(xì)胞肺癌,該藥單獨(dú)應(yīng)用或與化療藥物聯(lián)合應(yīng)用已在非小細(xì)胞肺癌包括肺腺癌的治療方面取得了良好效果[2-3]。康萊特可通過(guò)抑制腫瘤細(xì)胞增殖、誘導(dǎo)腫瘤細(xì)胞凋亡而發(fā)揮抗腫瘤作用[4-5],但其與化療藥物聯(lián)合應(yīng)用時(shí)是否有化療增敏效果及其與肺腺癌MDR關(guān)系的研究報(bào)道很少。本研究顯示,康萊特對(duì)肺腺癌細(xì)胞A549有明顯的抑制作用;該藥作用于A549后腫瘤細(xì)胞的耐藥相關(guān)因子MDR1/P-gp和凋亡抑制蛋白(inhibitor of apoptosis proteins,IAPs)Bcl-2水平明顯降低,而促凋亡蛋白Bax則水平升高,說(shuō)明康萊特可通過(guò)調(diào)節(jié)上述因子水平逆轉(zhuǎn)腫瘤MDR,達(dá)到抑制腫瘤的作用,但由于腫瘤MDR調(diào)控是多途徑、網(wǎng)絡(luò)式調(diào)節(jié),康萊特具體參與了哪些途徑還有待進(jìn)一步深入研究。本結(jié)果還顯示康萊特對(duì)于人正常細(xì)胞(人腦微血管內(nèi)皮細(xì)胞HBMEC)無(wú)明顯抑制作用,對(duì)該細(xì)胞的MDR因子水平也無(wú)顯著影響,說(shuō)明康萊特在用于肺腺癌治療中有較強(qiáng)的選擇性,對(duì)正常組織毒副作用較低,是較為理想的肺腺癌治療用藥。
肺腺癌由于起病隱匿,不易早期發(fā)現(xiàn),患者就診時(shí)多已處于進(jìn)展期或晚期,手術(shù)難以達(dá)到徹底根治或已失去手術(shù)機(jī)會(huì)。故目前包括化療在內(nèi)的各種措施在該病的治療中發(fā)揮著主要作用,而肺腺癌腫瘤細(xì)胞具有的MDR特性常導(dǎo)致化療失敗[6],結(jié)合中藥治療以提高化療效果、減輕毒副反應(yīng)已成為當(dāng)前臨床研究的熱點(diǎn)[7]。目前已有報(bào)道康萊特與化療藥物聯(lián)合應(yīng)用對(duì)腫瘤細(xì)胞殺傷有協(xié)同作用[3,8],但具體機(jī)制尚無(wú)明確報(bào)道。故本研究對(duì)康萊特聯(lián)合化療藥物CDDP對(duì)A549細(xì)胞系的作用情況進(jìn)行了研究。結(jié)果顯示,康萊特聯(lián)合CDDP對(duì)A549的殺傷率較單獨(dú)應(yīng)用放療更強(qiáng),該作用是通過(guò)抑制DR1/P-gp的藥泵作用和凋亡抑制蛋白Bcl-2的抗凋亡作用,同時(shí)促進(jìn)Bax的促凋亡作用而實(shí)現(xiàn)的。這說(shuō)明康萊特具有MDR逆轉(zhuǎn)作用,與化療藥物聯(lián)合使用可提高腫瘤細(xì)胞的化療敏感性。
本研究初步證實(shí)康萊特可通過(guò)逆轉(zhuǎn)肺腺癌細(xì)胞的MDR來(lái)增強(qiáng)化療效果,與化療具有協(xié)同作用。但本研究?jī)H檢測(cè)了部分MDR相關(guān)因子在用藥前后水平的變化,對(duì)其中轉(zhuǎn)導(dǎo)通路等具體機(jī)制尚未進(jìn)行深入研究;體外細(xì)胞系研究也與臨床研究存在較大差距。有待更深入研究其作用機(jī)制并應(yīng)用體內(nèi)實(shí)驗(yàn)予以驗(yàn)證,以期確定合適的康萊特與化療聯(lián)合作用方式,改善肺腺癌治療的效果。
[1]Li XQ,Li J,Shi SB,et al.Expression of MRP1,BCRP,LRP and ERCC1 as prognostic factors in non-small cell lung cancer patients receiving postoperative cisplatin-based chemotherapy[J].Int J Biol Markers,2009,24(4):230-237.
[2]練祖平,陸運(yùn)鑫,侯恩存,等.康萊特聯(lián)合化療治療中晚期非小細(xì)胞肺癌[J].中國(guó)肺癌雜志,2006,9(1):74-77.
[3]李 瑛,焦順昌,楊俊蘭,等.康萊特增加肺癌細(xì)胞化療敏感性的實(shí)驗(yàn)研究[J].軍醫(yī)進(jìn)修學(xué)院學(xué)報(bào),2009,30(4):560-561.
[4]梁鐵軍,秦成勇,譚艷蓉,等.康萊特抑制肝癌細(xì)胞HepG2增殖的實(shí)驗(yàn)研究[J]. 中國(guó)腫瘤臨床,2006,33(13):743-746.
[5]何 嵐,蔡 宇,徐月紅,等.中藥注射液抗腫瘤作用機(jī)理的研究進(jìn)展[J].中成藥,2004,26(10):846-848.
[6]Sun N,Sun X,Chen B,et al.MRP2 and GSTP1 polymorphisms and chemotherapy response in advanced non-small cell lung cancer[J].Cancer Chemother Pharmacol,2010,65(3):437-446.
[7]吳萬(wàn)垠,王 斌,張海波,等.參附注射液對(duì)NP方案治療非小細(xì)胞肺癌患者生活質(zhì)量影響的研究[J].中成藥,2007,29(1):14-18.
[8]李大鵬.康萊特注射液藥效學(xué)及臨床研究進(jìn)展[J].中國(guó)新藥與臨床雜志,2007,26(10):778-782.

