綿羊肺腺瘤病毒的巢式RT-PCR技術檢測*
趙澤赟,劉淑英,羅學東
綿羊肺腺瘤病毒(Jaagsiekte sheep retrovirus,JSRV)是引起綿羊肺腺瘤病(sheep pulmonary adenomatosis SPA)的病原,該病毒主要侵害肺臟[1]。SPA是一種慢性、進行性、接觸傳染性的肺臟腫瘤性疾病。該病主要以患羊咳嗽、呼吸困難、消瘦、大量漿液性鼻液、Ⅱ型肺泡上皮細胞和無纖毛細支氣管上皮細胞腫瘤性增生為特征[2-3]。綿羊肺腺瘤病1825年首先發現于南非,目前,幾乎所有養羊業發達的國家和地區,包括我國的新疆、內蒙、青海等省區都有該病的發生和流行,嚴重制約和影響著世界養羊業的發展[4]。此外,SPA與人類細支氣管—肺泡癌(bronchiolo-alveolar carcinoma,BAC)在臨床癥狀、病理組織學特征及超微病變方面極為相似,研究SPA病羊可作為研究人類BAC的理想動物模型[1]。綿羊肺腺瘤病毒是反轉錄病毒科β-反轉錄病毒屬的成員之一,很多研究表明健康綿羊基因組中含有至少20拷貝與exJSRV相似內源性逆轉錄病毒(endogenous jaagsiekte sheep retrovirus,enJSRV)序列,并且exJSRV和enJSRV在結構和序列上同源性很高[5],在絕大多數區域同源性高達98%以上,但有 3個高可變區,分別位于 U3、env、gag區[6-7]。目前,因為該病在血液中檢測不到循環抗體,所以不能用常規的血清學診斷方法,我國對本病一般通過流行病學、臨床癥狀、病理組織學切片進行粗略的診斷,尚無快速、特異、靈敏的實驗室診斷方法。
本試驗在高可變區env基因的TM區和LTR的U3區分別設計了2套引物,采用巢式 RT-PCR技術對引起綿羊肺腺瘤病(SPA)的病原進行進一步的確診,為建立特異性診斷該病的方法提供理論依據。
1 材料與方法
1.1 樣品來源及處理 樣品來源于內蒙古呼和浩特市某種羊場自然感染JSRV的病例,經過病理解剖、病理組織切片觀察,初步診斷為綿羊肺腺瘤病,取該病羊的肺臟、腎臟、肝臟、脾臟,小鼠、家兔的肺臟分別放在無RNase凍存管中于-80℃保存。取健康綿羊肺臟(陰性對照),放在無 RNase凍存管中于-80℃保存。
1.2 常用試劑 總RNA提取試劑盒,反轉錄PCR試劑盒,Ex Taq DNA聚合酶,dNTP Mixture,Marker DL2000膠回收試劑盒,均為大連寶生物工程有限公司產品。
1.3 總RNA的提取 按照總RNA提取試劑盒的說明分別提取病羊肺臟的總RNA,獲得的總RNA用1.0%瓊脂糖凝膠電泳檢測鑒定,并用微量紫外分光光度計(型號:ND-1000NanoDrop美國出產)檢測RNA的濃度和純度,之后保存于-80℃備用。
1.4 引物設計 由于enJSRV與exJSRV序列的差異主要存在于LTR的 U3區及env基因的編碼跨膜蛋白的 TM區,于是根據GenBank中注冊的JSRV基因全序列(登錄號為AF105220),用 Primer 5.0軟件在 LT R的 U3區及囊膜基因(env)的TM區分別設計套式引物,env基因的外側上游引物P1和下游引物P2,預計其擴增片段長度約為924 bp(P1,P2分別位于AF105220的6228-6247和7151-7195位點);內側上游引物P3和下游引物 P4,預計其擴增片段長度約為730 bp(P3,P4分別位于AF105220的6339-6357和7068-7083位點)。LTR的U3區的外側上游引物N1和外側下游引物N2,預計其擴增片段長度約為354 bp(N1,N2分別位于AF105220的7046-7063和7399-7419位點);內側上游引物 N3和下游引物N4,預計其擴增片段長度約為161bp(N3,N4分別位于AF105220的7239-7259和7399-7419位點)。引物由大連寶生物工程有限公司合成。各引物的序列分別為:
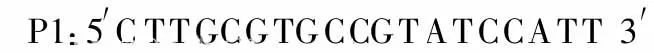

1.5 巢式RT-PCR反應體系及反應條件 反轉錄體系為:采用10 μL體系,在 PCR管中依次加入 5×PrimeScript Buffer 2μL,Oligo dT Primer(25pm/μL)0.5μL,Random 6 mers(50pm/μL)0.5μL,PrimeScript RT Enzyme Mix I 0.5μL,模板 RNA 1μL,其余用超純水補至10μL。反轉錄條件為:37℃15min,85℃5 s。
外側 PCR反應體系為:反應總體系為50μL,在PCR管中依次加入 Ex Taq酶(5 U/μL)0.25μL,10×Buffer(含 Mg離子)5μL,dNTP(各 215 mmol/L)4μL,反轉錄的 cDNA 模板 2μL,20 pmol/μL 的上下游引物 P1,P2;N1,N2;各 1μL,其余用超純水補至 50μL。在1%瓊脂糖凝膠中電泳,用凝膠成像系統拍照,觀察結果。
內側PCR反應體系同外側PCR反應體系。循環條件:94℃預變性2 min;94℃變性30 s,env基因外側52℃退火30 s,內側52℃退火30 s,LTR的U3區外側52℃退火30 s,內側52℃退火30 s,72℃延伸1 min,env基因進行35個循環,LTR的U3區進行30個循環,最后于72℃延伸10 min。反應后,PCR產物取5μL,在 1%瓊脂糖凝膠中電泳,用凝膠成像系統拍照,觀察結果。
1.6 巢式RT-PCR產物純化、測序及序列同源性比較 用AxyPrep DNA凝膠回收試劑盒分別回收env基因和 LTR的U3區的巢式RT-PCR產物。送大連寶生物工程有限公司進行雙向序列測定,應用DNAstar軟件對測得的序列與已經登錄enJSRV和exJSRV序列進行比較。
1.7 特異性試驗 采用相同的引物和反應條件,提取感染JSRV的病羊腎臟、肝臟、脾臟的 RNA為模板,進行巢式RT-PCR的特異性試驗,用瓊脂糖凝膠電泳進行檢測;再取健康綿羊、小鼠、家兔的肺臟分別提取RNA進行巢式 RTPCR的特異性試驗,用瓊脂糖凝膠電泳檢測。
1.8 敏感性試驗 取陽性病料的肺組織,提取RNA,測定其濃度及A260/A280的值,按10倍連續進行稀釋,進行巢式RT-PCR擴增,檢測其敏感性。
1.9 與普通RT-PCR進行比較 應用特異性引物 P1/P2以及N1/N2,在篩選出最適反應條件下,采用50μL反應體系,在 PCR 管中依次加入 Ex Taq酶(5 U/μL)0.25μL,10×Buffer(含 Mg離子)5μL,dNTP(各215 mmol/L)4μL,反轉錄的cDNA模板 2μL,20 pmol/μL的上下游引物 P1,P2;N1,N2;各 1μL,其余用超 純水補至 50μL。
循環條件:94℃預變性2 min;94℃變性30 s,env基因52℃退火30 s,LTR的U3區52℃退火30 s,72℃延伸1 min,env基因進行35個循環,LT R的U3區進行30個循環,最后于72℃延伸10 min。將模板RNA進行梯度稀釋,進行RT-PCR擴增,其結果與巢式RT-PCR進行比較。
1.10 重復性試驗 用外側引物P1/P2,N1/N2以及內側引物P3/P4,N3/N4進行巢式RT-PCR反應,使用陽性病料的總RNA為模板,進行3次重復試驗,來確定試驗結果的穩定性和重復性。
2 結 果
2.1 巢式RT-PCR擴增 以陽性病料的肺組織提取的總RNA為模板,以env基因的外側引物P1/P2,以及LT R的U3區的外側引物N1/N2,分別進行RT-PCR的擴增,同時設置健康綿羊肺組織總RNA以及水為模板的陰性對照。env基因外側PCR擴增的產物經過瓊脂糖凝膠電泳顯示約為924 bp,LT R的U3區外側擴增產物顯示約為354 bp(如圖1)。
以外側產物為模板,用內側引物P3/P4,N3/N4分別進行的PCR擴增產物經過瓊脂糖凝膠電泳顯示env基因的片段約為730 bp,LTR的U3區的片段約為161 bp(如圖2)。
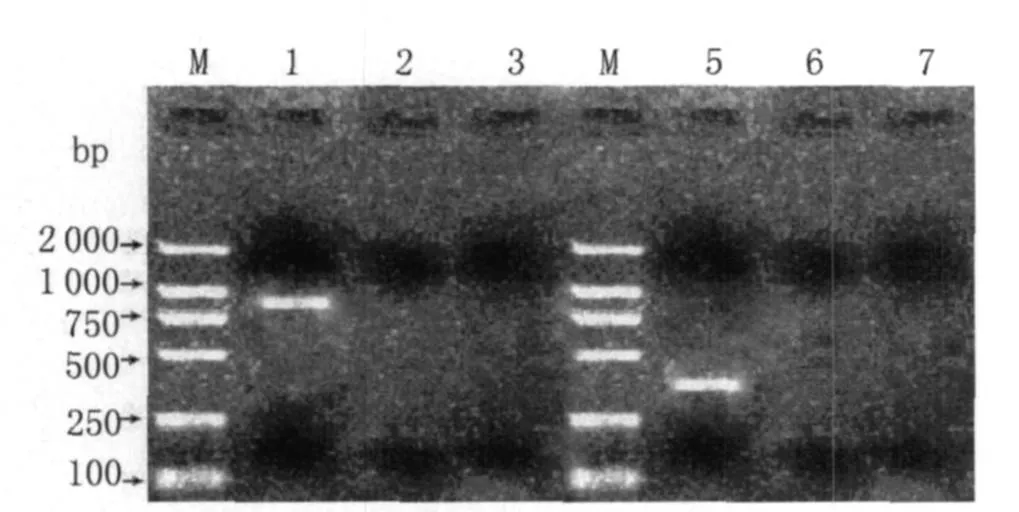
圖1 env基因、LTR的U3區外側引物的擴增結果與陰性對照Fig.1 RT-PCR products of env gene and U3(using outer primers P1P2,N1N2 separately)and negative control
2.2 序列同源性分析 經過大連寶生物工程有限公司對巢式RT-PCR產物純化,進行雙向測序,將2個基因的測序結果應用DNAstar軟件與GenBank中已登錄的外源性exJSRV序列(AF105220),內源性enJSRV序列(AF153615)進行比較分析,其中測得的env基因序列與外源性exJSRV的核苷酸同源性達100%,與內源性enJSRV核苷酸的同源性為88%,說明擴增到的目的序列為外源性的病毒序列;LTR的U3區序列與外源性exJSRV的核苷酸同源性達98%,與內源性 enJSRV核苷酸的同源性為48%,說明擴增到的目的序列也為外源性的病毒序列。
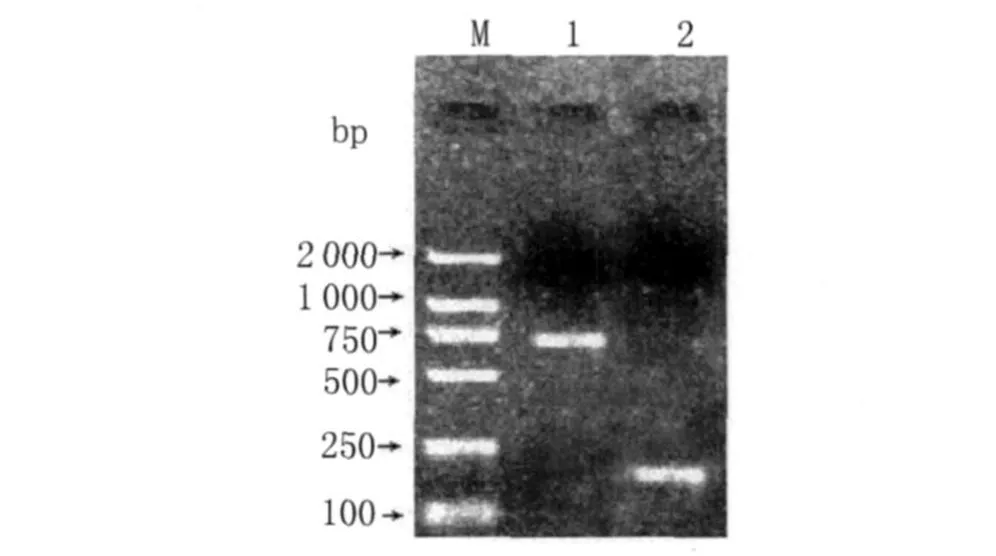
圖2 env基因、LTR的U3區巢式PCR擴增結果Fig.2 Nested PCR products of env gene(using inner primers P3P4,outer RT-PCR product of env gene as templates)and U3(using inner primers N3N4,outer RT-PCR product of U3 as templates)
2.3 特異性試驗結果 用感染JSRV的病羊腎臟、肝臟、脾臟的RNA為模板,在相同的條件下用env基因和LTR的U3區的引物進行巢式 RT-PCR試驗,用瓊脂糖凝膠電泳檢測均未見到相應的條帶(如圖3);用健康綿羊、小鼠、家兔的肺臟分別提取RNA,在相同條件下進行巢式RT-PCR試驗,用瓊脂糖凝膠電泳也均未見到相應條帶(如圖4),證明了不論是同一病羊的不同組織,還是不同動物的同一組織,本試驗設計的引物是特異的。
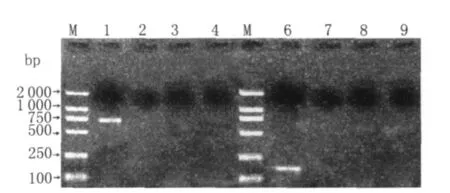
圖3 同一感染SPA羊env gene、LTR的U3區特異性試驗結果Fig.3 Specificity result of env gene and U3 by nested RT-PCR
2.4 敏感性試驗結果 用微量紫外分光廣度計測定,A260/A280=2.0134,可用于 RT-PCR擴增。取標準品總 RNA(含量480.4 ng/μL)按10倍倍比稀釋后,用本試驗設計env基因和LT R的U3區的引物進行巢式RT-PCR方法檢測。該反應體系檢測標準模板RNA的最大稀釋倍數為1×109,即env基因最低可檢測到約為48 fg的RNA,結果如圖5所示;LTR的 U3區最低可檢測到約為 48 pg的RNA,結果如圖6所示。
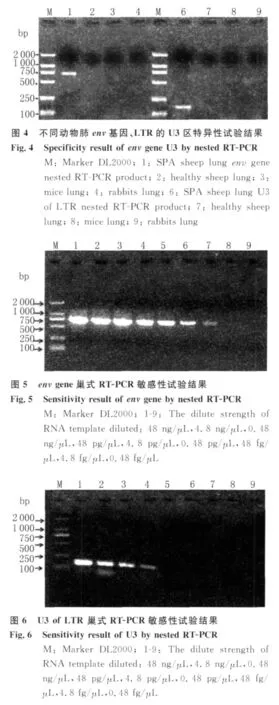
2.5 普通RT-PCR敏感性試驗及與巢式RT-PCR敏感性的比較 取標準品總RNA(含量480.4 ng/μL)按10倍倍比稀釋后,用本試驗設計的env基因和LTR的U3區的外側引物進行普通 RT-PCR方法的檢測。該反應體系檢測標準模板RNA的最大稀釋倍數為1×109,即env基因最低可檢測到約為0.48 ng的RNA,結果如圖7所示;LT R的 U3區最低可檢測到約為4.8 ng的 RNA,結果如圖8所示。說明巢式RT-PCR比普通RT-PCR更靈敏,且env基因的敏感性高于LTR的U3區。
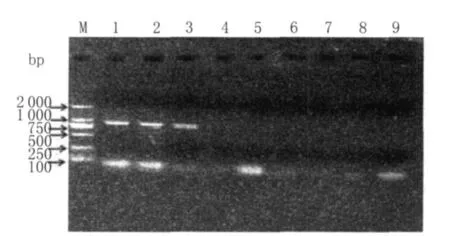
圖7 env基因普通RT-PCR的敏感性試驗結果Fig.7 Sensitivity result of env gene by RT-PCR
2.6 重復性試驗結果 用陽性病料的總RNA為模板,用內外側引物進行巢式RT-PCR擴增,重復3次,并同時也用健康綿羊肺臟的RNA為模板,進行同樣擴增,作為陰性對照,陽性病料每次都能出現特異性條帶,而陰性對照則未擴增出相應的條帶,說明本試驗具有高度穩定性和重復性。
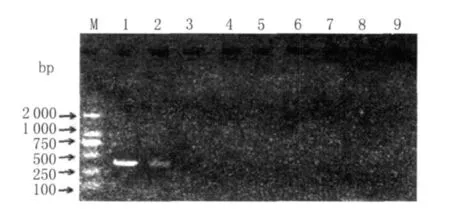
圖8 LTR的U3區普通RT-PCR的敏感性試驗結果Fig.8 Sensitivity result of U3 by RT-PCR
3 討論
到目前為止,在 SPA病羊體內未曾檢測到exJSRV的循環抗體,因此,不能用常規的免疫學方法進行診斷。另外,exJSRV還無法在體外培養傳代,所以常規的病毒分離鑒定方法在SPA診斷中也無法利用。目前,SPA的診斷主要依靠臨床癥狀和病理組織學檢查,但特異性的診斷還需依靠分子生物學技術進行確診,所以本研究運用了巢式 RTPCR的方法,對SPA的病原進行檢測。
Bai等對來自美國 3個州的 6個enJSRV和exJSRV病毒分離株進行對比研究,發現gag基因、LTR、env基因是內源性enJSRV和外源性exJSRV之間的可變區,尤其是env基因編碼跨膜蛋白區域(TM)和LTR的U3區是2個高可變區[8]。Palmarini等發現內源性enJSRV env和外源性exJSRV env基因的同源性為89%,但在env基因編碼跨膜蛋白區域(TM)和 LT R的U3區,同源性分別為57%~59%、50%[9]。因此本研究分別在env基因的TM區和LT R的U3區設計特異性引物,從而來保證診斷的特異性。本試驗結果表明應用病肺組織提取的RNA為模板進行的巢式RT-PCR,在env基因(730 bp)和LTR的U3區(161 bp)上都成功的擴增出了外源性exJSRV的特異性基因序列,序列分析所擴增的片段與外源性exJSRV的同源性分別高達100%和98%。
本課題組的梁化春等在進行該病的診斷時,運用了RT-PCR技術和半巢式RT-PCR技術成功的擴增出了外源性exJSRV的3段特異性基因序列(U3、env基因、gag基因),擴增序列的同源性和外源性exJSRV基因序列的同源性也較高,最后確診病例為綿羊肺腺瘤病[10]。然而他們的試驗沒有進行敏感性的試驗,沒有確定半巢式的方法的最低病毒檢出量是多少。
本研究通過提取病羊肺臟總RNA運用在env基因和LTR的U3區設計的特異性引物進行巢式RT-PCR和普通 RT-PCR,并且對比普通特異性RT-PCR和巢式RT-PCR的敏感性。env基因的巢式RT-PCR診斷方法最低能檢測出48 fg的標準模板RNA,LTR的 U3區的巢式 RT-PCR診斷方法最低能檢測出48 pg的標準模板 RNA,而普通的RT-PCR,env基因及LTR的 U3區的最低檢出量分別為0.48 ng和4.8 ng,試驗結果說明巢式RTPCR的敏感性明顯高于特異性RT-PCR的敏感性,同時還得出env基因的敏感性明顯高于LTR的U3區的敏感性。所以在相同的條件下用env基因進行檢測比LTR的U3區檢測的敏感性更高,所以在診斷時利用env基因可能要更好。
目前,對于綿羊肺腺瘤病的診斷還沒有快速、高效的方法,而且Marcel D等報道約240 000個外周血單核細胞中只含有一拷貝的外源性前病毒序列[11],由于病毒載量極低,所以用普通RT-PCR方法很難檢測到或容易出現假陽性,制約了該病的檢測研究,本試驗采用敏感性很高的巢式RT-PCR技術,通過對比env基因和LT R的U3區的敏感性,得出env基因在檢測中的敏感性更高,所以在實踐中,應用env基因引物通過巢式RT-PCR技術來檢測SPA將成為檢測該病的有效方法。
[1]Palmarini M,Fan H.Retrovirus-Induced ovine pulmonary adenocarcinoma,an animal model for lung cancer[J].Journal of the National Cancer Institute,2001,93:1603-1614.
[2]Palmarini M,Delasheras M,Lnglis NF,et al.Epithelial tumour cells in the lungs of sheep with pulmonary adenomatosis are major sites of replication for Jaag siekte retrovirus[J].J Gen Virol,1995,76:2731-2737.
[3]Palmarini M,Dalziel RG,Bai J,et al.The exogenous form of Jaagsiekte retrovirus is specifically associated with a contagious lung cancer of sheep[J].J Virol,1996,70:1618-1623.
[4]Beytut E,Sozmen M,Erginsoy S.Immunohistochemical detection of pulmonary surfactant proteins and retroviral antigens in the lungs of sheep with pulmonary adenomatosis[J].Comp Pathol,2009,140(1):43-53.
[5]Bai J,Bishop JV,Carlson JO,et al.Sequence comparison of JSRV with endogenous proviruses:Envelope genotypes and a novel ORF with similarity to a G-protein-coupled receptor[J].Virology,1999,258:333-343.
[6]De Las Heras M,Ortin A,Salvatori D,et al.A PCR technique for the detection of Jaagsiekte sheep retrovirus in the blood suitable for the screening of ovine pulmonary adenocarcinoma in field conditions[J].Res Vet Sci,2005,79(3):259-64.
[7]劉淑英,馬學恩,齊景偉,等.綿羊肺腺瘤病毒NM 株前病毒基因組的克隆與全序列[J].中國病毒學,2006,21(5):443-448.
[8]Bai J,Zhu RY,Stedman K,et al.Unique long terminal repeat U3 sequences distinguish exogenous jaag siekte sheep retroviruses associated with ovine pulmonary carcinoma from endogenous loci in the sheep genome[J].J Virol,1996,70(5):3159-3168.
[9]Palmarini M,Hallwirth C,York D,et al.M olecular cloning and functional analysis of three type D endogenous retrovirus of sheep reveal a different cell tropism from that of the highly related exogenous jaagsiekte sheep retrovirus[J].J Virol,2000,74(17):8065-8076.
[10]梁化春,齊景偉,劉淑英,等.綿羊肺腺瘤病的病理學及 RT-PCR診斷[J].中國預防獸醫學報,2009,31(6):443-447.
[11]Marcel D,Aurora O,Daniela S,et al.A PCR technique for the detection of Jaagsiekte sheep retrovirus in the blood suitable for the screening of ovine pulmonary adenocarcinoma in field conditions[J].Research in Res Vet Sci,2005,79(3):259-264.

