豬胸膜肺炎放線桿菌16S rDNA基因的克隆及序列分析
沈 萍,王喜軍
(1.湖南生物機(jī)電職業(yè)技術(shù)學(xué)院動(dòng)科系,湖南 長(zhǎng)沙 410127;2.長(zhǎng)沙市動(dòng)物防疫監(jiān)督站,湖南 長(zhǎng)沙 410012)
豬胸膜肺炎放線桿菌(APP)為革蘭氏陰性桿菌,可引起豬傳染性胸膜肺炎(porcine contagious pleuropneumoniae,PCP),該病由 Pattison 首次報(bào)道,現(xiàn)已在美國(guó)、墨西哥、瑞士、丹麥、澳大利亞、加拿大、泰國(guó)、韓國(guó)、日本等國(guó)家廣泛流行[1-2];該病在我國(guó)也早已廣泛存在,并有擴(kuò)大蔓延之勢(shì)。APP血清型較多,我國(guó)豬場(chǎng)中存在的就有 3、5、7、8、10 型,其中以3型和7型為最多[3]。發(fā)病時(shí),病豬出現(xiàn)心衰和循環(huán)障礙,精神委頓,食欲廢絕;晚期出現(xiàn)嚴(yán)重的體溫下降和呼吸困難;臨死前從嘴、鼻孔流出血性泡沫樣液體。病豬于發(fā)病后24~36 h內(nèi)死亡,死亡率高達(dá)80%~100%[4]。
16S rRNA為原核生物的一種核糖體RNA,在漫長(zhǎng)的生物進(jìn)化過(guò)程中,因其受到的選擇壓力小,基因序列變化緩慢,可以用來(lái)標(biāo)記生物的親緣關(guān)系和進(jìn)化距離;在結(jié)構(gòu)與功能上具有極為高度的保守性,素有“細(xì)菌化石”之稱[5]。鑒于APP有很多血清型,且各血清型之間缺乏相互的交叉保護(hù)性,很大程度就是因?yàn)槠洳煌逍偷耐饽さ鞍谆颉⒐δ芑虼嬖谝欢ú町悾虼耍x擇APP的16S rDNA基因設(shè)計(jì)引物,對(duì)在湖南分離到的長(zhǎng)沙(CS)株的16S rDNA基因進(jìn)行了克隆和測(cè)序;并與已報(bào)道的血清3、5、7型做序列比對(duì),進(jìn)行同源性分析。為APP分子流行病學(xué)調(diào)查、親緣性關(guān)系的研究提供資料,同時(shí)為APP的監(jiān)控奠定基礎(chǔ)。
1 試驗(yàn)部分
1.1 材料
1.1.1 病料來(lái)源 存于湖南生物機(jī)電職業(yè)技術(shù)學(xué)院動(dòng)科系動(dòng)物微生物實(shí)驗(yàn)室的豬胸膜肺炎放線桿菌病料。
1.2.1 引物設(shè)計(jì) 根據(jù)GenBank登錄的APP的16S rDNA基因序列,利用生物軟件Primer 5.0,設(shè)計(jì)1對(duì)特異性引物,擴(kuò)增片段長(zhǎng)度為827 bp,由南京金思特生物科技有限公司合成,合成后稀釋為終濃度20 pmol/L,置-20℃保存。
1.2 方 法
初代接種后24 h后加有V因子的副嗜血桿菌疫苗培養(yǎng)基上可觀察到呈圓形、中間有一灰白點(diǎn)、邊緣整齊、表面稍隆起、從針尖大小至直徑3 mm似露珠樣的菌落。顯微鏡下,細(xì)菌呈典型的革蘭氏陰性小球桿菌形態(tài),有莢膜,呈長(zhǎng)絲狀,有的成雙,有的成團(tuán)。
使用DNAStar分析軟件中的MegAlign程序,運(yùn)用Clustal V算法對(duì)所測(cè)序列與參考序列進(jìn)行比較并繪制和分析遺傳進(jìn)化樹(shù),同源性分析表明,分離得到的 4 株 CS1、CS2、CS3、CS4 株同源性為100%,筆者將得到4株共稱為CS株,與國(guó)外學(xué)者得到的血清3、5、7型同源性為99.4%~99.6%,與丹麥株同源性為100%;與李氏放線桿菌、脲放線桿菌、馬駒放線桿菌、莢膜放線桿菌同源性分別為97.8%、96.3%、97.3%、96.3%(見(jiàn)表1)。
1.1.2 主要試劑 蛋白酶K、Ex Taq酶、10×Mg2+、10×Buffer、dNTP、DL-2000 DNA Marker、瓊脂糖、E.B(寶生物工程(大連)有限公司);普通瓊脂糖凝膠DNA回收試劑盒、TIANgel Midi Purification Kit(天根公司);X-Gal、pGEM-T easy載體(Promega公司);工程菌JM109為本實(shí)驗(yàn)室保存;副嗜血桿菌疫苗培養(yǎng)基(長(zhǎng)沙佳和生物技術(shù)有限公司)。
分離得到的4個(gè)湖南CS株均能擴(kuò)增得到了約842 bp的目的DNA條帶(見(jiàn)圖1),與預(yù)期結(jié)果相符。
將擴(kuò)增的目的基因純化與克隆T載體連接,構(gòu)建重組質(zhì)粒pMD-T16S rDNA,轉(zhuǎn)化于工程菌JM109中,取1 μL菌液作擴(kuò)增模板進(jìn)行PCR鑒定,均能得到約842 bp的片段(見(jiàn)圖2)。說(shuō)明目的基因已克隆到載體中。
2 試驗(yàn)結(jié)果
2.1 菌落及細(xì)菌形態(tài)
1.2.2 細(xì)菌的培養(yǎng) 采集病豬的氣管、肺臟的病變組織,用生理鹽水浸泡后涂布于加有V因子的副嗜血桿菌疫苗培養(yǎng)基,37℃燭缸法培養(yǎng)24 h,觀察菌落形態(tài),并取單個(gè)菌落革蘭氏染色鏡檢觀察后保存。
2.2 分離株的PCR鑒定
1.2.4 pMD18-T載體克隆與序列測(cè)定 將純化產(chǎn)物按常規(guī)方法連接到pGEM-T中,轉(zhuǎn)化于工程菌JM109中,取50 μL轉(zhuǎn)化菌液均勻涂布于含氨節(jié)青霉素的LB平板,37℃培養(yǎng)16 h。培養(yǎng)后挑選白色的單菌落,對(duì)菌落進(jìn)行PCR鑒定,陽(yáng)性的克隆由南京金思瑞生物有限公司測(cè)序。應(yīng)用DNAStar分析軟件對(duì)測(cè)定的App 16S rRNA基因序列進(jìn)行分析和同源性分析,序列比較參考株毒株名(登錄號(hào))為:AF033059、CP000569、CP000687、CP001091、M350-17、M75067、M75072、M75075。
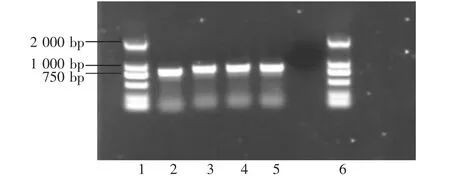
圖1 16S rRNA基因的擴(kuò)增
2.3 重組質(zhì)粒菌落的PCR鑒定
F:5-GGAGCTTGCTTTCTTTGCCGACG-3;R:5-TAACCTTGCGGCCGTACTCCC-3。

圖2 陽(yáng)性重組質(zhì)粒的PCR鑒定
2.4 測(cè)序結(jié)果分析
依據(jù)所建立的放線桿菌系統(tǒng)發(fā)育樹(shù)(見(jiàn)圖3),除去外群,CS株與丹麥株(AF033059)的遺傳距離最近,而且與血清3、5、7型處于一個(gè)相近的分支上。
2.5 系統(tǒng)進(jìn)化樹(shù)分析
“我把所有人都喝趴下,就為和你說(shuō)句悄悄話”,“我們總是發(fā)現(xiàn)以前的自己有點(diǎn)傻”,“低質(zhì)量的社交,不如高質(zhì)量的獨(dú)處”……這些印在江小白瓶身上的江小白語(yǔ)錄正是當(dāng)下80后、90后內(nèi)心真實(shí)的情感和態(tài)度表達(dá),借小白哥之口說(shuō)出,既使品牌形象立體化,也成功地走近消費(fèi)者,獲得其感情認(rèn)同并引發(fā)口碑傳播。
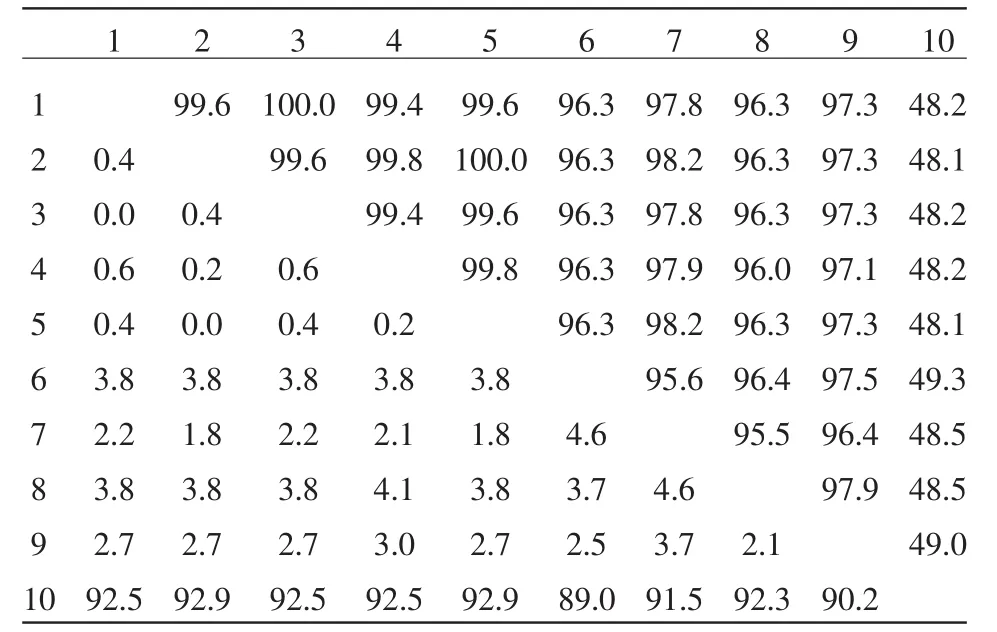
表1 核昔酸序列同源性分析
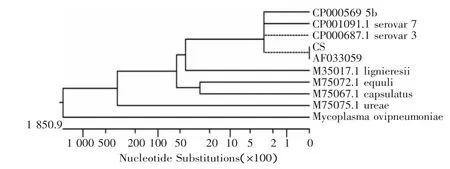
圖3 系統(tǒng)發(fā)育樹(shù)放線的基礎(chǔ)上的16S rRNA基因核苷酸序列
3 討論
豬傳染性胸膜肺炎是侵害豬呼吸道的主要傳染病之一,對(duì)養(yǎng)豬業(yè)危害極其巨大。該病是一種急性或慢性呼吸道疾病,以肺部纖維素性、壞死性和出血性肺炎為特征,具有高度的傳染性,各種年齡的豬對(duì)該病都為易感。國(guó)內(nèi)外對(duì)其4種毒素因子ApxI[6],ApxII[7],ApxIII[8]和 ApxIV[9]研究較多,主要集中于其抗原活性的研究;而本研究選取了APP的16S rDNA基因?yàn)檠芯繉?duì)象,填補(bǔ)了國(guó)內(nèi)APP基因分析的一個(gè)空白,因?yàn)閱渭儼凑占?xì)菌的形態(tài)和生化指標(biāo)等特征,已經(jīng)難以區(qū)分比如豬胸膜肺炎放線桿菌、李氏放線桿菌、脲放線桿菌、馬駒放線桿菌、莢膜放線桿菌這樣的親緣關(guān)系相近的菌株,不能保證分類的準(zhǔn)確性和科學(xué)性。
目前,16S rDNA已被作為一個(gè)分子指標(biāo),廣泛地應(yīng)用于各種細(xì)菌的系統(tǒng)進(jìn)化分析和分子差異的研究。這是因?yàn)?6S rDNA普遍存在于一切細(xì)菌內(nèi),生理功能穩(wěn)定,非常保守,具有良好的時(shí)鐘性質(zhì),可用它比較在進(jìn)化中的相互關(guān)系[10];而且大量已知細(xì)菌的16S rDNA序列都被測(cè)定并上傳至Gen-Bank,使細(xì)菌鑒定和分類擁有了非常有用的參照系統(tǒng)。人類對(duì)自然界存在的微生物多樣性的認(rèn)識(shí)還遠(yuǎn)遠(yuǎn)不夠,在今后相當(dāng)長(zhǎng)的時(shí)間內(nèi)以16S rDNA基因?yàn)榛A(chǔ)的群落結(jié)構(gòu)研究方法仍然是揭示和明確環(huán)境微生物群落結(jié)構(gòu)的主要手段。本研究獲得的豬胸膜肺炎放線桿菌CS株與李氏放線桿菌、脲放線桿菌、馬駒放線桿菌、莢膜放線桿菌同源性分別為97.8%、96.3%、97.3%、96.3%,都高于95%,與16S rDNA序列的相似性已成為劃分屬的標(biāo)準(zhǔn),屬內(nèi)同源性應(yīng)不低于95%這是一致的[11]。
朱小寧等[12-14]曾應(yīng)用16S rDNA基因分離鑒定了副豬嗜血桿菌獲得成功。本研究應(yīng)用16S rDNA作為放線桿菌的一個(gè)分子指標(biāo),結(jié)果提示分離得到的A.pleuropneumoniae CS株與國(guó)內(nèi)早期報(bào)道的存在A.pleuropneumoniae血清3、5、7型處于一個(gè)相近但不同的分支,提示國(guó)內(nèi)存在除血清3、5、7型外的A.pleuropneumoniae病原存在。研究結(jié)果為進(jìn)一步開(kāi)展分子流行病學(xué)調(diào)查及相關(guān)疾病的研究提供了依據(jù)。
[1] Bosse J T,Janson H,Sheehan B J,et al.Actinobacillus pleuropneumoniae:pathobiology and pathogenesis of infection[J].Microbes Infect,2002,4(2):225-35.
[2] 徐公義,王海麗,葛長(zhǎng)城,等.魯西地區(qū)豬胸膜肺炎放線桿菌流行病學(xué)調(diào)查[J].安徽農(nóng)業(yè)科學(xué),2009,37(13):6002-6004.
[3] Bhatia B,Mittal K R,F(xiàn)rey J.Factors involved in immunity against Actinobacillus pleuropneumoniae in mice[J].Vet Microbiol,1991,29(2):147-58.
[4] Enwick W,Osbum B.Immune responses to lipopoly saccharides and capsular polysaccharides of Haemophilus pleuropneumoniaein convalescent and immunized pigs[J].Ame Soc Microb,2006,54(2):577-582.
[5] Harmsen D,Karch H.16S rDNA for diagnosing pat hogens:aliving tree[J].A SM News,2004,70:19-24.
[6] Ramjeet M,Cox A D,Hancock M A,et al.Mutation in the LPS outer core biosynthesis gene,galU,affects LPS interaction with the RTX toxins ApxI and ApxII and cytolytic activity of Actinobacillus pleuropneumoniae serotype 1[J].Mol Microbiol,2008,70(1):221-235.
[7] Shin S J,Bae J L,Cho Y W,et al.Induction of antigen-specific immune responses by oral vaccination with Saccharomyces cerevisiae expressing Actinobacillus pleuropneumoniae ApxIIA[J].FEMS Immunol Med Microbiol,2005,43(2):155-64.
[8] Vanden B P G,Zecchinon L L,F(xiàn)ett T,et al.Porcine CD18 mediates Actinobacillus pleuropneumoniae ApxIII species-specific toxicity[J].Vet Res,2009,40(4):33.
[9] Wang C,Wang Y,Shao M.Positive role for rApxIVN in the immune protection of pigs against infection by Actinobacillus pleuropneumoniae[J].Vaccine,2009,27(42):5816-21.
[10] Barry T,Colleran G,Glennon M,et al.The 16s/23s ribosomal spacer region as a target for DNA probes to identify eubacteria[J].Applicat,1991,1(1):51-56.
[11] Rappe M S,Giovannoni S J.The uncultured microbial majority[J].Annu Rev Micmbiol,2003,57:369-394.
[12] 朱小寧,余興龍,李潤(rùn)成.副豬嗜血桿菌的分離與鑒定及其16S rRNA生物信息學(xué)分析 [J].湖南農(nóng)業(yè)大學(xué)學(xué)報(bào):自然科學(xué)版,2009,35(5):517-520.
[13] 劉俊偉,張慧輝,余 燕,等.豬瘟繼發(fā)副豬嗜血桿菌病的診斷與防治[J].湖南農(nóng)業(yè)科學(xué),2010,(11):128-130,133.
[14] 萬(wàn)世平,王 建,葛菲菲,等.副豬嗜血桿菌上海株的分離鑒定及耐藥特性的研究[J].廣東農(nóng)業(yè)科學(xué),2010,37(8):201-203.

