假絲酵母SSR-PCR反應體系的優化
孫曉紅,楊艷秋,賀 丹,張云峰,橫山耕治,王 麗*
(1.吉林大學白求恩醫學院病原生物學系,吉林長春130021;2.北華大學基礎醫學院;3.吉林大學第一醫院;4.日本千葉大學真菌醫學研究中心)
微衛星(Microsatellite)又稱為簡單序列重復(Simple sequence repeats,SSR),是指基因組中由l-6個核苷酸為基本單位的串聯重復序列構成的一段DNA。廣泛分布于真核生物基因組中,由于其在群體中的多態性高,且一般為共顯性遺傳,已成為一種很好的分子遺傳標記。目前在真菌的研究中,SSR主要用于種群遺傳多樣性、近緣種間及種內的系譜研究、基因分型等[1-4]。
近年來,醫院內真菌感染日益增多,且主要表現為條件致病真菌感染。其中,假絲酵母居于第一位,但在國內及國外的多項研究中,檢出的假絲酵母各菌種的構成比有很大差異[5,6]。為了追溯感染的來源,更有利于真菌感染的治療,有必要使用分子生物學方法對假絲酵母進行正確的鑒定。以PCR為基礎的SSR技術,因其對DNA質量要求不高及引物的通用性好等特點,對菌種的鑒定具有特殊意義[7,8]。本研究確定了SSR-PCR反應最適的退火溫度,利用正交實驗優化反應體系,建立了最佳的SSR-PCR反應體系。旨在為將該技術用于臨床假絲酵母感染的快速鑒定奠定基礎。
1 材料與方法
1.1 菌株
熱帶假絲酵母(Candidaparapsilosis)(JLCC33785)為SSR-PCR反應體系優化試驗菌株,所用菌株由吉林大學真菌研究中心菌種保藏中心(Culture Collection of Jilin University Mycology Research Center,JLCC)保藏。
1.2 主要試劑及儀器
SSR引物由本實驗室設計,寶生物(大連)工程有限公司合成;dNTP、Taq DNA聚合酶和DNA marker購自寶生物(大連)工程有限公司;美國ASTEC基因擴增儀PC-320。
1.3 基因組DNA提取
采用Gene TLETM酵母菌DNA快速抽提方法并進行改進[9]:①取 100-200 mg菌絲體,加入540 μ l SolutionⅠ ,混勻 ;②加入 60 μ l SolutionⅡ ,混勻 ,95 ℃金屬浴10 min;③加入300 μ l Solution Ⅲ,顛倒混勻,冰浴 2 min;④12 000 rpm 、4℃離心 10 min,取 600 μ l上清于一新EP管中;⑤加入等體積異丙醇,混勻,12 000 rpm、4℃離心 5 min,棄上清 ;⑥加入 200 μ l-20℃的70%冷乙醇洗滌,12 000 rpm、4℃離心5 min,棄上清;⑦沉淀物置于離心濃縮儀中真空干燥;⑧獲得的DNA,加入40 μ l ddH2O 溶解,-20℃保存備用。
1.4 PCR反應條件
根據引物Tm值,設立6個梯度的退火溫度,依次為 48℃、49℃、50℃、51 ℃、52℃、53℃。PCR 反應條件為94℃預變性2 min;94℃變性1 min,退火1 min,72℃延伸 90 s;40個循環,最后72℃延伸10 min,PCR產物4℃保存備用。取反應產物10 μ l,于1.5%的瓊脂糖凝膠電泳,EB染色30 min,置于凝膠成像系統下觀察拍照。
1.5 SSR-PCR反應體系的優化
以Taq DNA聚合酶、模板DNA、dNTP、引物為實驗因素,進行4因素3水平的正交實驗優化反應體系(表1),即選用L9(34)正交表進行9種組合的實驗(表2)。

表1 SSR-PCR反應體系正交實驗的水平和因素
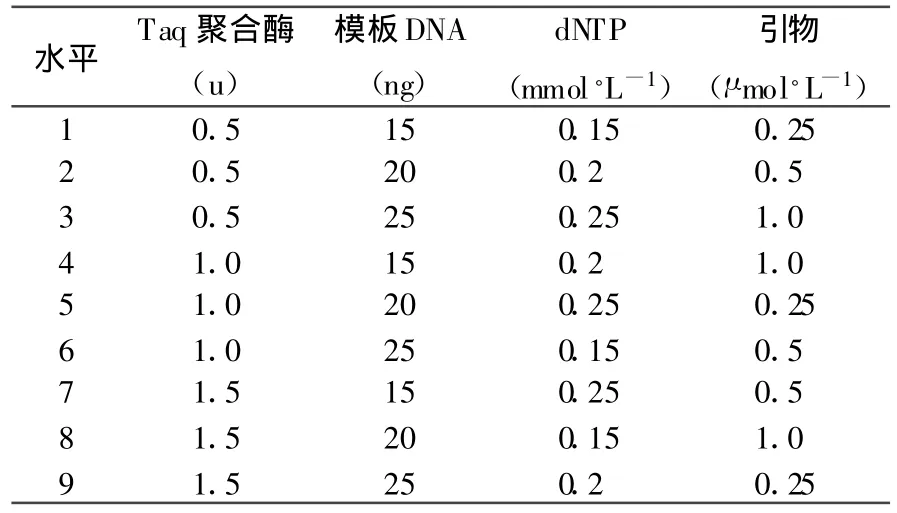
表2 SSR-PCR反應體系正交實驗設計表L9(34)
2 結果
2.1 退火溫度對SSR-PCR反應的影響
退火溫度將會直接影響PCR擴增的結果。為此,本研究根據理論Tm值將退火溫度分別設置為48℃、49℃、50℃、51℃、52℃、53℃。其結果明顯不同:泳道1、2、3擴增的非特異條帶多,背景彌散;泳道4擴增的條帶清晰,多態性好;泳道5擴增的條帶明亮,但多態性低;泳道6幾乎沒有擴增出條帶。所以選擇泳道4對應的51℃為最適退火溫度(圖1)。
2.2 正交實驗優化SSR-PCR反應體系
通過4因素3水平的正交實驗,共9種組合,對SSR-PCR反應體系進行了優化。每一組合的結果存在顯著差異,泳道1沒有擴增出條帶;泳道2擴增條帶弱;泳道3、4、8擴增的條帶較亮,但多態性低;泳道5、6、7、9擴增條帶均較清晰,多態性高,其中以泳道6的效果最好;對泳道5、6、7、9的反應體系進行比較,確定泳道6各因素濃度作為最佳的反應體系:25μ l SSR-PCR反應體系中,加入Taq DNA聚合酶1.0 u 、模板 DNA 為 25 ng、dNTP 為 0.15 mmol·L-1、引物為 0.5 μ mol·L-1(圖 2)。
2.3 模板濃度對SSR-PCR反應體系的影響
在正交實驗中確定了最佳的模板用量為25 ng,為3水平中的最高值。為了驗證SSR反應體系的靈敏度,設置了不同的模板梯度,依次為5 ng、10 ng、15 ng、20 ng、25 ng、30 ng、35ng。電泳結果表明,泳道1、2擴增的條帶相對較弱;泳道 3、4、5、6擴增的條帶較亮且清晰,且以泳道5、6擴增的效果好,這和正交實驗中確定的模板用量基本一致;泳道7擴增的條帶較亮,但多態性低(圖3)。
2.4 反應體系的穩定性驗證
使用優化的SSR-PCR反應體系及條件,對6株臨床分離鑒定的熱帶假絲酵母進行PCR擴增,1.5%瓊脂糖凝膠電泳后均得到明亮、清晰、多態性穩定的條帶,長度分別約為480 bp、750 bp、1750 bp,證實該體系具有較好的的穩定性(圖4)。
3 討論
SSR作為一種很好的分子遺傳標記,其高度的多態性優于 RFLP、重復性強于RAPD。對于SSRPCR技術,其結果多用聚丙烯酰胺凝膠電泳進行檢測,雖分辨率高,但操作復雜、成本較高。本研究使用SSR引物進行PCR擴增,采用1.5%的瓊脂糖凝膠電泳觀察結果,可得到清晰穩定的多態性條帶,操作簡單,在普通實驗室易于開展。
PCR反應受許多因素影響,退火溫度的高低會直接影響PCR擴增結果。溫度過低非特異條帶多,溫度過高會影響引物和模板的結合,甚至無PCR產物擴增。本研究設置48℃~53℃6個梯度的退火溫度,其中,51℃擴增的條帶清晰、明亮,將其作為最適的退火溫度。這說明每一引物,有其適宜的退火溫度。
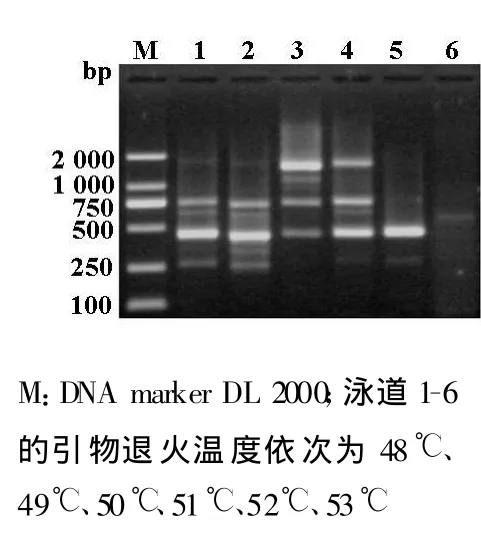
圖1 退火溫度對SSRPCR反應的影響
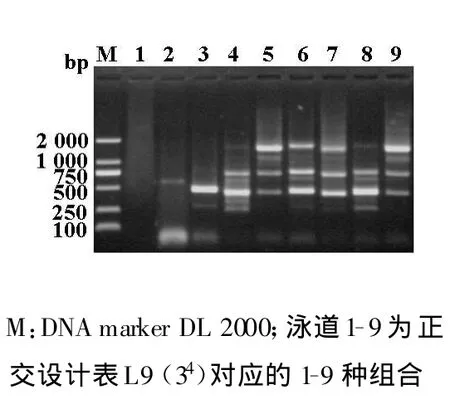
圖2 正交實驗SSR-PCR反應體系優化的電泳圖
圖3 模板濃度對SSR-PCR反應體系的影響
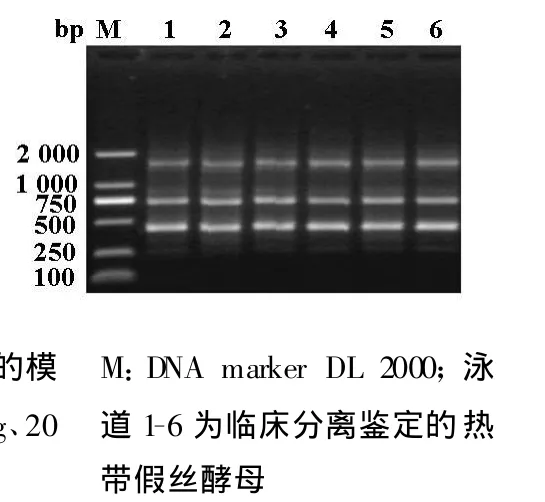
圖4 臨床菌株驗證反應體系的穩定性
本研究采用4因素3水平的正交實驗,對SSRPCR反應體系進行優化,建立了最佳的反應體系,在動態環境中考慮到PCR反應各因素的相互作用。因為各因素濃度過低時,可能無法擴增出產物;濃度過高時,非特異性條帶可能增多及出現彌散狀背景[10]。dNTP既是PCR反應的原料,又可以與PCR反應中的Mg2+結合,如 dNTP濃度過高,使Mg2+濃度下降而影響Taq DNA聚合酶的活力;另外,引物濃度過高,易引起非特異性擴增及形成引物二聚體[11]。從節約的角度考慮,只要能擴增出清晰、明亮、穩定、多態性高的條帶,Taq DNA聚合酶、模板DNA、dNTP、引物的用量應越低越好,在圖 2中,泳道 5、6、7、9擴增的條帶均較亮且清晰,但綜合考慮各因素的濃度,選擇泳道6對應的各因素濃度作為最佳的SSR-PCR反應體系。
在確定的最佳SSR-PCR體系中,模板DNA為25 ng,為3水平中的最高值。所以我們又設置7個梯度的模板濃度,濃度為5 ng-30 ng時,基本上均可得到清晰的電泳條帶。這說明模板濃度對該反應的影響不大及PCR反應的高靈敏性,也證實通過變換某單一因素而固定幾種其他因素來確定PCR反應體系的局限性。
綜上分析,采用正交實驗優化的SSR-PCR反應體系,操作簡便,電泳條帶清晰,多態性好,重復性強。為將本實驗室設計的SSR引物,進一步用于假絲酵母的鑒定奠定基礎。
[1]Giraud T,Fournier E,Vautrin D,et al.Isolation of 44 polymorphic microsatellite loci in three host races of the phytopathogenic fungus Microbotryum violaceum[J].Molecular Ecology Notes.2002,2(2):142.
[2]Barve MP,Haware MP,Sainani MN,et al.Potential of microsatellites to distinguish four races of Fusarium oxysporum f.sp.ciceri prevalent in India[J].Theoretical and Applied Genetics,2001,102(1):138.
[3]Dea Garcia-Hermoso,Odile Cabaret,Gael Lecellier,et al.Comparison of Microsatellite Length Polymorphism and Multilocus Sequence Typing for DNA-Based Typing of Candida albicans[J].Journal of ClinicalMicrobiology,2007,45(12):3958.
[4]Brent A.Lasker,Geraldine Butler,andTimothy J.Lott.Molecular Genotyping of Candida parapsilosis Group I Clinical Isolates by Analysis of Polymorphic Microsatellite Markers[J].Journal of Clinical Microbiology,2006,44(3):750.
[5]方 芳,伊和姿,吳麗桂.危重病人203例深部真菌感染的調查研究[J].皮膚病與性病,2005,27(1):6.
[6]Agarwal J,Bansal S,Malik GK,et al.Trends in neonatal septicemia:emergence of non-Candida albicans[J].Indian Pediatr,2004,41(7):712.
[7]Meyer W&Mitchell TG.Polymerase chain reaction fingerprinting in fungi using single primers specific to minisatellites and simple repetitive DNA sequences:strain variation in Cryptococcus neoformans[J].Electrophoresis,1995,16(9):1648.
[8]Barada G,Basma R,Khalaf RA.Microsatellite DNA identification and genotyping of Candida albicans from Lebanese clinical isolates[J].Mycopathologia,2008,165(3):115.
[9]Wang L,Yokoyama K,Miyaji M,et al.Mitochondrial cytochrome b gene analysis of Aspergillus fumigatus and related species[J].J Clin Microbiol,2000,38(4):1352.
[10]張文娜,王 憶,孔 瑾,等.甜櫻桃品種SSR-PCR反應體系的優化[J].生物技術通報,2009,11:103.
[11]韓加軍,林英任,劉艷兵,等.散斑殼屬ISSR-PCR反應條件的優化[J].微生物學雜志,2008,28(1):20.

