黃姑魚幼魚繼饑餓后補償生長的研究
史會來,耿 智,樓 寶,毛國民,薛寶貴,詹 煒,徐冬冬
(1.浙江海洋學院海洋與漁業研究所,浙江省海洋水產研究所,浙江省海水增養殖重點實驗室,浙江舟山 316100;2.浙江海洋學院,浙江舟山 316004)
近年來,國內外許多學者對饑餓條件下魚類生理生態學變化和能量代謝及其恢復進食后的生長現象進行了深入研究[1-8]。魚類繼饑餓后的補償生長現象已在石首魚科、鮭科、鯉科、鱈科、鰈科、麗魚科、鲴科、鰨科、鲆科、刺魚科中的近30種魚中被發現,其中絕大多數研究表明經過環境(食物和溫度等)脅迫的魚可表現出不同程度的補償生長。但有關黃姑魚饑餓后的補償生長研究還未見公開報道。
黃姑魚Nibea albiflora,俗稱黃婆雞,屬鱸形目、石首魚科、黃姑魚屬,體形與黃花魚有相似處,黃姑魚為近海中下水層魚類,主要棲息于砂泥底質較淺沿岸海域,以小型甲殼類及小魚等底棲動物為食。分布于西北太平洋區,包括中國南海、東海及黃海南部,是我國東南沿海養殖的理想品種[9-10]。目前,有關黃姑魚的研究已有一些報道,主要集中在胚胎、仔稚魚發育、人工繁育和養殖等方面[10-16],本文報道了黃姑魚幼魚在不同的饑餓時間后恢復投喂過程中攝食、生長、體組成變化,以期為黃姑魚養殖中餌料投喂提供科學依據。
1 材料與方法
1.1 材料
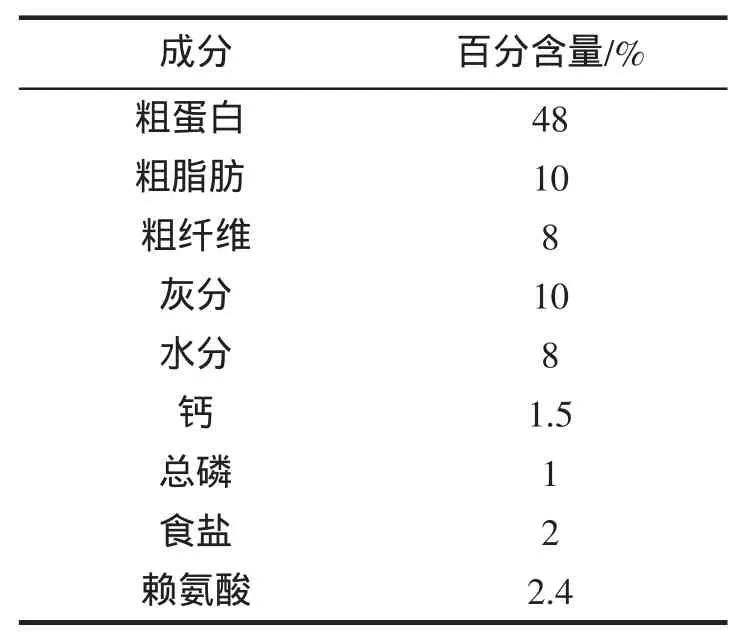
表1 實驗飼料營養組成Tab.1 The nutrution composition of feed in the present experiment
室內養殖實驗在浙江省海洋水產研究所西閃實驗場進行,所用的黃姑魚為該場自行繁殖的幼魚。實驗前先選取健康魚種600尾,暫養于室內10 t水泥池中,每天早、晚2次投喂配合飼料,飼料為寧波天邦股份有限公司生產的海水魚類全價配合飼料(表1)。待攝食和生長正常后,選取大小相近的魚480尾,按30尾/缸的密度在16個實驗玻璃鋼水槽(有效水體0.8 m3)內繼續馴養2周。實驗過程中使用經沉淀和沙濾后的自然海水,鹽度為26.0~27.5,溫度為 26~28 ℃,日換水量為 200%。
1.2 方法
實驗中設5個食物處理組,其中4組魚分別饑餓4 d(S4組)、8 d(S8組)、12 d(S12組)和16 d(S16組)后再恢復正常投喂;另外1組魚在實驗期間始終正常投喂作為對照(S0組)。另設一持續饑餓取樣組,實驗周期為40 d。
實驗開始時將馴養的魚停喂24 h,然后每次隨機取25尾魚,稱重,隨機放入16個實驗桶中,每組處理設3個重復。實驗魚初始體重為(7.18±0.49)g/尾(平均值±標準差)。放養結束后從剩余的馴養魚中隨機取3組魚(3尾/組),稱重去內臟后在-20℃下保存以待分析其化學組成。S4~S16組在饑餓處理結束時,分別從取樣組中隨機取魚3尾;實驗結束后,從每個處理組中隨機取3尾。稱重去內臟后在-20℃下保存以待分析其化學組成。
在實驗開始、饑餓處理結束以及實驗過程中每8 d分別測定各組魚體重、攝食量和殘餌量。
1.3 樣品分析
將實驗過程中所取的魚體樣品在70℃下烘干至恒重,根據烘干前后的重量差異計算水分含量;粗蛋白含量用半微量凱氏定氮法測定;粗脂肪含量用Soxtec抽提法(以乙醚為抽提溶劑)測定;將樣品在550℃下灼燒至恒重,根據灼燒前后重量損失計算灰分含量。
1.4 數據計算與統計分析
魚體饑餓過程中體重損失率、恢復生長后每尾魚的特定生長率(SGR)、攝食率(FR)和食物轉化效率(FCE)分別用以下公式計算:
體重損失率(%)=100×(W0-W1)/W0
SGR(%/d)=100×(LnW2-LnW1)/t
FR(%/d)=100×C/[t×(W1+W2)/2]
FCE(%)=100×(W2-W1)/C
其中:W0、W1和W2分別為饑餓處理開始、恢復生長開始和恢復生長結束時實驗魚的體重(g),C為總攝食餌料量(g),t為恢復生長時間(d)。
同一水槽實驗數據(平均值)作為一個樣本值,實驗數據用SPSS13.0軟件進行方差分析,以鄧肯多重比較方法檢驗組間差異,P<0.01為差異極顯著,P<0.05為差異顯著。
2 結果
2.1 饑餓和恢復投喂過程中體重變化
實驗期間 S0、S4、S8、S12和 S16組成活率分別為(87.7±5.1)%、(86.7±3.1)%、(84.4±4.5)%、(82.2±5.1)%和(81.1±5.1)%,各組間魚成活率無顯著差異(P>0.05)。體重變化見表2,實驗開始時(饑餓處理前),實驗魚平均體重為 7.18±0.49 g,各實驗組魚體重間無顯著性差異(P>0.05)。饑餓結束時 S4組體重為 6.86 g,體重損失率達 2.83%;S8組體重為 6.76 g,體重損失率達 4.65%;S12組體重為 6.54 g,體重損失率達 6.33%;S16組體重為6.78 g,體重損失率達6.98%。饑餓后各處理組體重均降低,并且隨著饑餓時間的延長體重損失率逐漸增大,除 S12和 S16組間無顯著性差異外(P>0.05),其他各組間均出現了極顯著差異(P<0.01)。實驗第8 d 結束時 S0、S4和 S8組體重分別為 11.24 g、8.96 g 和 6.76 g,S0組顯著高于 S4和 S8組,各組間存在極顯著性差異(P<0.01);實驗第 16 d 結束時 S0、S4、S8、S12和 S16組分別為 12.16 g、10.73 g、7.06 g、6.67 g 和 6.78 g,S0組顯著高于其他組(P<0.01),S8、S12和 S16組間無顯著差異(P>0.05);實驗第 24 d 結束時 S0、S4、S8、S12和 S16組分別為 16.51 g、15.78 g、12.30 g、9.83 g 和 8.43 g,S0和 S4組顯著高于其他組(P<0.01),兩組間無顯著性差異(P>0.05),其他各組間差異顯著(P<0.01);實驗第 32 d 結束時 S0、S4、S8、S12和 S16組分別為 21.76 g、20.13 g、16.56 g、12.87g 和 12.22 g,S0和 S4組顯著高于其他組(P<0.01),兩組間無顯著性差異(P>0.05),S12和 S16組顯著低于其他各組(P<0.01),兩組間無差異(P>0.05);實驗結束時 S0、S4、S8、S12和 S16組分別為24.81 g、23.53 g、19.58 g、15.40 g和 15.23 g,S0和 S4組顯著高于其他組(P<0.01),兩組間無顯著性差異(P>0.05),S12和 S16組顯著低于其他各組(P<0.01),兩組間無差異(P>0.05)。

表2 黃姑魚饑餓及恢復生長過程中的體重變化(平均值±標準差)Tab.2 The weight changes of Nibea albiflora during starvation and after recovery growth(mean±S.D.n=3)
2.2 饑餓和恢復投喂過程中魚體生化組成變化
饑餓過程中魚體生化組成發生改變,魚體的水分含量隨饑餓時間延長而增加,從73.4%升至75.9%,S12和 S16處理組顯著高于其他組(P<0.05),實驗結束時各實驗組魚體水分含量無顯著差異(P>0.05)(圖1-A);蛋白質含量隨饑餓時間延長而下降,從 19.5%降至 17.8%,S12和 S16組顯著低于對照組(P<0.05),實驗結束時各實驗組魚體蛋白質含量無顯著差異(P>0.05)(圖1-B);脂肪隨饑餓時間延長而迅速下降,從1.60%降至 0.31%,各組間均存在顯著差異(P<0.05),實驗結束時各實驗組魚體脂肪含量無顯著差異(P>0.05)(圖1-C);灰分含量饑餓時間延長略有增加,從5.40%升至6.07%,各實驗組間無顯著性差異,實驗結束時各實驗組魚體灰分含量無顯著性差異(P>0.05)(圖-D)。
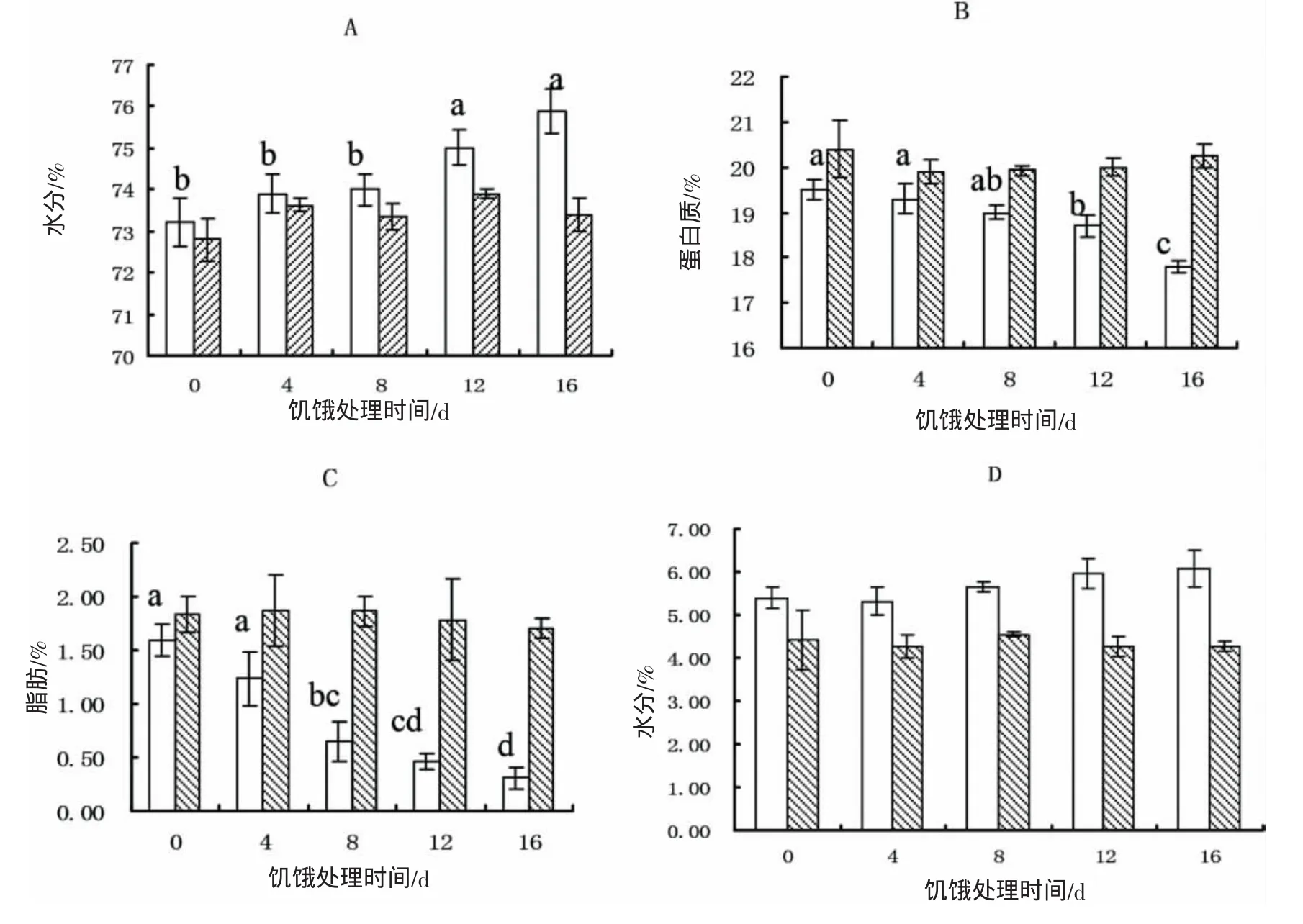
圖1 黃姑魚幼魚在饑餓后(白色)及恢復投喂后(黑色)身體組成的變化Fig.1 The changes of biochemical compositions in Nibea albiflora after starvation(white)and recovery growth(black)
2.3 饑餓和恢復投喂過程中特定生長率、攝食率和食物轉化率的變化
SGRW變化:實驗期間,S0組的SGRW變化較小,饑餓組的變化較大(表3)。S4組的SGRW隨著恢復投喂時間的延長逐漸降低,1~24 d 的 SGRW顯著高于 S0組(P<0.05),之后與 S0組無顯著性差異(P>0.05);S8組SGRW隨著恢復投喂先增高后降低,1~16 d的SGRW顯著低于S0組,1~24 d的SGRW顯著高于S0組(P<0.05),之后與 S0組無顯著性差異(P>0.05);S12和 S16組的 SGRW變化趨勢相似,隨著恢復投喂時間的延長逐漸增加,S12組1~16 d和S16組1~24 d的SGRW均顯著低于S0組(P<0.05),之后與S0組無顯著性差異(P>0.05)。
FR變化:實驗期間,S0組的FR變化較小,饑餓組的變化較大(表2)。S4組的FR隨著恢復投喂時間的延長逐漸降低,1~24 d 的 FR 顯著高于 S0組(P<0.05),之后與 S0組無顯著性差異(P>0.05);S8和 S12組 1~16 d 的 FR 與 S0組無顯著性差異(P>0.05),S8組 1~32 d 的 FR 顯著高于 S0組(P<0.05),之后與 S0組無顯著差異(P>0.05),S12組 1~40 d 的 FR 與 S0組仍有顯著差異(P<0.05);S16組 1~32 d 的 FR 與 S0組無顯著性差異(P>0.05),之后與 S0組差異顯著性(P<0.05)。
FCE變化:實驗期間,FCE的變化趨勢與FR相似。S4、S8和S12組在恢復喂食后的開始階段FCE均顯著的高于S0組(P<0.05),隨著恢復投喂時間的延長,FCE開始下降,在實驗結束時與S0組無顯著性差異(P>0.05)。S16組 1~24 d 的 FCE 顯著的低于 S0組 (P<0.05),隨著恢復投喂時間的延長,FCE 開始升高,結束時與對照間無顯著性差異(P>0.05)。
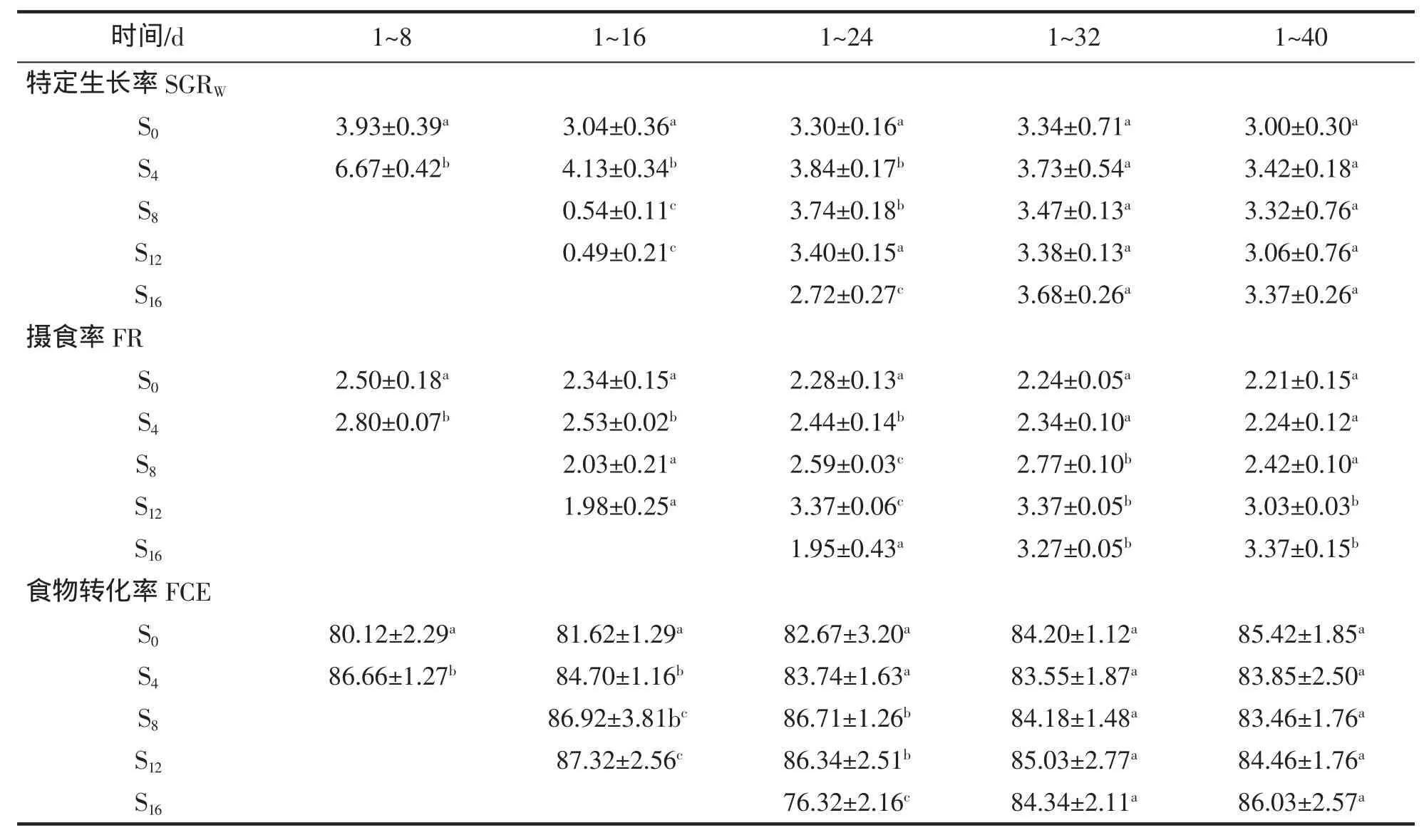
表3 實驗過程中黃姑魚SGR(%/d)、FR(%/d)和FCE(%)(平均值±標準差)的變化Tab.3 Changes of SGR(%/d)、FR and FCE in Nibea albiflor during experiment(mean±SD)
3 討論
本實驗中,雖然S4和S8組的SGRW1~24 d顯著高于S0組,但實驗結束時S4組體重與S0組無顯著差異,S8組顯著低于S0組,S12和S16組的SGRW和實驗結束時體重顯著低于S0組,S4組出現了完全補償生長的效應,S8組出現了部分補償生長效應,S12和S16組,未出現補償生長效應。
通常情況下魚類補償生長強度隨饑餓時間延長而增加[8],但本實驗研究結果顯示,S4組饑餓處理后恢復投喂的前20天SGRW顯著高于S0組,之后與S0組無顯著差異;S8組饑餓處理后恢復投喂的前8天SGRW顯著低于S0組,隨后顯著高于S0組,16天之后與S0組無顯著差異;S12和S16組饑餓后恢復投喂的SGRW一直顯著低于S0組,補償生長強度并未隨著饑餓處理時間的延長而增強,與王巖等的報道不同,這可能與本實驗魚的體重較小(僅為7.18±0.49 g)有關,12 d和16 d的饑餓處理強度已超過魚體的承受范圍。另有研究表明,經過食物限制后魚類補償生長可持續約1~3周[17-19],在本實驗中,S4組恢復投喂后的前20 d SGRW顯著高于S0組,S8組恢復投喂后的前16 d SGRW顯著高于S0組,黃姑魚幼魚的補償生長效應產生在恢復投喂后的2~3周,與WIESER等的研究結果一致[17-19]。
魚類在補償生長階段是否會改善對食物利用效率至今存在不同的結論。經過饑餓的雜交斑點叉尾鮰Ictalurus punctatus[3]、南方鲇 Silurus meridionalis[5]和羅非魚 Oreochromis mossambicus×O.niloticus[8]等在恢復喂食期間攝食量明顯增加,但對食物的利用效率未出現明顯變化;經過饑餓的大西洋鱈Gadus morhua[20]、黑鯛Sparus macrocephalus[21]和虹鱒Salmo gairdneri[1]等在恢復喂食期間除增加攝食量外,食物利用率也得到明顯的改善。本實驗中,出現補償生長效應的S4和S8組恢復投喂后的FR和FCE均大于S0組。黃姑魚的補償生長效應主要是通過提高攝食水平和提高食物轉化率來共同實現的,與樓寶等研究結果一致[1,20-21]。
樓寶和姜志強等對黑鯛[21]、日本黃姑魚[22]和美國紅魚[23]的研究表明:饑餓后魚體內的粗蛋白和粗脂肪含量會下降,水分和灰分含量會升高,恢復投喂后魚體的生化成分無顯著變化。本實驗中魚體粗蛋白質和粗脂肪含量隨饑餓時間延長顯著下降,水分和灰分含量升高,恢復投喂后與對照組無顯著差異,饑餓后再恢復投喂不會影響黃姑魚幼魚的營養質量,這與姜志強和樓寶等的研究結果一致。
本實驗結果顯示:對于體重7~10 g的黃姑魚幼魚,采用饑餓4 d后恢復投喂20 d的投喂方法可提高飼料利用率而不會明顯影響魚的生長,同時降低養殖管理成本,適度饑餓后再恢復投喂會增強魚的食欲。因此,按一定規律采用饑餓后恢復投喂的策略應為黃姑魚養殖有益的飼養管理措施。
[1]DOBSON S H,HOLMES R M.Compensatory growth in the rainbow trout,Salmo gairdneri Richardson[J].J Fish Biol,1984,25:649-656.
[2]MIGLOVS I,JOBHNG M.Effects of feeding regime on food consumption,growth rates and tissue nucleic acids injuvenile Arctic char,Salvelinus alpinus[J].Fish Biol,1989,34:947-957.
[3]KIM M K,LOVELL R T.Effect of restricted feeding regimes on compensatory weight gain and body tissue changes in channel catfish Ictaluruspunctatus in pond[J].Aquaculture,1995,135:285-293.
[4]孔令軍,王 巖,李 翠,等.網箱養殖鮸狀黃姑魚停喂不同時間后的補償生長[J].中國水產科學,2006,13(4):591-596.
[5]鄧 利,張 波,謝小軍.南方鲇繼饑餓后的恢復生長[J].水生生物學報,1999,23(2):167-173.
[6]張 波,孫 耀,唐啟升.饑餓對真鯛生長及生化組成的影響[J].水產學報,2000,24(3):206-210.
[7]謝小軍,鄧 利,張 波.饑餓對魚類生理生態學影響的研究進展[J].水生生物學報,1998,22(2):181-189.
[8]王 巖,崔正賀.魚類補償生長研究中的幾個問題[J].上海水產大學學報,2003,12(3):260-264.
[9]朱元鼎,張春霖,成慶泰.東海魚類志[M].北京:科學出版社,2005:277-278.
[10]樓 寶,史會來,毛國民,等.黃姑魚全人工繁育及大規格苗種培育技術研究[J].現代漁業信息,2011,26(3):20-23.
[11]蔡厚才,林歸璇,陳傳再.南極海區黃姑魚網箱養殖技術研究[J].浙江海洋學院學報:自然科學版,2001,20(1):66-70.
[12]雷霽霖,樊寧臣,鄭澄偉.黃姑魚(Nibea albiflora Richardson)胚胎及仔、稚魚形態特征的初步研究[J].海洋水產研究,1981,4(2):77-88.
[13]余方平,孫 忠,程國寶.舟山近海黃姑魚胚胎發育及前期仔魚形態的觀察[J].浙江海洋學院學報:自然科學版,2005,27(4):265-271.
[14]陳 超,徐延康,雷霽霖.黃姑魚人工育苗初步研究[J].水產科學,1989,8(1):7-11.
[15]雷霽霖,陳 超,徐延康,等.黃姑魚工廠化育苗技術研究[J].海洋科學,1992,11(6):5-10.
[16]孫 忠,余方平,程國寶.舟山近海黃姑魚室內全人工育苗技術研究[J].浙江海洋學院學報:自然科學版,2005,24(1):27-47.
[17]WANG Y,CUI Y,YANG Y,et al.Compensatory growth in hybird tilapia,Oreochromis mossambicus×O.niloticus,reared in seawater[J].Aquaculture,2000,189:101-108.
[18]WIESER W,KRUMSCHNALBEL G,OJWANG-OKWOR J P.The energetics of starvation and growth after refeeding in juveniles of three cy pinid species[J].Environ Biol Fish,1992,33:63-71.
[19]RUSSELL N R,WOOTTON R J.Appetite and growth compensation in the European minnow,Phoxinus phoxinus(Cyprinidae)following short periods of food restriction[J].Environ Biol Fish,1992,34:277-285.
[20]JOBLING M,MELY O H,DOS SANTOS J,et al.The compensatory gorowth response of the Atlantic cod:Effects of nutritional history[J].Aquac Intern,1994,2:75-90.
[21]樓 寶,史會來,駱季安,等.黑鯛幼魚繼饑餓補償生長的研究[C]//2008年全國海水養殖學術研討會論文集.北京:海洋出版社,2009:381-389.
[22]樓 寶,史會來,胡則輝,等.饑餓和再投喂對日本黃姑魚生長及其體生化組成的影響[J].水生生物學報,2008,32(2):280-285.
[23]姜志強,賈澤梅,韓延波.美國紅魚繼饑餓后的補償生長及其機制[J].水產學報,2002,26(1):66-72.

