L-亮氨酸-U-13C6 的研制
張 亮,杜曉寧,李良君
(上海化工研究院 上海穩定同位素工程技術研究中心,上海 200062)
隨著后基因組計劃的到來,蛋白質組研究成為生命科學的最前沿。在用核磁共振(NMR)研究蛋白質結構以及定量蛋白質組學方面,13C標記的氨基酸和蛋白質都大有用武之地,已成為蛋白質組學領域不可或缺的重要工具[1]。13C標記L-亮氨酸產品在醫藥工業、生命科學、食品工業、分析測試等相關領域的廣泛應用,特別是在醫療領域,其作用越來越突出。近年來,國內一些大醫院也已開始利用13C標記L-亮氨酸對多種疾病進行診斷、治療。如:北京協和醫院利用13C標記的L-亮氨酸進行呼氣實驗[2],以判斷氨基酸在腸道內的吸收是否異常,是否患有蛋白質吸收不良癥;還可以通過給予口服氨基酸判斷進行營養學治療的可能性。天津第二醫科大學附屬醫院以13C標記亮氨酸作為示蹤劑跟蹤蛋白質代謝是否異常,以此作為判斷癌癥的依據之一[3]。利用13C標記亮氨酸進行醫學研究更是不勝枚舉,如手術前后采用靜脈輸入13C標記亮氨酸的方法進行蛋白動力學研究[4],以亮氨酸-13C作為示蹤劑測定兔子燒傷后整體蛋白代謝水平的改變[5]等。而這些13C標記L-亮氨酸試劑均從國外進口,昂貴價格。本工作擬通過生物發酵法,自行研制L-亮氨酸-U-13C6。
1 材料與方法
1.1 主要儀器設備
SCS-24型巡回式自動搖瓶機:上海市離心機械研究所提供;LS-B50L高壓蒸汽滅菌鍋:上海醫用核子儀器廠提供。
1.2 主要試劑
13C標記葡萄糖:上海化工研究院自制;葡萄糖:AR級,中國醫藥集團上海化學試劑公司;H+型732陽離子交換樹脂:上海樹脂廠。
2 實驗方法
2.1 培養基配方(g/L)
活化斜面培養基:葡萄糖1g/L、蛋白胨10g/L、牛肉膏10g/L、酵母膏5g/L、NaCl 2.5 g/L、瓊脂條20g/L、pH7.0~7.2。在121℃下滅菌20min。
種子培養基:葡萄糖5g/L、蛋白胨10g/L、牛肉膏10g/L、酵母膏 5g/L、NaCl 2.5g/L、pH 7.0~7.2。在121℃下滅菌20min。
2.2 誘變選育
2.2.1 紫外誘變
取1環菌體,接種于液體完全培養基,在28℃下振蕩(100r/min)培養9~10h。用滅完菌的移液器取1mL培養液,用無菌生理鹽水稀釋10倍后均勻涂布于保藏平板上,放入紫外照射箱進行誘變,誘變時間為30~100s。
2.2.2 DES誘變
取1環菌體,接種于種子培養基中,振蕩培養6h,取10mL菌液,離心、去上清夜,菌體用磷酸緩沖液洗滌2次,之后加入一定量磷酸緩沖液配成菌液。向菌液中加入0.2mL DES誘變劑,攪拌誘變30min。用硫代硫酸鈉溶液終止誘變。
2.2.3 紫外與DES復合誘變
將DES誘變完的菌體再進行紫外誘變,誘變條件與2.2.1節及2.2.2節相同。
2.2.4 營養缺陷型菌株的篩選
根據育種目標,本工作要選出“Met-+Ile-”突變株,即挑選僅能在添加蛋氨酸和異亮氨酸的平板上生長的突變株[6,7]。
2.2.5 抗性菌株的篩選
選育抗性突變株,可以解除亮氨酸合成途徑上關鍵酶及限速酶的反饋抑制及反饋阻遏作用,進一步提高產酸累積量。通過在活化培養基中加入不同濃度不同種類的抗性藥物制成抗性藥物平板,將誘變后的突變株接入其中,挑選能夠在高抗性藥物濃度下生長的菌株。
2.3 發酵培養
2.3.1 種子液培養[8]
取1環活化后的菌體接入裝有25mL種子培養基的500mL三角瓶中,9層紗布封口,30℃下,于巡回式搖瓶柜中培養15h,振搖速度為200r/min。
2.3.2 搖瓶發酵培養[9]
用移液槍取3mL上述培養好的種子液接入裝有20mL發酵培養基的500mL三角瓶中,9層紗布封口,28℃下于巡回式搖瓶柜中培養,振搖速度為200r/min。培養期間定其檢測殘糖,當殘糖下降到1%以下時,發酵反應停止。
2.4 提取方法
采用離子交換(732陽離子樹脂)法進行分離,通過氯化銨、氨水兩步洗脫法進行分離[10]。
2.5 分析方法
采用氨基酸自動分析儀[11]測定發酵液產酸量;采用凱氏定氮法測定L-亮氨酸純度;采用同位素質譜儀測定13C豐度。
3 結果與討論
3.1 目的突變株TS151的誘變選育[12]
育種譜圖中各菌株的氨基酸積累情況列于表1。由表1可以看出,通過數次誘變選育,出發菌株ACTT39106逐漸帶上蛋氨酸缺陷(Met- )、異 亮 氨 酸 缺 陷 (Ile- )和 帶 磺 胺 胍(SGr)、α-氨基丁酸(α-ABr)、β-羥基亮氨酸(β-HLr)抗性標記等5種遺傳標記,產酸也從原來的幾乎沒有提高到18.2g/L,滿足了高豐度生產的需求。
3.2 目的突變株TS151的遺傳穩定性檢測
將高產菌株TS139和TS151在完全液體培養基上連續搖瓶培養10代。取第10代菌液用平板劃線分離單菌落后轉接斜面[13]。取斜面培養物制成經離心洗滌過的菌懸液。用濾紙片法驗證缺陷型標記[14];各取0.2mL菌液均勻涂布在各個藥物平板表面。28℃恒溫培養72h,觀察濾紙片周圍和藥物平板上有無菌體生長及生長情況,結果列于表2。
表2數據表明:TS139和TS151兩株菌仍為雙缺陷;TS139在8g/L磺胺胍抗性平板、8 g/Lα-氨基丁酸抗性平板上,TS151在8g/Lα-氨基丁酸抗性平板、4g/Lβ-羥基亮氨酸抗性平板上,均長出大小一致的小菌落。對每株菌隨機挑取5個菌落的少量菌體涂片,用革蘭氏染色,光鏡下檢查。結果顯示,菌體形態與原始菌株ATCC39106的一致。
3.3 發酵工藝的優化
3.3.1 發酵配方的優化
1)不同氮源對L-亮氨酸發酵的影響
在發酵培養基中分別以硫酸銨、醋酸銨、尿素、硝酸銨和氯化銨(以硫酸銨用量為4%時的含氮量0.85g來計算其它氮源的添加量)為氮源培養36h,觀察氮源對發酵的影響,結果列于表3。從表3可以看出,以醋酸銨為氮源時L-亮氨酸產量最高,其次為硫酸銨。醋酸銨在發酵中不僅起著氮源的作用,同時其醋酸根離子也參與了亮氨酸的合成代謝。
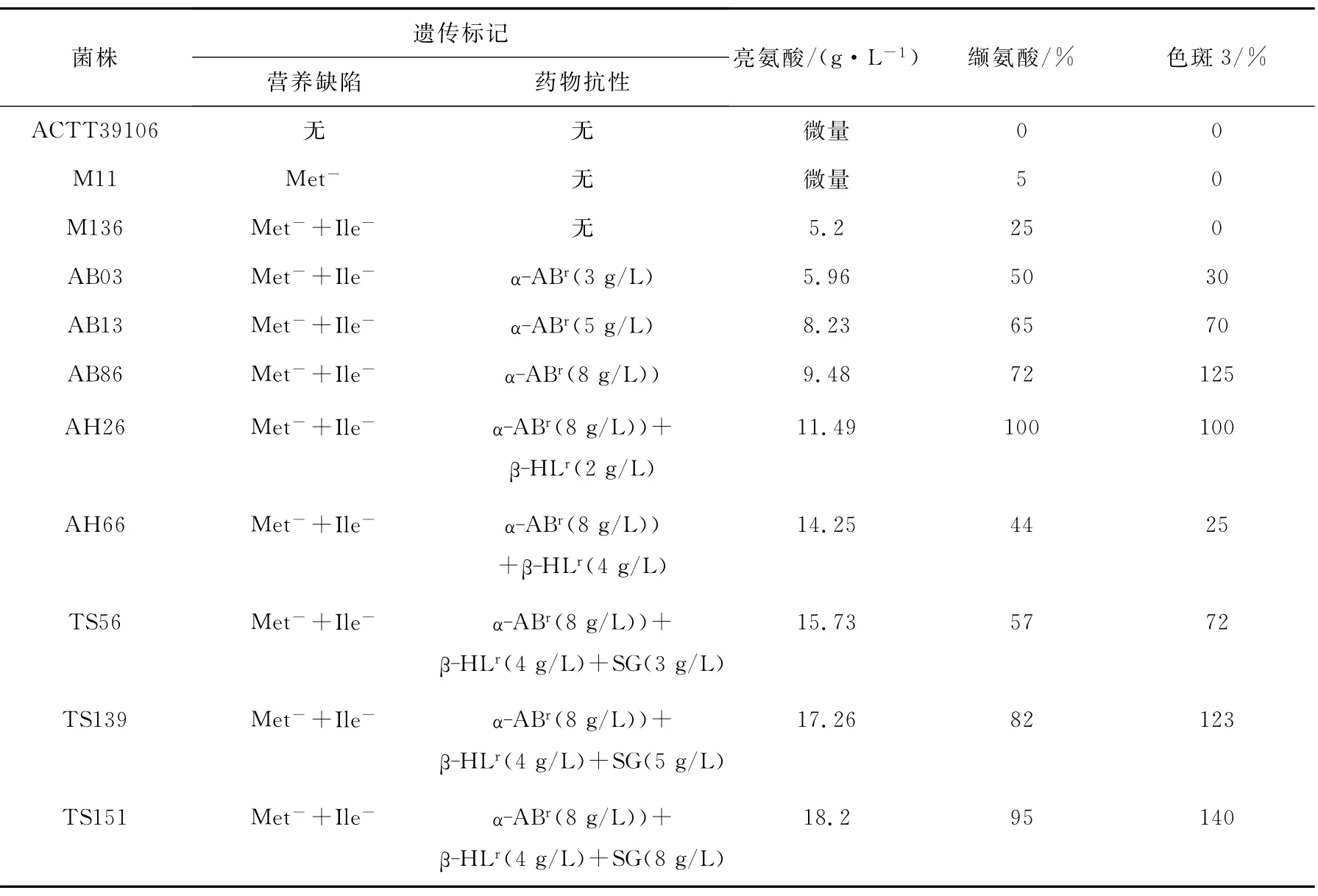
表1 育種譜圖中各菌株的氨基酸積累情況
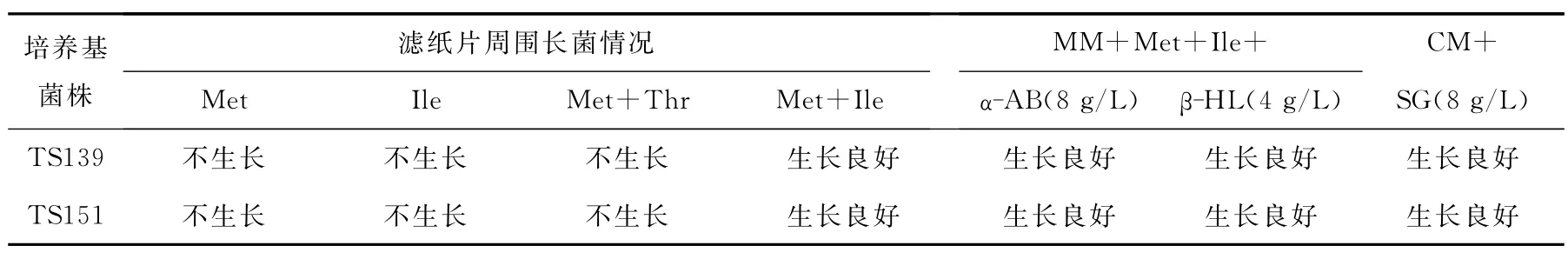
表2 遺傳標記穩定性檢驗結果
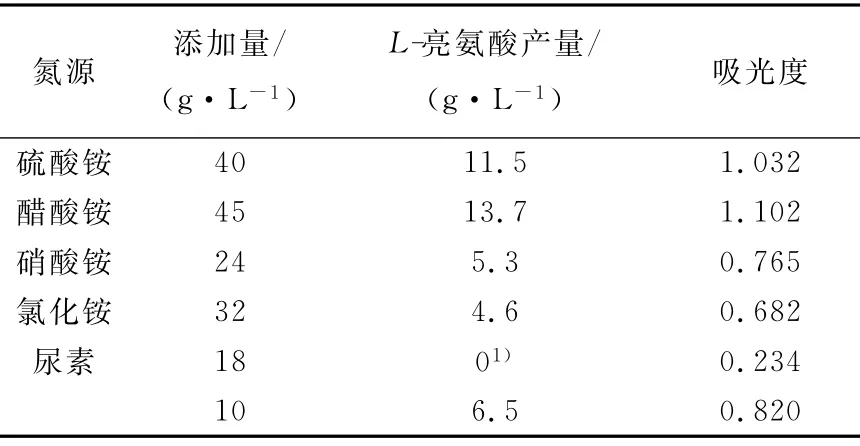
表3 不同氮源對L-亮氨酸發酵的影響
2)醋酸銨與硫酸銨配比對發酵的影響
在基礎發酵培養基中,醋酸銨與硫酸銨的配比對發酵的影響列于表4。從表4可以看出,表中所列各種配比,都能滿足菌體生長需要,但對產酸有不同的影響。當有20g/L醋酸銨時,添加20g/L硫酸銨,可以提高L-亮氨酸產量;只添加硫酸銨,含量即使高達40g/L,L-亮氨酸產量仍較低。
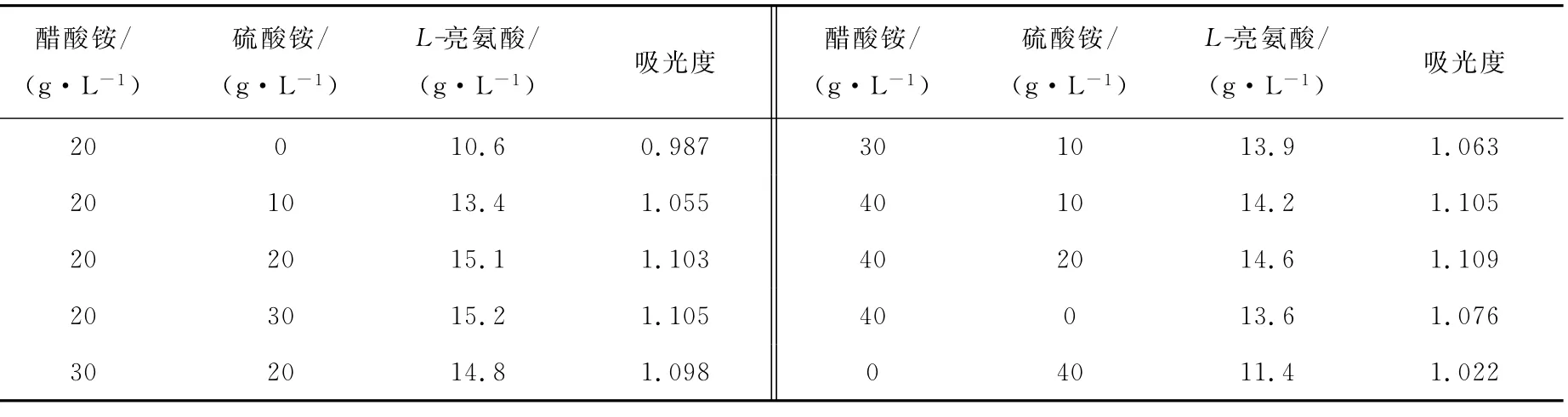
表4 醋酸銨與硫酸銨配比對L-亮氨酸發酵的影響
3)生物素對發酵的影響
為了研究生物素用量對L-亮氨酸發酵的影響,實驗在不添加玉米漿(玉米漿中含生物素)的發酵培養基中進行,試驗結果示于圖1。由圖1可知,生物素對L-亮氨酸發酵的影響很顯著。生物素缺乏,菌體就不能生長;而當生物素的質量濃度提高到50~75μg/L時,菌體生長良好,可獲得較高的L-亮氨酸產量。
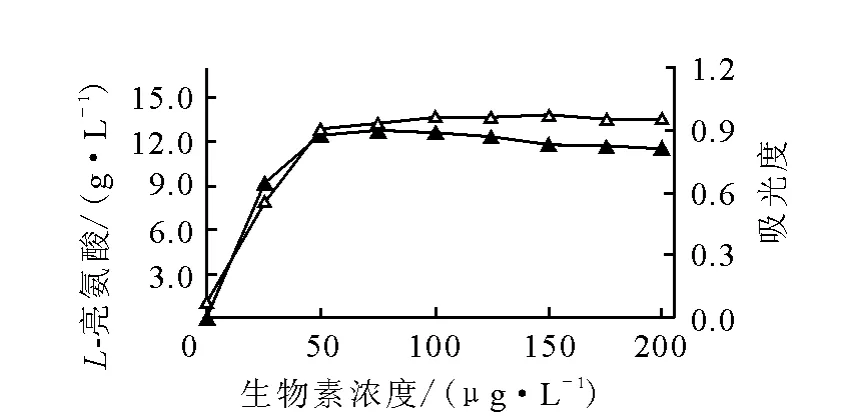
圖1 生物素對L-亮氨酸發酵的影響
4)碳酸鈣用量對發酵的影響
碳酸鈣用量對發酵的影響結果示于圖2。從圖2可知,碳酸鈣添加量為30g/L對發酵產酸最有利。
3.3.2 發酵條件的優化
1)溫度對發酵的影響
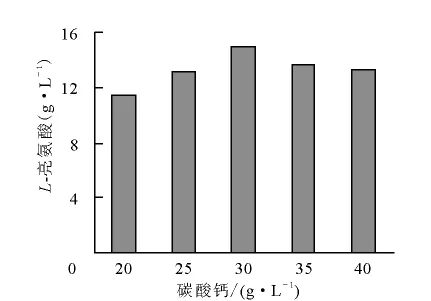
圖2 碳酸鈣用量對發酵的影響
溫度對發酵的影響示于圖3。由圖3可知,在28~30℃時,菌體生長好、菌體濃度大,L-亮氨酸產量較高,尤以28℃最好,發酵產酸達到最大值18.53g/L。溫度太低則菌體生長緩慢,難以完成對原料的轉化;溫度太高,菌體易衰老,菌體后勁不足,不利于高產L-亮氨酸。從圖3數據來看,L-亮氨酸發酵溫度控制在28℃為佳,最高不宜超過30℃。
2)裝液量對發酵的影響
采用優化的培養基和相同的種子及接種比例,在同一搖床上,選擇培養溫度為28℃,在220r/min轉速下振蕩培養92h,考查250和500mL兩種規格圓底三角瓶的不同裝液量對L-亮氨酸發酵的影響,結果分別示于圖4和圖5。
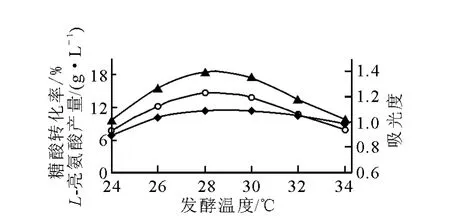
圖3 溫度對L-亮氨酸發酵的影響
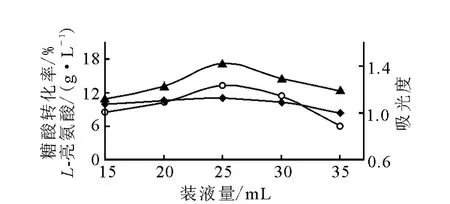
圖4 250mL三角瓶裝液量對L-亮氨酸發酵的影響
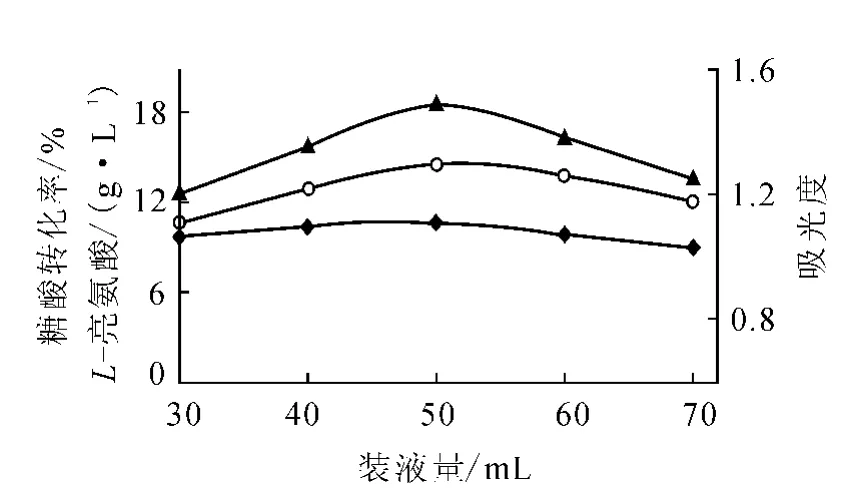
圖5 500mL三角瓶裝液量對L-亮氨酸發酵的影響
分析圖4和圖5可知,對相同規格三角瓶而言,由于固定了搖床轉速,若裝液量太少,在往復振蕩時發酵液翻滾過于劇烈,使溶氧過大而導致產酸不高。而裝液量過大則發酵液不易翻滾,使溶氧太少,導致產酸也不高。從本實驗結果來看,500mL三角瓶裝液50mL或250mL三角瓶裝液25mL為佳。
3)pH對發酵的影響
在接種前用滅菌的5mol/L NaOH溶液重調發酵液pH,并在發酵過程中每隔4h調pH至所需值(±0.1)。實驗在同一搖床上進行,發酵92h結束,結果示于圖6。由圖6得知,在發酵過程中控制pH7.0,有利于菌體生長和發酵產酸。實驗中觀測到,pH對發酵前期的菌體生長和中、后期發酵產酸影響都較大。pH7.0時菌體生長較快,培養至36~38h即結束對數生長進入穩定期。因此,發酵過程控制pH7.0,有利于菌體生長和發酵產酸。
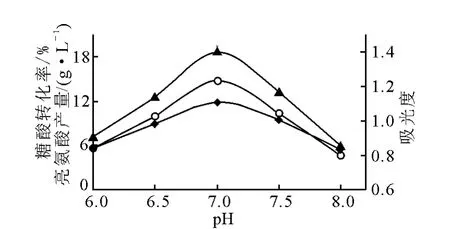
圖6 pH對L-亮氨酸發酵的影響
3.4 同位素13C高豐度實驗
將黃色短桿菌TS151從斜面接種于種子培養基中,每瓶接1環菌體,共接2瓶,置于搖床上,在28℃、220r/min下震蕩培養20h。在無菌條件下按10%接種量將新鮮種子液接入發酵培養 基 中 (原 料 葡 萄 糖-13C 豐 度 為 99%),500mL三角瓶裝液量50mL,置于巡回式搖床上,在28℃、220r/min下培養92h,直到發酵結束。發酵平均產酸16.6g/L。
將上述發酵液合并后用草酸調節pH至2~3,經離心分離(4 800r/min,30min),所得到的上清液用陽離子交換樹脂(H+型)吸附。先用蒸餾水洗至中性,然后用0.2mol/L氯化銨溶液進行洗脫,收集L-亮氨酸-U-13C6單斑洗脫液;將上述洗脫液調pH至2.0后上陽離子交換樹脂(H+型)脫鹽;收集L-亮氨酸-U-13C6單斑洗脫液,放入活性炭脫色、結晶。真空干燥得到L-亮氨酸-U-13C6產品,產品豐度達97.03%,純度98.5%,提取收率71.31%。
4 小 結
1)本研究以代謝控制發酵原理為基礎,選育獲得突變株黃色短桿菌TS151(帶有5種遺傳標記:Met-、Ile-、SGr、а-ABr、β-HLr),斜面連續轉接10次,遺傳標記穩定,高豐度產酸穩定在15g/L以上,空白產酸穩定在20g/L以上。
2)優化了L-亮氨酸-U-13C6生產的發酵配方和發酵工藝,通過高豐度實驗進一步確認選育菌株TS151可應用于L-亮氨酸-U-13C6的生產。
[1] Len,Ching Hohn,Ho,et al.Synthesis of poly(L-leucine):United States,5541237[P],1996-07-30.
[2] 貝濂,江驥,胡蓓,等.13C-亮氨酸呼氣實驗與氨基酸吸收[J].質譜學報,2000(4):113.
[3] 王亮,李保義.胃腸外營養與腫瘤生長[J].腸外與腸內營養,1999,(4):228-230.
[4] 許勤.老年外科病人與生長激素的應用[J].實用老年醫學,2000,(14):36-38.
[5] 林建華,吳國豪.以13C-亮氨酸作為示蹤劑測定兔燒傷后整體蛋白代謝水平的改變[J].外科理論與實踐,2007,(5):33-39.
[6] 宮景薌.L-亮氨酸產生菌的研究[J].微生物學雜志,1988,(1):22-26.
[7] Kisumi M.L-valine and L-leucine production by analogresistant mutants derived from serratia macesscens[J].J Bacteriol,1971,(107):824-830.
[8] Groeger U,Sahm H.Microbial Production of L-leucine from α-ketoisocaproate by Corynebacterioum glutaicum Appl[J].Microbiol Biotechnol,1987,(25):336-352.
[9] 張偉國,錢和.氨基酸生產技術及其應用[M].北京:中國輕工業出版社,1997:49-50.
[10]來彩霞,李福德.L-亮氨酸提取的研究[J].沈陽藥學院學報,1991,8(4):285-286.
[11]常碧影,梁冬生,閻惠文,等.氨基酸分析技術的研究與現狀[J].氨基酸雜志,1992,2:29-40.
[12]張素鑫 宛蘭翠等.產L-白氨酸突變株的選育及發酵條件的研究[J].微生物學報,1979,19(2):180-186.
[13]李彤,黃和容.L-亮氨酸分批發酵穩定性探討[J].微生物學通報,1991,18(2):91-96.
[14]Tsuchida T,Yoshinaga F,Kubota K.et al.Culture conditions for L-leucine production by strain No.218,a mutant of Brevibacterium lactofermentum 2 256[J].Agric Boil Chem,1975,39:1 149-1 153.

