負壓創(chuàng)面治療技術早期應用對軟組織爆炸傷創(chuàng)面作用的研究
錢玉鑫 蘆立軒 侯強 江華 張文俊 劉安堂
爆炸傷導致軟組織缺損嚴重,傷道周圍及深面存有泥沙、爆炸物碎屑、毛發(fā)等異物,清創(chuàng)后感染發(fā)生率高[1];爆炸傷患者嚴重創(chuàng)傷后免疫反應受到抑制,容易出現嚴重感染及其他并發(fā)癥[2]。負壓創(chuàng)面治療技術(NPWT)自上世紀90年代以來,已被證實具有較強的預防和控制感染能力,并能促進肉芽生長。本研究通過動態(tài)觀察組織內細菌量及組織學觀察肉芽生長情況,探討NPWT早期應用對于控制軟組織爆炸傷創(chuàng)面感染及促進肉芽生長的作用。
1 材料和方法
1.1 材料
健康家豬(n=5),第三軍醫(yī)大學野戰(zhàn)外科研究所動物中心提供,體質量30~35 Kg,雌雄不限;NPWT敷料由醫(yī)用聚氨酯海綿(孔徑400~600 μm,厚度2 cm,大小10 cm×15 cm)、三通接頭(GL-200)、引流管醫(yī)用貼膜(3M)、負壓泵(YB-DX230型電動吸引器,上海醫(yī)療器械工業(yè)公司)構成。
1.2 實驗方法
1.2.1 豬軟組織爆炸傷模型建立
采用兩根600 mg瞬發(fā)紙質電雷管并列致傷,間距2 cm。皮膚與爆炸源之間墊放0.5 cm厚海綿,固定后人員撤離,電起爆致傷。致傷部位選擇肌肉豐滿處,臀部致傷位置為髂前上棘后側4 cm,肩胛部致傷位置距背中線10 cm。每只動物致傷4個部位(雙側臀部和雙側肩胛部),每次致傷1個部位。
1.2.2 動物清創(chuàng)治療及分組
3只家豬隨機分為一側NPWT組,對側為紗布敷料組,每組6個創(chuàng)面;另選取兩只家豬形成的6個創(chuàng)面設為暴露組。致傷后6 h,暴露組送回動物房固定飼養(yǎng),NPWT組及紗布敷料組行創(chuàng)面清創(chuàng)。去除表面壞死組織,搔刮至組織新鮮出血。雙氧水、洗必泰、生理鹽水沖洗創(chuàng)面,消毒創(chuàng)面周圍正常皮膚。按實驗分組進行創(chuàng)面包扎。紗布組:外層凡士林紗布、內層無菌干紗布覆蓋,并將紗布固定于周圍皮膚。NPWT組:制備、安放NPWT敷料,調節(jié)負壓至-125 mmHg,檢查貼膜的氣密性。
1.2.3 大體觀察
觀察創(chuàng)面色澤、腫脹情況、分泌物的顏色及數量,并拍照留檔。
1.2.4 組織學觀察
傷后6 h和治療后第3、5、7天,自創(chuàng)面中心取10 mm×10 mm×10 mm大小組織塊,福爾馬林固定,石蠟包埋,5 μm厚度制片,常規(guī)HE染色,顯微鏡觀察組織損傷、炎癥浸潤及肉芽生長情況。
1.2.5 創(chuàng)面組織細菌計數
傷后6 h和治療后第3、5、7天取材。取材前生理鹽水紗布擦拭創(chuàng)面,除去滲液及壞死組織,以無菌方法取創(chuàng)面中央組織,大小約2 mm×2 mm×2 mm,稱重后玻璃勻漿器制成1.0 mL的勻漿液,按l:l0進行不同比例稀釋,于各梯度取0.5 mL標本稀釋液接種于瓊脂平板上,37℃孵育24 h,計數平板上的細菌菌落。每克組織內的細菌數=菌落數×稀釋倍數/標本重量,單位cfu/g(cfu:colony-forming unit,菌落形成單位)。
1.2.6 動物飼養(yǎng)
清創(chuàng)后動物自制五孔板固定籠內飼養(yǎng)。每日肌注青霉素40 000 U/Kg。
1.3 統(tǒng)計方法
2 結果
2.1 創(chuàng)面大體觀察
傷后第3天:NPWT組局部可見新生肉芽組織,創(chuàng)面濕潤,分泌物少(圖1A)。紗布組組織水腫,創(chuàng)面基底凹凸不平,創(chuàng)面可見壞死肌肉組織,表面少量膿性分泌物(圖1B)。暴露組創(chuàng)周紅腫明顯,創(chuàng)面內滲液,異味明顯;創(chuàng)緣可見1~2 cm皮緣發(fā)黑,呈燒灼樣損傷;創(chuàng)面基底局部肌肉外露,質軟色暗紅,夾之不收縮,切割不出血(圖1C)。
傷后第5天:NPWT組創(chuàng)面肉芽新鮮,色紅,稍水腫,觸之易出血(圖2A)。紗布組創(chuàng)面深度較前稍加深,局部肌肉組織壞死,少部分肉芽生長,蒼白水腫(圖2B)。暴露組創(chuàng)面較前擴大,痂皮未見溶解;創(chuàng)面滲液多,異味明顯,創(chuàng)周紅腫(圖2C)。
傷后第7天:NPWT組滲液少,創(chuàng)面內肉芽致密,組織無明顯水腫(圖3A)。紗布組肉芽面積較前稍增大,滲液較第5天減少(圖3B)。暴露組局部痂皮溶解,下方可見少量肉芽組織,水腫質脆,表面有膿性分泌物,量多伴惡臭,創(chuàng)緣紅腫(圖3C)。
2.2 創(chuàng)面組織細菌計數
傷后第3天:NPWT組可見炎性細胞浸潤,成纖維細胞增生,細胞水腫減退(圖4A)。紗布組可見炎性細胞浸潤較明顯,肌細胞間有少量成纖維細胞增生(圖4B)。暴露組可見大量炎性細胞浸潤,部分肌纖維出現溶解壞死(圖4C)。
傷后第5天:NPWT組新生肉芽鮮紅,成纖維細胞增多,可見新生的微毛細血管(圖5A)。紗布組炎性浸潤明顯,肌細胞周圍較多成纖維細胞,未見微毛細血管形成,無明顯肉芽生長(圖5B)。暴露組組織水腫明顯,肌細胞碎裂溶解,伴有大量炎性細胞浸潤(圖5C)。
傷后第7天:NPWT組肉芽組織致密,炎性細胞少,可見成形血管(圖6A)。紗布組肉芽組織疏松,可見微毛細血管形成(圖6B)。暴露組大片肌細胞溶解壞死,呈空泡狀,細胞結構消失,炎癥明顯(圖6C)。
2.3 創(chuàng)面組織細菌計數
治療前各組間細菌數無明顯差異。治療后各時間段NPWT組細菌計數均較紗布組、暴露組數值小,統(tǒng)計學差異顯著(表1)。NPWT治療后第3天后計數為(3.282±0.336)×105cfu/g,以后隨時間延長計數不再增加;第5天細菌計數降至感染臨界水平以下。紗布組第5天細菌計數達到峰值,后緩慢下降。暴露組細菌計數逐漸增高,第7天達到109cfu/g水平,感染嚴重(圖7)。
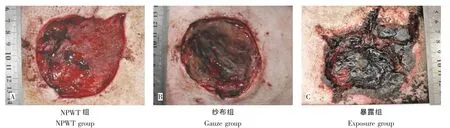
圖1 治療后第3天創(chuàng)面大體觀Fig.1The gross observation 3 days after treatment
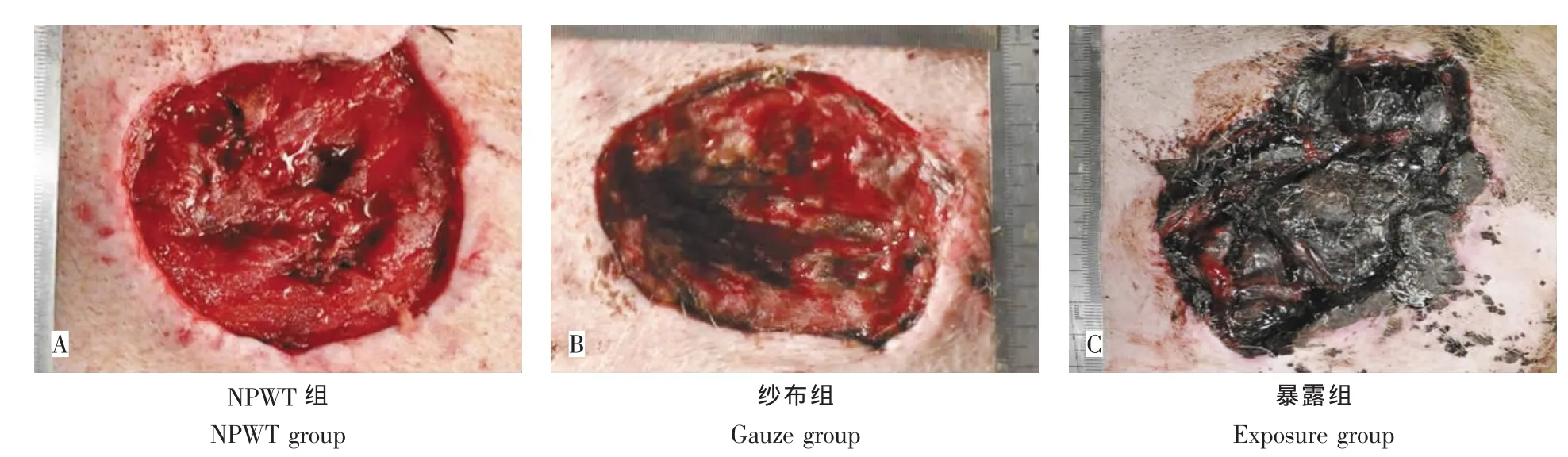
圖2 治療后第5天創(chuàng)面大體觀Fig.2The gross observation 5 days after treatment

圖3 治療后第7天創(chuàng)面大體觀Fig.3The gross observation 7 days after treatment
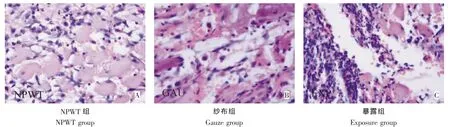
圖4 治療后第3天創(chuàng)面組織HE染色(400×)Fig.4HE staining observation 3 days after treatment(400×)
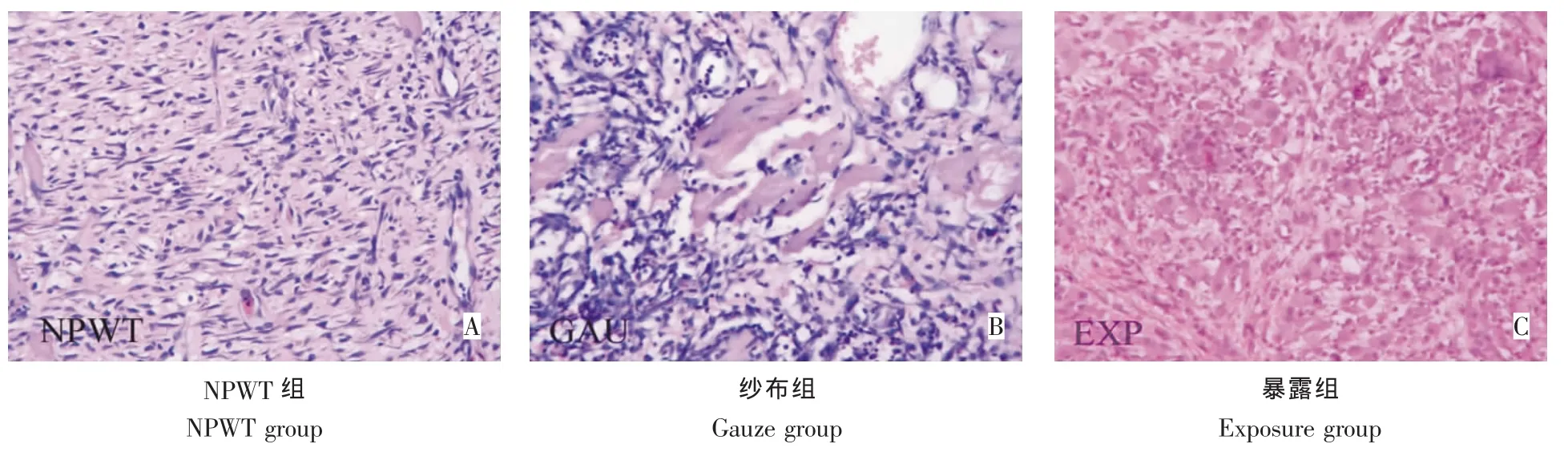
圖5 治療后第5天創(chuàng)面組織HE染色(200×)Fig.5HE staining observation 5 days after treatment(200×)

圖6 治療后第7天創(chuàng)面組織HE染色(200×)Fig.6HE staining observation 7 days after treatment(200×)

圖7 創(chuàng)面組織細菌計數Fig.7Wound organization bacterial count
表1 不同時間點各組細菌計數(±s,×105cfu/g)Table 1Bacterial counts of specimens from each group at different time points(±s,×105cfu/g)
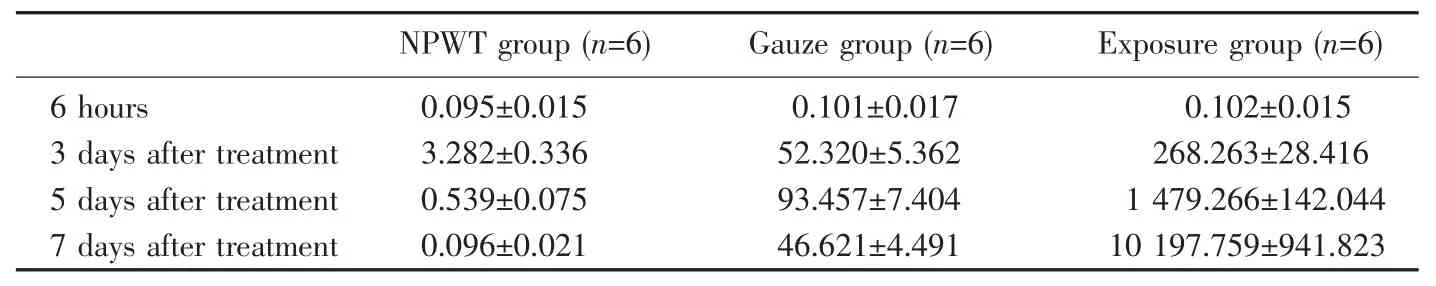
表1 不同時間點各組細菌計數(±s,×105cfu/g)Table 1Bacterial counts of specimens from each group at different time points(±s,×105cfu/g)
NPWT group(n=6)Gauze group(n=6)Exposure group(n=6)6 hours0.095±0.0150.101±0.0170.102±0.015 3 days after treatment3.282±0.33652.320±5.362268.263±28.416 5 days after treatment0.539±0.07593.457±7.4041 479.266±142.044 7 days after treatment0.096±0.02146.621±4.49110 197.759±941.823
3 討論
上世紀50年代開始,細菌計數被認為能直觀并準確地反映創(chuàng)面感染程度,并進而預測組織愈合情況。細菌計數達到105cfu/g被視為是感染的臨界值[3]。爆炸傷組織損傷嚴重,創(chuàng)面缺乏正常皮膚的屏障作用,水、蛋白質丟失,創(chuàng)面細菌感染率較高。控制感染有3個主要手段:清創(chuàng)、創(chuàng)面沖洗、特異性抗生素應用。自NPWT發(fā)明以來,大量研究發(fā)現,NPWT治療可以降低細菌負荷[4-5]。也有部分研究觀察到治療過程中細菌計數升高,但創(chuàng)面臨床情況改善[6]。針對這種傷口愈合而細菌負荷并未降低的現象,Moues等[7]推測,相對于細菌的數目而言,細菌的種類、性質、毒力以及機體對抗感染的能力更為重要。美軍已經逐漸將NPWT運用到戰(zhàn)傷救治中,將創(chuàng)面與周圍戰(zhàn)場、病室環(huán)境相隔離,有效保持創(chuàng)面清潔并減少創(chuàng)面感染。Leininger等[8]運用NPWT治療88例高能爆炸所致軟組織創(chuàng)面,無創(chuàng)面感染及并發(fā)癥發(fā)生。Geiger等[9]對合并廣泛軟組織和骨質缺損(Ⅲ/Ⅳ級開放性骨折)的68名伊戰(zhàn)傷員,運用NPWT進行創(chuàng)面準備,減少了急、慢性骨髓炎的發(fā)生。
本實驗顯示,NPWT早期治療爆炸傷創(chuàng)面,能抑制細菌增殖,降低組織細菌負荷。各時間段NPWT組細菌計數均較紗布組、暴露組數值小。NPWT組治療后第3天后計數為(3.282±0.336)×105cfu/g,后隨時間延長,計數不再增加;第5天細菌計數降至感染臨界值水平以下。NPWT早期治療,能有效控制爆炸傷創(chuàng)面細菌增殖的作用機制,其可能機制是:①貼膜的屏障作用,NPWT使創(chuàng)面與周圍環(huán)境相隔離,有效保持創(chuàng)面清潔并減少創(chuàng)面感染。與平原地區(qū)相比,高原環(huán)境下細菌增殖速度減緩,細菌計數達到107cfu/g時才出現感染,可能與低氧環(huán)境有關[10]。②負壓的虹吸作用將細菌、滲液及壞死物質從創(chuàng)面清除,組織細菌量減少,減少條件性致病菌增殖[11]。負壓產生的吸引力量減少了細菌向深面組織的侵襲,抑制了感染擴散。③減少第三間隙內液體,減輕創(chuàng)面水腫。軟組織爆炸傷損傷嚴重,壞死物質及滲出多,組織水腫明顯,循環(huán)阻塞引起細胞持續(xù)性壞死及組織繼發(fā)性感染。NPWT治療有效減輕組織水腫,縮短毛細血管與修復細胞之間的距離,增加氧和營養(yǎng)的轉運,白細胞更容易外滲到達微生物定殖區(qū)域,提高了組織的抗感染能力[12]。④NPWT治療后,組織細菌負荷減輕,避免了過度炎癥反應。適度的炎癥促使創(chuàng)面自炎癥期轉入為增殖期變化,肉芽組織形成,創(chuàng)周上皮組織向創(chuàng)面內遷移,增強了創(chuàng)面的屏障作用。
伊拉克戰(zhàn)爭中,美軍已廣泛應用NPWT早期治療皮膚軟組織戰(zhàn)創(chuàng)傷,文獻報道應用后可以減輕醫(yī)護人員工作量,提高治療效果。Morykwas等[5]證實,與濕紗布敷料相比,應用NPWT治療家豬創(chuàng)面肉芽形成的體積可以增加約60%;進一步的研究表明,負壓在125 mmHg時肉芽生長效果較25 mmHg或500 mmHg要好[13]。本研究通過觀察爆炸傷創(chuàng)面肉芽生長的情況,發(fā)現NPWT組肉芽形成較其他兩組更早。治療后第3天,NPWT鏡下即表現出成纖維細胞增生,水腫明顯減輕;第5天時NPWT組新生肉芽鮮紅,并可以見多個微毛細血管形成,而紗布組僅有少量肉芽生長;第7天時NPWT組肉芽組織致密,成形血管形成。NPWT早期治療促進肉芽生長的作用,可能與以下因素有關:①負壓作用減輕組織水腫,改善創(chuàng)面的供血、供氧,負壓治療后組織氧含量上升,增強細胞分化能力,并且提高成纖維細胞的增殖和遷移,調控膠原生成。②負壓吸引的機械性牽張作用。細胞受到表面張力才能響應細胞因子變化發(fā)生分裂和增殖;未受牽拉時,細胞外形呈球狀,細胞周期停止,并出現凋亡趨勢[14]。NPWT導致創(chuàng)面微變形,這種變化使細胞骨架中細胞整合素發(fā)生斷裂,觸發(fā)了細胞內第二信使的釋放(如前列腺素,磷酸肌醇,蛋白激酶C,細胞內鈣),引起細胞生長、增殖和分化[15]。負壓張力作用下,細胞伸展5%~20%時可以促進細胞增殖[15],毛細血管芽定向生長。③負壓吸引促進創(chuàng)面內修復性生長因子分泌,降低創(chuàng)面內抑制性因子水平。NPWT能夠提高創(chuàng)面組織內VEGF、FGF-2以及PDGF的表達[16]。VEGF、FGF-2已被證實是最強的血管新生刺激因子,VEGF主要促進毛細血管形成,FGF-2則傾向于促進小動脈形成。兩者在血管新生的不同階段起作用,共同作用可以更好地促進血管新生。FGF-2、PDGF均具有趨化及增殖作用,促進創(chuàng)面修復。同時,負壓作用可將抑制成纖維細胞及內皮細胞的增殖的多種細胞因子、金屬蛋白酶以及膠原酶,從創(chuàng)面中引流清除,從而使修復性生長因子更好地發(fā)揮作用。④控制感染,促進組織由炎癥期向增殖期轉變。感染可延長炎癥反應期,妨礙肉芽組織形成。
NPWT早期應用治療豬爆炸傷軟組織缺損,能有效抑制創(chuàng)面細菌增殖,減輕細菌負荷,避免創(chuàng)面過度炎癥反應;并可早期啟動爆炸傷軟組織創(chuàng)面細胞增殖過程,促進肉芽組織生長。因此,在爆炸傷傷軟組織缺損創(chuàng)面的早期治療中具有積極的意義。
[1]Radonic V,Giunio L,Boric T,et al.Antipersonnel mine injuries in Southern Croatia[J].Mil Med,2004,69(4):313-319.
[2]Yun HC,Branstetter JG,Murray CK.Osteomyelitis in military personnel wounded in Iraq and Afghanistan[J].J Trauma,2008,64(2 Suppl):S163-168.
[3]Robson MC.Wound infection.A failure of wound healing caused by an imbalance of bacteria[J].Surg Clin North Am,1997,77(3):637-650.
[4]Campton-Johnston S,Wilson J.Infected wound management:advanced technologies,moisture-retentive dressings,and diehard methods[J].Crit Care Nurs Q,2001,24(2):64-77.
[5]Morykwas MJ,Argenta LC,Shelton-Brown EI,et al.Vacuum assisted closure:a new method for wound control and treatment:animal studies and basic foundation[J].Ann Plast Surg,1997,38(6):553-562.
[6]Weed T,Ratliff C,Drake DB.Quantifying bacterial bioburden during negative pressure wound therapy:does the wound VAC enhance bacterial clearance[J]?Ann Plast Surg,2004,52(3):276-279.
[7]Moues CM,Vos MC,van den Bemd GJ,et al.Bacterial load in relation to vacuum-assisted closure wound therapy:a prospective randomized trial[J].Wound Repair Regen 2004;12(1):11-17.
[8]Leininger BE,Rasmussen TE,Smith DL,et al.Experience with wound VAC and delayed primary closure of contaminated soft tissue injuries in Iraq[J].J Trauma,2006,61(5):1207-1211.
[9]Geiger S,McCormick F,Chou R,et al.War wounds:lessons learned from Operation Iraqi Freedom[J].Plast Reconstr Surg,2008,122(1):146-153.
[10]何代平,李素芝,殷作明,等.高原和內地槍彈傷后細菌感染的對比研究[J].中華醫(yī)院感染學雜志,2006,16(2):l77-179
[11]Kiyokawa K,Takahashi N,Rikimaru H,et al.New continuous negative-pressure and irrigation treatment for infected wounds and intractable ulcers[J].Plast Reconstr Surg,2007,120(5):1257-1265.
[12]Webb LX.New techniques in wound management:vacuum-assisted wound closure[J].J Am Acad Orthop Surg,2002,10(5):303-311.
[13]Morykwas MJ,Faler BJ,Pearce DJ,et al.Effects of varying levels of subatmospheric pressure on the rate of granulation tissue formation in experimental wounds in swine[J].Ann Plast Surg,2001,47(5):547-551.
[14]Chen CS,Mrksich M,Huang S,et al.Micropatterned surfaces for control of cell shape,position,and function[J].Biotechnol Prog,1998,14(3):356-363.
[15]Saxena V,Hwang CW,Huang S,et al.Vacuum-assisted closure:microdeformations of wounds and cell proliferation[J].Plast Reconstr Surg,2004,114(5):1086-1096.
[16]Erba P,Ogawa R,Ackermann M,et al.Angiogenesis in wounds treated by microdeformational wound therapy[J].Ann Surg,2011,253(2):402-409.

