非綜合征型耳聾線粒體基因突變的檢測
劉 濤 ,李建瑞 ,嚴江偉 ,李玲香 ,王利偉 ,
1.北京市垂楊柳醫院耳鼻咽喉科,北京 100022;2.中國科學院北京基因組研究所,北京 100029;3.內蒙古醫學院附屬醫院耳鼻喉科,內蒙古呼和浩特 010059
耳聾是最常見的殘疾之一,其發病率高、病因復雜、治療困難,給個人、家庭及社會帶來巨大的壓力和沉重的負擔。據各國統計,每1000名新生兒中,有1~3例聽力障礙兒童,其中至少一半與遺傳因素有關。研究表明,線粒體(mtDNA)12SrRNA基因A1555G點突變能引起氨基糖苷類藥物敏感性耳聾(aminoglycoside antibiotics induced deafness,AAID)[1],占遺傳性聾1%~2%[2]。目前國內用于檢測線粒體 12S rRNA基因第1555位A>G均質性突變的方法為:PCR擴增線粒體DNA片段,限制性內切酶分析(RFLP)和 DNA序列分析[3]。本文采用常規流行病學的研究方法結合分子生物學的手段,于2006年7月~2010年10月對內蒙古鄂爾多斯市特殊教育學校102名非綜合征型感音神經性耳聾患者的mtDNA A1555G點突變進行檢測,以了解耳聾和該突變的關系。
1 資料與方法
1.1 一般資料
選擇內蒙古鄂爾多斯市特殊教育學校學生102例。這些學生從內蒙古鄂爾多斯市下屬的各個旗、縣招生。其中,男56例,女46例;年齡6~23歲,平均15.65歲;蒙古族10例,漢族92例。
1.2 方法
1.2.1 病史資料采集 首先,通過學校給家長或監護人發放知情同意書;然后由學生和家長共同填寫調查問卷。問卷包括患者的一般情況,如姓名、性別、出生年月;特別要關注患者的耳聾病史、家族中是否有同樣的耳聾患者、是否用過耳毒性藥物、耳聾是否與外傷有關、是否患過腮腺炎等可以引起耳聾的傳染病疾病史。對患者的耳鼻喉科進行正規的專科檢查和聽力學評估。對所有患者行純音測聽和聲導抗檢查。在學校對所有患者抽取外周靜脈血3 ml,低溫冷凍保存。在實驗室進行全基因組DNA的提取,然后進行A1555G點突變的篩查。
1.2.2 基因組DNA的制備 用DNA提取試劑盒(QIA amp DNA Blood Mini Kit 250)提取耳聾患者的全基因組DNA,取適量用紫外分光光度計進行純度檢測,將提取的DNA置于-80℃冰箱保存備用。
1.2.3 引物設計與合成 用Primer 3 input數據庫設計引物,引物由上海生工生物工程技術服務有限公司合成。正向引物序列:5'-CCGCCATCTTCAGCAAACCCTG-3';反向引物序列:5'-TAGTAAGGTGGAGTGGGTTTGG-3'。
1.2.4 PCR擴增 PCR反應體系包括1×PCR緩沖液、1.5 mmol/L MgCl2、0.2 mmol/L dNTPs、0.2 mol/L 正反向引物、40 ng 基因組DNA、1U TaqDNA聚合酶(PCR反應試劑均為北京Fermentas公司產品),去離子滅菌水補足至20 μl。PCR反應在 DNA熱循環儀(BIO RAD PTC-200,美國BIO RAD公司)上進行。反應條件:95℃預變性 3 min,95℃變性 30 s,62℃退火 30 s,72℃延伸 30 s,經 30個循環,最后 72℃延伸 10 min。4℃保存。PCR產物 4 μl與1 μl溴酚藍混合,1.5%瓊脂糖凝膠電泳(120 V,40 min),DL2000 DNA Ladder(北京天根公司)標記,化學發光成像系統下進行PCR產物鑒定。
1.2.5 限制性內切酶分析 酶切總體系30 μl,針對mtDNA 12SrRNA的PCR擴增產物,經瓊脂糖凝膠電泳驗證后取10 μl,加入Alw26I(酶切位點:5'-GAGAC)限制性內切酶(北京 Fermentas公司)1 μl,Buffer Tango 緩沖液 2 μl,去離子滅菌水補足至30 μl。酶切條件:37℃水浴箱中溫育消化過夜,經瓊脂糖凝膠電泳驗證,酶切切開者為150 bp和295 bp兩個條帶,為突變陰性;如只見445 bp的一個條帶,說明存在mtDNA A1555G突變;均設陽性和陰性對照。不能切開的或是酶切顯示不清的送測序驗證。
1.2.6 DNA序列測定 擴增出的PCR產物經QIAGEN PCR純化試劑盒純化,純化產物經電泳證實后,再做Cycle Sequencing反應。用擴增模扳的引物行測序反應,然后在3100毛細管測序儀上該片段進行DNA序列測定。取DNA庫內正常人混合基因組DNA做正、反向測序,作為單鏈DNA測序的陽性對照。 反應條件:95℃預變性 2 min,95℃變性 10 s,50℃退火5 s,60℃延伸4 min,循環25次。反應產物用Gentri-Sep Spin columns除去過量的dye terminators保證反應產物適合在3100毛細管測序儀內進行。測序結果經過3100測序分析系統軟件進行分析。
2 結果
2.1 病史資料
聾啞學校的102例非綜合征型耳聾患者中,三代人中可發現2例耳聾患者的有11例,1例是父母近親結婚,其余均為散發性耳聾。
2.2 聽力損失評估
極重度聾占大多數,共89例,其次是重度聾,共10例,中度聾和中重度聾3例。聲導抗測試:鼓室壓圖:大多數為A型鼓室曲線共58例;其次是As型鼓室曲線共30例;B型鼓室曲線共13例;Ad型鼓室曲線僅有1例。鐙骨肌反射:57例雙耳都沒有引出鐙骨肌反射,31例可引出鐙骨肌反射者,但反應閾較高,另外14例聽力較好耳可引出鐙骨肌反射。1.5歲以下發現耳聾82例,1.5~5.0歲發現耳聾20例。
2.3 藥物性耳聾情況
用氨基糖苷類抗生素后發現耳聾54例。其中以使用慶大霉素最多見為33例,其次是鏈霉素共13例。卡那霉素與上述二種藥物聯合使用2例。三種藥物兩兩聯合使用5例,三種聯合使用1例。因感冒發熱使用48例,其他病因使用6例。
2.4 線粒體A1555G基因突變酶切結果
本實驗擴增的片段是從線粒體基因核苷酸1261到1705,PCR產物共有445 bp。含有GAGAC核苷酸序列的DNA片段可被限制性內切酶Alw26I識別。如果發生突變,這個識別位點消失,PCR產物不被酶切,經該酶孵育過的電泳檢測仍為445 bp一條帶;如果未發生突變,擴增產物被酶切后就被分為295 bp和150 bp兩個片段。7例患者的PCR產物經Alw26I酶切后無識別位點的丟失,電泳檢測為一條445 bp的帶,陽性率是6.9%(7/102),有氨基糖苷類用藥史54例,該點突變的發生率為13.0%(7/54)。部分病例酶切結果見圖1。
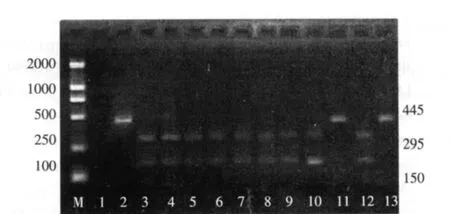
圖1 部分病例酶切結果
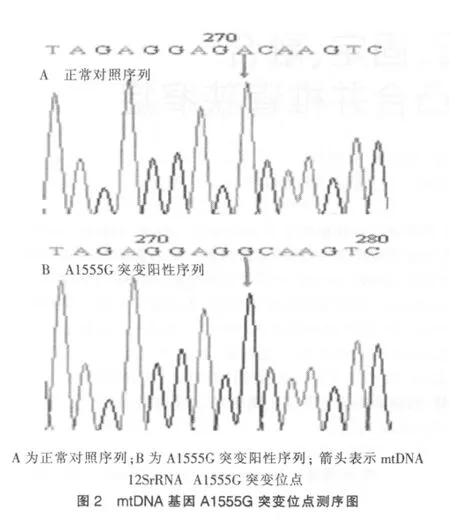
2.5 mtDNA 12SrRNA A1555G基因測序結果
7例存在線粒體基因A1555G位點突變,與酶切結果相吻合。見圖2。
3 討論
人類線粒體是一個雙鏈閉環分子,由16569 bp的核苷酸序列組成。與其他細胞器諸如溶酶體和過氧化物酶等特化膜結構相比,線粒體具有自己的遺傳物質,因而是一種半自主復制體。這是指mtDNA能夠獨立地復制、轉錄和翻譯[4-5]。當mtDNA出現突變時,核苷酸序列和空間結構發生改變,導致mtDNA亞單位rRNA的結構與細菌蛋白核糖體的結構極為相似,改變了結構的rRNA與氨基糖苷類抗生素有極高的親和力。而野生型rRNA卻不能與氨基糖苷結合[6]。這是氨基糖苷類抗生素致聾的的機制之一。
在臨床工作中,有的患者由于患有結核病等原因,使用氨基糖苷類抗生素可達3個月之久,卻沒有發生聽力下降;有些患者僅用了少量的氨基糖苷類抗生素,結果發生了極為嚴重的聽力下降而導致聾啞癥。可見個體對氨基糖苷類抗生素的敏感性有巨大的差異性,這是由基因決定的。本研究資料也說明,該地區有明顯的抗生素濫用傾向,只要有發熱就使用氨基糖苷類抗生素。因此,停止濫用抗生素對降低耳聾的發生也是非常有效的方法之一。由于本研究有7例患者存在mtDNA A1555G點突變,全部有氨基糖苷類抗生素用藥史,說明mtDNA A1555G點突變是他們患病的遺傳學基礎。但是,另外的47例卻沒有檢測到該位點的的突變,不能排除mtDNA其他位點的突變;如線粒體A7445G點突變,C1494T等的點突變[2-7]。也不能排除核基因的調控和環境因素的影響。賈婧杰等[8]對山東省濱州市特教學校74例耳聾學生進行了12S rRNA基因A1555G點突變的檢測,5例為陽性,陽性率為6.76%(5/74)與本文結果一致。該群體線粒體A1555G位點的突變率高于以往的報道,攜帶有該突變的個體對氨基糖苷類抗生素有高度易感性,因此該基因突變是感音神經性耳聾的原因之一。鮑曉林等[9]對西北地區245例患者行A1555G點突變檢測,86例有氨基糖苷類藥物應用史,檢測到21例線粒體DNA 12SrRNA A1555G同質型突變,突變檢出率為24.4%(21/86);在東北地區188例患者中,66例有氨基糖苷類藥物應用史,檢測到2例同質型突變,1例異質性突變,突變檢出率為4.5%(3/66)。兩地區比較差異有統計學意義,西北地區線粒體DNA 12SrRNA A1555G突變檢出率顯著高于東北地區。
由于本次研究只針對內蒙古鄂爾多斯聾啞學校學生進行檢測,這些學生大多為重度-極重度非綜合征型耳聾患者,而本文只檢測了mtDNA A1555G突變,還應有該基因其他位點的突變。所以內蒙古鄂爾多斯地區的線粒體基因突變的頻率應該高于單個點突變6.9%的比率。這一地區mtDNA高突變率的遺傳學因素,氨基糖苷類藥物的高使用率是這一地區高聾啞癥發生率的原因。因此,氨基糖苷類抗生素的使用應該非常慎重,對非用不可的患者要仔細詢問其耳聾家族史,進行mtDNA A1555G點突變的檢測,對該位點陰性的個體先行常見其他位點的檢測,必要時行全部基因組mtDNA的檢測。如果有mtDNA的點突變則避免使用氨基糖苷類抗生素,防止人為因素造成的聽力損害。這對防聾將產生重大而深遠的意義。
[1]Guan MX.Molecular pathogenetic mechanism of maternally inherited deafness[J].Ann N Y Acad Sci,2004,1011(1):259-271.
[2]李琦,戴樸,黃德亮.遺傳性聾線粒體DNA分子流行病學[J].國際耳鼻咽喉頭頸外科雜志,2008,32(4):210-212.
[3]蔡筠,羅彩群,謝建生,等.PCR-高效液相色譜法檢測線粒體DNA A1555G突變[J].臨床檢驗雜志,2011,29(2):87-88.
[4]Anderson S,Bankier A T,Barrell BG,et al.Sequence and organization of the human mitochondrial genome[J].Nature,1981,290(5806):457-465.
[5]李建瑞,陳瑛,王宇,等.母系遺傳性聾線粒體基因的突變[J].中國耳鼻咽喉頭頸外科,2005,12(10):645-648.
[6]Erik CB.Mutant A1555G Mitochondrial 12S rRNA and Aminoglycoside Susceptibility[J].Antimicrob Agents Chemother,2010,54(7):3073-3075.
[7]卜云飛,呂曉光,汪洋,等.22例非綜合征型耳聾患者的致病基因突變位點分析[J].南京醫科大學學報:自然科學,2010,30(3):390-393.
[8]賈婧杰,袁永一,戴樸,等.山東省濱州市特教學校耳聾學生分子病因學分析[J].中華耳科學雜志,2010,8(4):407-410.
[9]鮑曉林,郭玉芬,劉曉雯,等.西北地區與東北地區耳聾先證者線粒體DNA12SrRNAA1555G突變特點分析[J].聽力學及言語疾病雜志,2010,18(4):387-388.

