衍生自人ⅡA型磷脂酶A2碳末端的多肽C-26殺菌作用研究Δ
何睿林,梁寧生(廣西醫(yī)科大學附屬腫瘤醫(yī)院,南寧市530021)
對于抗菌多肽(Antimicrobial peptides)的研究已有較長的歷史,這類多肽對細菌和/或真菌都有殺菌作用。最初的研究主要集中在生物體內(nèi)天然存在的抗菌多肽,無論是低等生物昆蟲體內(nèi),還是高等生物哺乳動物體內(nèi),都存在這類物質(zhì),其是生物天然免疫系統(tǒng)里一類抵抗微生物感染的重要武器[1]。對抗菌多肽的研究有助于揭示生物抵抗感染的機制,也有助于抗感染藥物的開發(fā)。
目前,除生物體內(nèi)天然存在的抗菌多肽以外,抗菌多肽的研究還向2方面擴展:一是根據(jù)抗菌多肽的一些特性,利用計算機輔助設(shè)計和合成具有抗菌作用的多肽(非天然的)[2];二是根據(jù)已知的一些蛋白分子結(jié)構(gòu),如血紅蛋白分子結(jié)構(gòu),模擬合成這些分子的部分結(jié)構(gòu),也就是一些多肽片段,其也具有殺菌作用[3]。本研究是根據(jù)人ⅡA型磷脂酶A2(ⅡA型PLA2)分子的結(jié)構(gòu)(全長為124個氨基酸殘基),合成其碳(C)末端26個氨基酸殘基的多肽C-26。現(xiàn)對其殺菌作用進行初步研究。
1 材料
1.1 細菌
3種革蘭陽性(G+)細菌:金黃色葡萄球菌(ATCC26003)、枯草桿菌(ATCC63501)、炭疽桿菌(ATCC63065),3種革蘭陰性(G-)細菌:大腸桿菌(ATCC44113)、變形桿菌(ATCC49027)、綠膿桿菌(ATCC10104),以上標準菌株均由廣西醫(yī)科大學微生物學教研室提供,購自中國食品藥品檢定研究院。
1.2 試藥
多肽C-26(由梁寧生教授設(shè)計,上海波泰生物公司合成和純化,批號:10101321);羥乙基哌嗪乙硫磺酸(Hepes)、1%小牛血清白蛋白(北京Solarbio公司);LB培養(yǎng)基粉(上海生工生物工程有限公司);LB營養(yǎng)瓊脂(北京陸橋技術(shù)有限責任公司);無水氯化鈣(CaCl2,成都科隆化工試劑廠生產(chǎn),批號:20081106);RPMI-1640培養(yǎng)基(美國Gibco-Brl公司)。
1.3 儀器
Anke TGL-16C臺式離心機(上海安亭科學儀器廠);TU-1810S紫外分光光度計(北京普析通用儀器有限責任公司);Thermo 420型恒溫氣浴搖床(新加坡Thermo Electron公司);HWS-20恒溫水浴箱(江蘇太倉市實驗設(shè)備廠);J3-NAPCO-5410型CO2培養(yǎng)箱(克勒格瓦尼(上海)分析儀器有限公司)。
2 方法
2.1 不同哺乳動物ⅡA型PLA2氨基酸順序(蛋白質(zhì)一級結(jié)構(gòu))的獲取與分析
根據(jù)本課題組先前的研究結(jié)果獲取兔ⅡA型PLA2氨基酸順序[4],并利用美國國家生物工程信息中心(NCBI)網(wǎng)站的基因庫(GenBank),查詢并獲取所有已知的包括人、猩猩、猴、牛、豚鼠、大鼠和小鼠等7種哺乳動物的ⅡA型PLA2mRNA及其氨基酸順序。人、猩猩、猴和牛的ⅡA型PLA2mRNA參考序列號(NCBI reference sequence)分別是NM_000300.3、XM_001160501.1、XM_001094969.1、NM_001025324,豚鼠、大鼠和小鼠ⅡA型PLA2mRNA基因獲取號分別是GI:951010、GI:155369735、GI:132626632。同時,將各自氨基酸順序的C末端26個氨基酸殘基剪切并比較其氨基酸組成情況。
2.2 多肽C-26的制備與配制
以上述獲取的人ⅡA型PLA2氨基酸順序的C末端為模板,合成長度為26個氨基酸殘基的多肽C-26(ARNKTTYNKKYQYYSNKHCRGSTPRC),純度90%。多肽C-26使用前先離心將附壁的制劑粉末收集至管底以確保溶質(zhì)的量,然后溶于經(jīng)高壓蒸汽滅菌的雙蒸水400μL(10 g·L-1),并以20μL/管分裝于500μL Eppendorf管中,-20℃冷凍保存,盡量避免反復凍融。
2.3 殺菌試驗
采用瓊脂鋪板計數(shù)法。(1)取過夜培養(yǎng)的細菌,按1∶50分別加入至5 mL新鮮LB培養(yǎng)液中(當細菌為金黃色葡萄球菌或綠膿桿菌時,加入量為300μL),置于37℃恒溫氣浴搖床中振搖孵育2.5~3 h(對數(shù)生長期)。(2)采用臺式離心機離心收集、洗滌細菌并將其沉淀物溶解于0.5 mL生理鹽水,繼以紫外分光光度計(波長540 nm)測出吸光度達到0.1時所需的細菌量(mL),計算細菌稀釋倍數(shù)。吸取多肽C-26和細菌(終濃度1×109cfu·L-1)各10μL,加入RPMI-1640反應(yīng)體系(總體積為100μL,含有10 mol·L-1Hepes、1%小牛血清白蛋白、1 mol·L-1CaCl2,pH 7.4),混勻后置于37℃恒溫水浴。(3)水浴2 h后,從該體系中取出反應(yīng)液50 μL,加滅菌生理鹽水450 μL,連續(xù)10倍稀釋,共4次。每一稀釋倍數(shù)都取出100 μL的稀釋液至無菌培養(yǎng)皿(直徑55 mm)中,再加入經(jīng)高壓蒸汽滅菌后55℃保溫的LB營養(yǎng)瓊脂約5 mL,待瓊脂冷卻后,將培養(yǎng)皿放入37℃溫箱培養(yǎng)。18~24 h后取出計算每一瓊脂板上的菌落形成單位(cfu),與未加入多肽C-26的對照組相比,計算經(jīng)不同濃度多肽C-26作用后的殺菌率=(對照組cfu-實驗組cfu)/對照組cfu×100%,并繪制殺菌曲線。每組實驗重復4次。
3 結(jié)果
3.1 不同哺乳動物ⅡA型PLA2蛋白質(zhì)一級結(jié)構(gòu)C末端分析
對獲得的包括人、猩猩、猴、牛、兔、豚鼠、大鼠和小鼠等8種哺乳動物ⅡA型PLA2蛋白質(zhì)一級結(jié)構(gòu)進行分析表明,在其中的C末端26個氨基酸殘基堿性最強,完全不含酸性氨基酸殘基,卻包含5~8個堿性氨基酸殘基。所帶的凈正電荷在+5~+8之間,堿性氨基酸殘基占據(jù)C末端26個氨基酸殘基的百分比在19.23%~30.7%,提示該區(qū)域為堿性氨基酸富集區(qū)域。人或動物ⅡA型PLA2C末端26個氨基酸殘基構(gòu)成情況見圖1。

3.2 多肽C-26對G+細菌的殺菌作用
多肽C-26在濃度為250 mg·L-1時即對同屬G+細菌的金黃色葡萄球菌、炭疽桿菌、枯草桿菌具有較強的殺菌作用,殺菌率在70%~99.9%,殺菌敏感性由高到低依次為:枯草桿菌>炭疽桿菌>金黃色葡萄球菌;當其濃度為500 mg·L-1(對炭疽桿菌)和1000 mg·L-1(對金黃色葡萄球菌)時,對炭疽桿菌和金黃色葡萄球菌的殺菌率增加至99.9%以上。多肽C-26對G+細菌的殺菌作用詳見圖2。
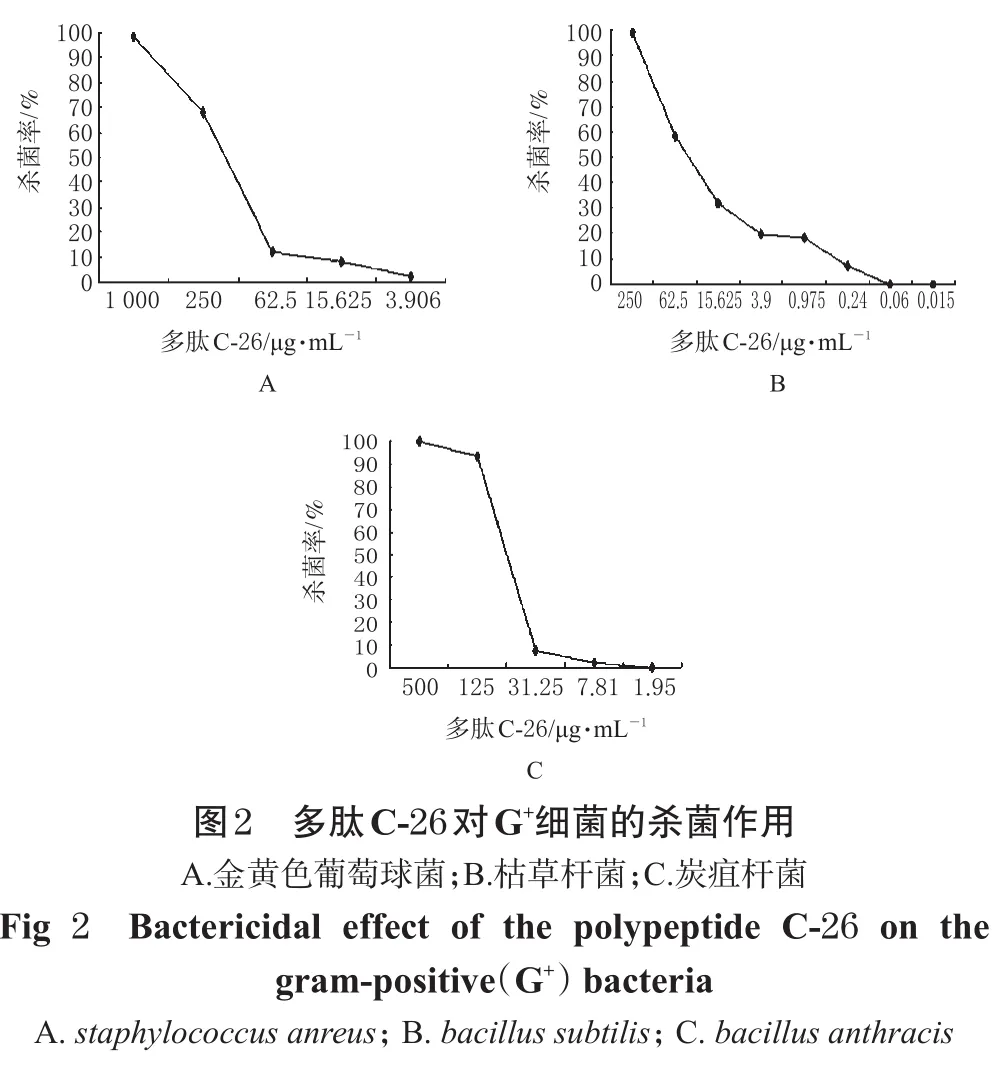
3.3 多肽C-26對G-細菌的殺菌作用
多肽C-26濃度在500 mg·L-1時,對大腸桿菌、變形桿菌和綠膿桿菌3種G-細菌的殺菌率較為接近,在41%~52%之間,殺菌敏感性由高到低依次為:變形桿菌>綠膿桿菌>大腸桿菌。多肽C-26對G-細菌的殺菌作用詳見圖3。
4 討論
4.1 多肽C-26的設(shè)計
已知的絕大部分抗菌多肽在結(jié)構(gòu)上有一個共同的特點,就是帶凈正電荷,在多肽分子的組成中有較多的堿性氨基酸殘基,較少或者沒有酸性氨基酸殘基[1]。本課題組先前對人ⅡA型PLA2的研究已注意到,ⅡA型PLA2分子組成中,也帶有較多堿性氨基酸殘基,所以分子帶較多的凈正電荷,其殺菌作用強度與分子攜帶的凈正電荷成正相關(guān)[4]。因此,本研究以人ⅡA型PLA2為模板,分析其結(jié)構(gòu),選擇ⅡA型PLA2分子中堿性最強的多肽片段。在ⅡA型PLA2分子的C末端,有1段長度為26個氨基酸殘基的片段,約占模板分子1/5的長度,符合這一條件。其中,有8個堿性氨基酸殘基,而沒有任何酸性的,這一片段在已知的其他哺乳動物體內(nèi)也高度保留,特別是其攜帶較多凈正電荷的特性。另外,在ⅡA型PLA2分子的結(jié)構(gòu)中,這一片段沒有較復雜的結(jié)構(gòu),如α-螺旋或者β-片層結(jié)構(gòu),也較適合作為一個簡單多肽合成。因此,本研究選擇這一片段進行合成,并檢測其殺菌作用。有學者曾根據(jù)蛇毒PLA2分子的C末端區(qū)域部分氨基酸順序合成了抗菌多肽(長度為13個氨基酸殘基)并進行研究,但考慮到蛇毒PLA2分子殺菌作用比人ⅡA型PLA2分子低1000倍以上[5],且蛇毒PLA2分子的結(jié)構(gòu)與人的有很大差別,作為藥物很有可能產(chǎn)生抗原性,故選擇人ⅡA型PLA2分子作為模板可能更為恰當。
4.2 多肽C-26的殺菌作用
本研究結(jié)果表明,多肽C-26對試驗的G+細菌有較強的殺菌作用,其殺滅99.9%細菌的多肽濃度在250~1000 mg·L-1之間;對3種G-細菌的殺菌作用比較弱,當其濃度在500 mg·L-1時對三者的殺菌率相差不大,為41%~52%。之前本課題組對ⅡA型PLA2殺菌作用的研究表明,該分子對G+細菌有很強的殺菌作用,對G-細菌則很弱[4,6,7]。這提示多肽C-26與ⅡA型PLA2結(jié)構(gòu)具有的類似性,決定了其殺菌作用的類似,因此其應(yīng)該具有類似的殺菌機制。但是,本研究也注意到,多肽C-26的殺菌作用比ⅡA型PLA2分子明顯偏弱,具體原因值得進一步探索。
4.3 多肽C-26的殺菌機制
前面提到,已知的絕大部分抗菌多肽在結(jié)構(gòu)上有一個共同點,那就是有較多堿性氨基酸殘基,分子帶凈正電荷。而在殺菌機制上,也與這一結(jié)構(gòu)特點密切相關(guān)。細菌的細胞膜外層和內(nèi)層都含有大量的酸性磷脂,如心磷脂和磷酸甘油,使得細菌的細胞膜帶有大量負電荷,那些帶有正電荷的抗菌多肽通過電荷的吸引力,結(jié)合到細菌的胞膜表面,進而插入細胞膜內(nèi)層,使胞膜變薄和損壞,引起細菌死亡。由于高等生物是由真核細胞組成,而真核細胞的細胞膜的外層主要由不帶電荷的中性磷脂組成,使得這類抗菌多肽不能有效地結(jié)合到真核細胞膜上,故對人等高等生物沒有危害[1]。本課題組對ⅡA型PLA2的殺菌機制進行過研究,也發(fā)現(xiàn)其與抗菌多肽有類似的機制[8,9]。雖然本文尚未對多肽C-26的殺菌機制進行研究,但根據(jù)其結(jié)構(gòu)特點,推測其應(yīng)該也具有與其他抗菌多肽類似的殺菌機制,而具體的情況還有待進一步的分析。
[1]Wiesner J,Vilcinskas A.Antimicrobial peptides:the ancient arm of the human immune system[J].Virulence,2010,1(5):440.
[2]Tian ZG,Dong TT,Teng D,et al.Design and characterization of novel hybrid peptides from LFB15(W4,10),HP(2-20),and cecropin A based on structure parameters by computer-aided method[J].Appl Microbiol Biotechnol,2009,82(6):1097.
[3]Catiau L,Traisnel J,Delval-Dubois V,et al.Minimal antimicrobialpeptidicsequencefromhemoglobinalpha-chain:KYR[J].Peptides,2011,32(4):633.
[4]梁寧生,楊帆,陸益,等.具強殺菌活性的兔Ⅱ型磷脂酶A2互補DNA克隆及其順序確定的研究[J].廣西醫(yī)科大學學報,1999,16(3):237.
[5]Paramo L,Lomonte B,Pizarro-Cerda J,et al.Bactericidal activity of Lys49 and Asp49 myotoxic phospholipases A2from Bothrops asper snake venom--synthetic Lys49 myotoxinⅡ-(115-129)-peptide identifies its bactericidal region[J].Eur J Biochem,1998,253(2):452.
[6]Weinrauch Y,Abad C,Liang NS,et al.Mobilization of potent plasma bactericidal activity during systemic bacterial challenge.Role of groupⅡA phospholipase A2[J].J Clin Invest,1998,102(3):633.
[7]李艷,梁寧生,陸益,等.不同生長時期的金黃色葡萄球菌對重組人血小板型磷脂酶A2的敏感性研究[J].中國藥房,2009,20(25):1945.
[8]Koprivnjak T,Peschel A,Gelb MH,et al.Role of charge properties of bacterial envelope in bactericidal action of human groupⅡA phospholipase A2 against Staphylococcus aureus[J].J Biol Chem,2002,277(49):47636.
[9]李艷,梁寧生,楊帆,等.重組人血小板型磷脂酶A2體外抗金黃色葡萄球菌的活性及其影響因素研究[J].中國藥房,2008,19(28):2177.

