銀杏內酯B對胚胎大鼠中腦神經細胞的作用研究
譚才宏,錢小薔,馬洪峰(.江蘇大學附屬醫院藥劑科,鎮江市00;.江蘇丹陽市人民醫院藥劑科,丹陽市 300)
銀杏提取物含有多種活性成分,包括銀杏內酯A、B、C、M、J和白果內酯。銀杏內酯B(GBE)具有抗炎、抗過敏、抗休克、抗腫瘤等廣泛的生物學作用。其不但對缺血、缺氧等多種因素引起的神經細胞損傷有保護作用,而且還具有促進學習記憶、促進神經系統發育和神經干細胞向神經細胞分化,防治老年性癡呆等神經系統退行性疾病等諸多重要作用。從細胞學方面來說,近年來,GBE對細胞的作用研究很多,如GBE能拮抗谷氨酸所致的腦皮質神經細胞毒性作用;GBE對局灶性腦缺血再灌注損傷大鼠具有保護作用;GBE對膽固醇和載脂蛋白E4(ApoE4)共損傷海馬神經元膽堿能系統具有保護作用;GBE可促進分化細胞成熟,促進神經干細胞向神經元分化;GBE可拮抗谷氨酸誘導的視網膜神經細胞凋亡等[1,2]。而GBE對中腦神經細胞的保護作用及其機制的探討未見文獻報道。
海人藻酸(KA)能使胞漿或線粒體內超氧化物岐化酶(SOD)水平降低或消失,其通過降低神經細胞對氧自由基的清除能力而使得氧自由基在神經細胞內聚集,引起細胞的繼發性損傷[3~5]。因此,自由基導致細胞膜和線粒體損傷作用成為KA引起神經細胞損傷的主要因素。本文以此為模板探討GBE對中腦神經細胞作用的機制。
1 儀器與材料
1.1 儀器
電子天平(上海天平儀器廠);微量加樣器(法國Gildon公司);M 200型酶標儀(瑞士Tecan公司);Mz12.5型體視顯微鏡(德國Leica公司);CO2培養箱(美國Shellab公司);倒置相差顯微鏡(日本Olympus公司);TDL-5C型臺式低速離心機(上海菲恰爾分析儀器有限公司)。
1.2 試藥
GBE(批號:071204)、左旋多聚賴氨酸(批號:070716)、MTT(批號:070416)、KA(批號:080264)均購自美國Sigma公司;DMEM干粉培養基(批號:070405),胰蛋白酶(1∶250)均購自美國Gibco公司;胎牛血清(杭州四季青生物制品有限公司,批號:080103);臺盼藍(上海歐韋達儀器科技有限公司);神經生長因子(NGF,北京邦定公司,批號:070106);一氧化氮(NO)、SOD、丙二醛(MDA)試劑盒均由武漢博士德生物工程有限公司提供。
1.3 動物
健康成年Wistar大鼠,♀♂(2∶1),體重(250±20)g,由江蘇大學實驗動物中心提供(動物生產許可證號:SYXK(蘇)2008-0024)。下午6:00合籠,次晨鏡檢♀鼠陰道的精子,以檢出精子為0 d,第14天孕鼠脫頸椎法處死。
2 方法
2.1 胚胎大鼠中腦神經細胞懸液的制備
取14 dWistar孕鼠,用頸椎脫落法處死,放入盛有75%酒精容器內,消毒5m in,于無菌條件下取出胚胎浸于培養基中,無菌取胎鼠中腦組織;用PBS液洗凈血污,剪碎,置0.25%胰蛋白酶溶液中37℃消化5m in,吸除消化液,用含血清的培養基終止消化;加完全培養基反復吹打制成單細胞懸液。200目不銹鋼篩網過濾。
2.2 胚胎大鼠中腦神經細胞的原代培養
用含10%胎牛血清的DMEM培養基將細胞密度調整至4×106個/m L的細胞懸液,細胞接種在涂有10mg·L-1左旋多聚賴氨酸多孔培養板上,于CO2培養箱中(37℃,5%CO2)培養。24 h待大部分細胞貼壁后,全量換液1次,以后每2~3 d半量換液。此法不需使用抑制膠質細胞的藥物,減少了藥物對神經細胞的損傷,使神經細胞生長更接近自然環境。
2.3 分組
試驗分為7組,即正常對照、GBE對照(50mg·L-1)、KA(100 μmol·L-1)、NGF(50mg·L-1)和GBE高、中、低劑量(100、50、25mg·L-1)組。每個劑量為6孔,每孔400 μL。于中腦神經細胞培養第10天,分別測定指標。
2.4 神經元鑒定
采用神經元特異性烯醇化酶(NSE)免疫組化法染色對原代培養的神經元進行鑒定。
2.5 中腦神經細胞內MDA、NO含量和SOD活性測定
用2.5 g·L-1胰蛋白酶消化收集細胞,再用PBS漂洗3次,制成單細胞懸液,低溫超聲粉碎細胞,4 000 r·min-1離心,取出上清液待測。采用黃嘌呤氧化酶法測定SOD的活性;改良的硫代巴比妥酸法測定MDA含量;硝酸還原酶法測定NO含量。
2.6 統計方法
3 結果
3.1 NSE免疫組化染色對神經元的鑒定
NSE免疫反應呈棕黃色,顆粒狀,陽性染色分布于神經元的胞質及突起中,神經膠質細胞不著色。GBE高、中、低劑量組細胞生長、分化程度明顯好于KA組。免疫組化圖片見圖1。

圖1 免疫組化圖片A.正常對照組;B.GBE對照組;C.KA組;D.GBE低劑量組;E.GBE中劑量組;F.GBE高劑量組;G.NGF組Fig 1 Immunohistochem icalpictures A.normal control group;B.GBE control group;C.KA group;D.GBE low dose group;E.GBEmedium dose group;F.GBE high dose group ;G.NGFgroup
3.2 中腦神經細胞SOD活性和NO、MDA含量的測定
KA組SOD活性顯著低于正常對照組(P<0.01);GBE高、中、低劑量組SOD活性隨著GBE濃度的增大而增強,與模型組比較有顯著性差異(P<0.01或P<0.05)。
KA組MDA、NO含量顯著高于正常對照組(P<0.01);GBE高、中、低劑量組MDA和NO含量隨著GBF濃度的增大而逐漸減小,與模型組比較有顯著性差異(P<0.01或P<0.05)。中腦神經細胞SOD活性、MDA和NO含量測定結果見表1。
表1 中腦神經細胞SOD活性、MDA和NO含量測定結果(±s,n=6)Tab 1 Results of the SOD activities,MDA and NO contents ofm idbrain neuron(s±s,n=6)
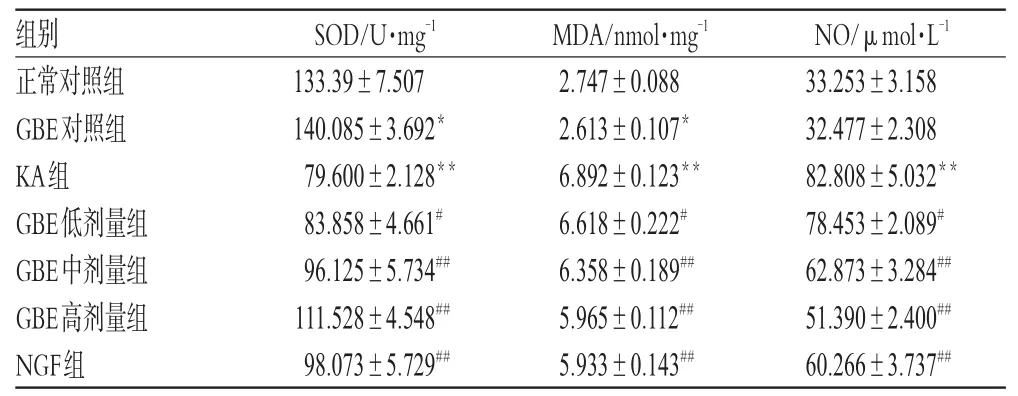
表1 中腦神經細胞SOD活性、MDA和NO含量測定結果(±s,n=6)Tab 1 Results of the SOD activities,MDA and NO contents ofm idbrain neuron(s±s,n=6)
與正常對照組比較:*P<0.05,**P<0.01;與KA組比較:#P<0.05,##P<0.01vs.normal control group:*P<0.05,**P<0.01;vs.KA group:#P<0.05,##P<0.01
NO/μmol·L-1 33.253±3.158 32.477±2.308 82.808±5.032**78.453±2.089#62.873±3.284##51.390±2.400##60.266±3.737##組別正常對照組GBE對照組KA組GBE低劑量組GBE中劑量組GBE高劑量組NGF組SOD/U·mg-1 133.39±7.507 140.085±3.692*79.600±2.128**83.858±4.661#96.125±5.734##111.528±4.548##98.073±5.729##MDA/nmol·mg-1 2.747±0.088 2.613±0.107*6.892±0.123**6.618±0.222#6.358±0.189##5.965±0.112##5.933±0.143##
4 討論
中腦神經細胞損傷是多種病理機制相互作用的結果。在諸多損傷機制中,主要是線粒體內電子傳遞失調致使氧分子接受單個電子生成氧自由基,同時黃嘌呤氧化酶(XO)系統被激活,XO在將ATP的降解產物次黃嘌呤轉化為黃嘌呤的同時,產生大量氧自由基。另外,SOD等自由基清除系統被大量消耗,造成自由基堆積。自由基損傷的主要病理機制是引發脂質過氧化反應。由于腦組織中富含脂質,極易受到自由基的攻擊,導致脂質過氧化反應,激起自由基連鎖和增殖反應,形成一系列脂質自由基及其降解產物MDA。
越來越多的研究發現,自由基產生與腦缺氧、缺血性損傷有關,并認為氧化應激在其發生發展中起關鍵作用[6]。正常生物氧化過程中,活性氧自由基處于不斷產生與清除的動態平衡中,當外界因素打破這種平衡時,過量產生的自由基可誘發不飽和脂肪酸發生脂質過氧化反應。與其他臟器相比,胚胎中腦組織更易受自由基的攻擊。腦內的SOD等抗氧化物水平改變,腦組織抗氧化能力就會失去平衡,因此胚胎中腦脂質過氧化的發生率最高[7]。脂質過氧化發展到一定程度使細胞膜失去流動性,膜電位降低,膜對離子通透性增加,線粒體不能產生能量,溶酶體水解酶外漏,與蛋白質反應滅活酶,抑制蛋白質的合成,產生細胞毒性作用,最終導致細胞破裂和組織溶解。
本研究用不同濃度GBE作用于中腦神經細胞,結果表明,當GBE濃度在25~100mg·L-1范圍內具有明顯的抗自由基作用,抑制脂質過氧化反應,增強細胞抵抗KA損傷的能力。其作用強度與NGF相當,這可能與GBE的分子結構有關。
從NO和MDA數據分析,GBE組與正常對照組相比相差不大。以前的研究表明,GBE能對興奮性神經毒過程中的細胞提供保護作用[8]。在研究中筆者進一步發現,GBE只有在與KA同時使用處理細胞才能有效地抑制KA所致的神經細胞損傷,單獨使用GBE對培養細胞的NO和MDA無明顯影響。這間接的表明血小板活化因子(PAF)可能作為第二信使參與了KA誘導神經細胞損傷的信號傳遞過程,這與Mukherjee PK等[9]研究結果一致。GBE可能通過競爭PAF受體阻斷PAF介導的興奮性神經毒信號傳遞過程,提高抗氧化酶的活性和清除自由基,從而提供神經保護作用。GBE高、中、低劑量組NO和MDA含量遠低于KA組(P<0.01或P<0.05),并呈現濃度依賴性,進一步說明GBE具有抗自由基作用,能更好地保護神經細胞的DNA蛋白質,使膜脂質不被氧化損傷。
綜上所述,GBE對中腦神經細胞生長的促進作用和保護作用機制可能與GBE提高細胞的SOD活性,降低細胞的NO、MDA含量有關。
[1]梁中琴,朱 益,顧振綸,等.心腦通保護血管內皮細胞損傷的實驗研究[J].中草藥,2002,33(11):1 006.
[2]Jun YM,ZhiQ,Zhao CA.The involvementof gila in the long-term plasticity in the spinal dorsal horn of the rat[J].Neuroreport,2002,13(14):1 781.
[3]邵潤軒,王江濱,郭鶴佳,等.原發性肝癌血漿一氧化氮含量及組織中誘導型一氧化氮合酶的表達[J].世界華人消化雜志,2000,8(8):935.
[4]Amaro MJ,Bolome J,Pardo M,et al.Decreased nitric oxide production in chronic viral hepatitis B and C[J].J Med Virol,1997,51(4):326.
[5]Gupta YK,Briyal S,Sharma M.Protective effectof curcum in against kainic acid induced seizures and oxidative stress in rats[J].Indian J Physiol Pharmacol,2009,53(1):39.
[6]姜積明,吐爾遜江,王 敏.維生素C對人體疾病的影響及其在康復預防中的作用[J].中國臨床康復,2004,8(15):2 940.
[7]Asplund KV,Jansson PJ,Lindq V,etal.Measurementof asconbic acid(Vitaminc)induced hydroxyl radicalgeneration in household drinking water[J].Free Radic Res,2002,36(12):1271.
[8]王志娟,高 爾,法志強.銀杏葉提取物治療阿爾茨海默病的研究進展[J].中國藥房,2007,18(36):2 863.
[9]Mukherjee PK,De Coster MA,Campbell FZ,etal.Glutamate receptor singaling interplaymodulates stress-sensitivem itogen-activated protein kinases and neuronal death[J].JBiolChem,1999,274(10):6 493.

