不同途徑移植骨髓間充質干細胞對脊髓損傷修復效果研究
范東艷, 王 蘋, 劉 然, 魯質成
干細胞作為種子細胞是再生醫學研究領域最重要和最基本的環節。理想的種子細胞應該具有取材方便、對機體損傷小、體外增殖傳代能力強、易定向分化、生物毒性低、無致瘤性等特點。近年來研究發現[1~3],骨髓間充質干細胞(BMSCs)具有與胚胎干細胞相似特性,可塑性強,易被誘導分化;強化骨髓間充質干細胞機能可增強對實質細胞功能表達調控,保持其長期穩定性,還可以補充替代壞死的實質細胞甚至可使少數變異細胞正常化。BMSCs移植治療脊髓損傷(SCI)已受到了廣泛關注,BMSCs移植進入體內后,可通過血腦屏障到達損傷部位,通過替代損傷神經元、填充缺損部位、分泌營養因子、調節自身免疫等過程實現保護和促進神經元功能恢修[4,5]。目前研究顯示[6],BMSCs 可以通過多種途徑移植進入體內,無論通過哪種途徑移植BMSCs到宿主體內均可不同程度發揮作用,但是通過哪條途徑移植BMSCs對SCI修復效果更好尚未見報道。故本實驗通過分別從損傷部位和腰骶鞘內兩條途徑移植BMSCs,探討不同途徑移植BMSCs治療SCI的療效。
1 材料與方法
1.1 主要試劑和儀器 實驗動物:清潔級20g Wister大鼠、180gWister大鼠,購自吉林大學實驗動物中心。細胞培養試劑:吉林大學醫學院動物中心。細胞培養試劑:PMEM/F12和小牛血清購自Gibco公司;HE染液(I nvitrogen公司)、微型打磨機(Invitrogen公司)、CO2培養箱(日本SANYO)、切片機(SHANDONAS620)、倒置相差顯微鏡 (Olympus)、Fluview 1000激光掃描共聚焦顯微鏡(Olympus)。
1.2 BMSCs分離培養 無菌條件下取重20g Wister大鼠雙側股骨、脛骨、肱骨,兩端剪開,用裝有DMEM/F12的無菌注射器沖洗骨髓入30ml離心管;1000r/min離心5min;將細胞團輕柔打散并以1×106個/ml細胞接種于完全培養液內,完全培養液為DMEM/F12培養基+15%胎牛血清+100U/ml青霉素和100U/ml鏈霉素;將細胞培養于37℃ 5%CO2飽和濕度培養箱內。
培養72h更換培養液,以后每3d換液1次。細胞長到80%融合時用0.25%的胰酶消化傳代,以1×106個/ml的密度接種于傳代培養瓶中進行擴增培養。采用及時、反復傳代對細胞進行純化。
1.3 動物模型制備 本實驗中采用了脊椎骨破壞技術的改進方法:將Wistar大鼠伏臥固定在手術臺上;以大鼠第10胸椎為中心,無菌條件下暴露T10棘突并暴露出棘突及兩側椎板;暴露脊髓背側硬膜,顯微鏡下切開硬脊膜,借助腦膜鑷和虹膜刀等器械,以脊髓后動脈(半橫斷)及中央管(背側半橫斷)為界,在脊髓正中向一側橫行切開,切斷脊髓達中央導水管,即可切斷半側脊髓,局部脊髓表面呈暗紅色,并適度搗毀局部脊髓組織。經制模效果評價后即可縫合硬脊膜、肌肉及皮膚。表面外敷青霉素20萬U粉末。術后每天行人工擠壓膀胱排尿2次,直至大鼠恢復自主排尿。
1.4 實驗分組 實驗分為4組,模型組,SCI模型大鼠6只;損傷局部移植BMSCs組,模型大鼠6只損傷局部微注射細胞5μl(5×107cells);腰骶鞘內移植BMSCs組,模型大鼠6只腰骶鞘內微注射5μl(5×107cells);陰性對照組正常大鼠5只。
1.5 行為學評分標準 分別于細胞移植后的1、2、3w對各組動物進行BBB評分。
1.6 HE染色 將組織取材后制成冰凍切片貼至玻片上,備用。蘇木素染液5min;沖洗3min;分化液分化10s;自來水沖洗3mins;返藍液返藍5min;沖洗3min;伊紅液5min;沖洗3min;梯度乙醇脫水,各1min;二甲苯透明3次,各1min;中性樹膠封片,晾干后觀察。
1.7 統計學處理 使用 Sigma Stat2.03軟件進行統計學分析。所有數據來自5次獨立的實驗,以表示,統計學處理采用單因素方差分析,q檢驗,P<0.05認為差異有意義。
2 結果
2.1 行為學觀察及運動評價 正常大鼠術前四肢活動自如,BBB評分均可達21分。脊髓橫斷后,雙后肢立即完全癱瘓,術后BBB評分為0分。細胞移植術后1w,各組大鼠后肢功能恢復均不理想,組間的 BBB評分差異無統計學意義(P>0.05);術后2、3周w細胞移植組與其他兩組比較均有明顯的差異,有統計學意義(P<0.05)見表1。
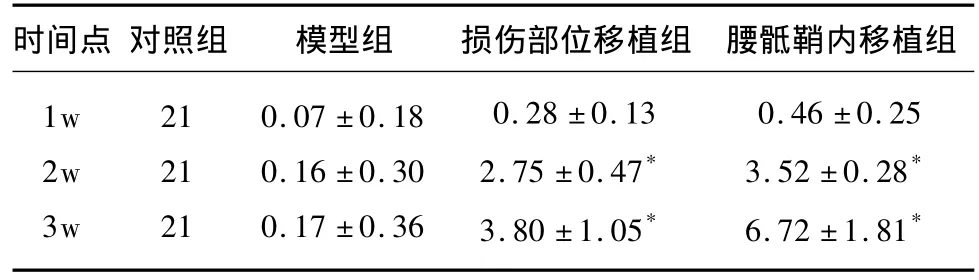
表1 各組不同時間點大鼠BBB后肢運動評分
2.2 形態學觀察 損傷后14d大鼠脊髓標本切片蘇木精-伊紅染色均可見脊髓損傷區組織壞死,細胞腫脹,結構不清,7d以后傷處形成囊腔及膠質癱痕。損傷區細胞內可見到細胞核固縮、碎裂、溶解,胞漿紅染及空泡性(見圖1)。
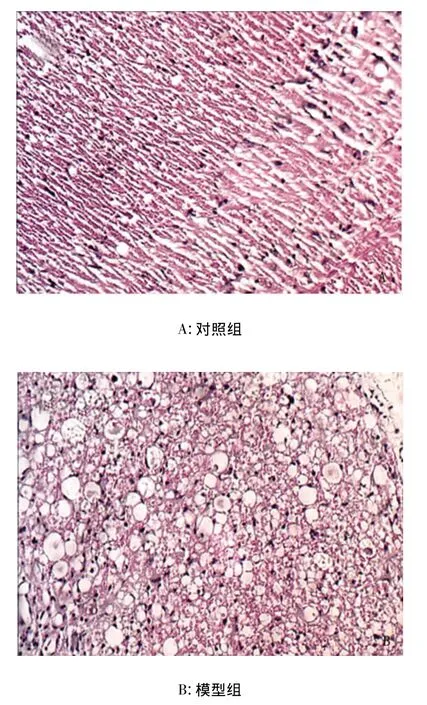
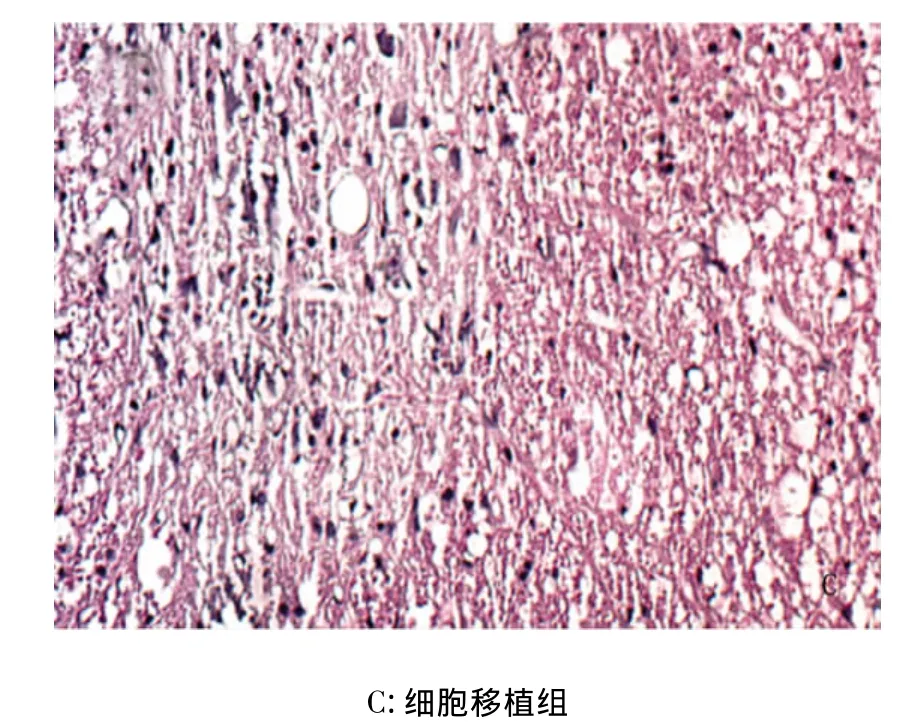
圖1 HE染色(×200)
2.3 不同細胞移植途徑對脊髓損傷修復的影響 局部細胞移植脊髓變性較重,軸突數目較少,微囊數目較多,而經腰骶鞘內移植組脊髓變性較模型組輕,軸突數目較多,微囊數目較少,遠側細胞移植組,脊髓損傷程度與局部移植組相比明顯減輕。可見神經纖維和血管增生、修復更明顯(見圖2)。
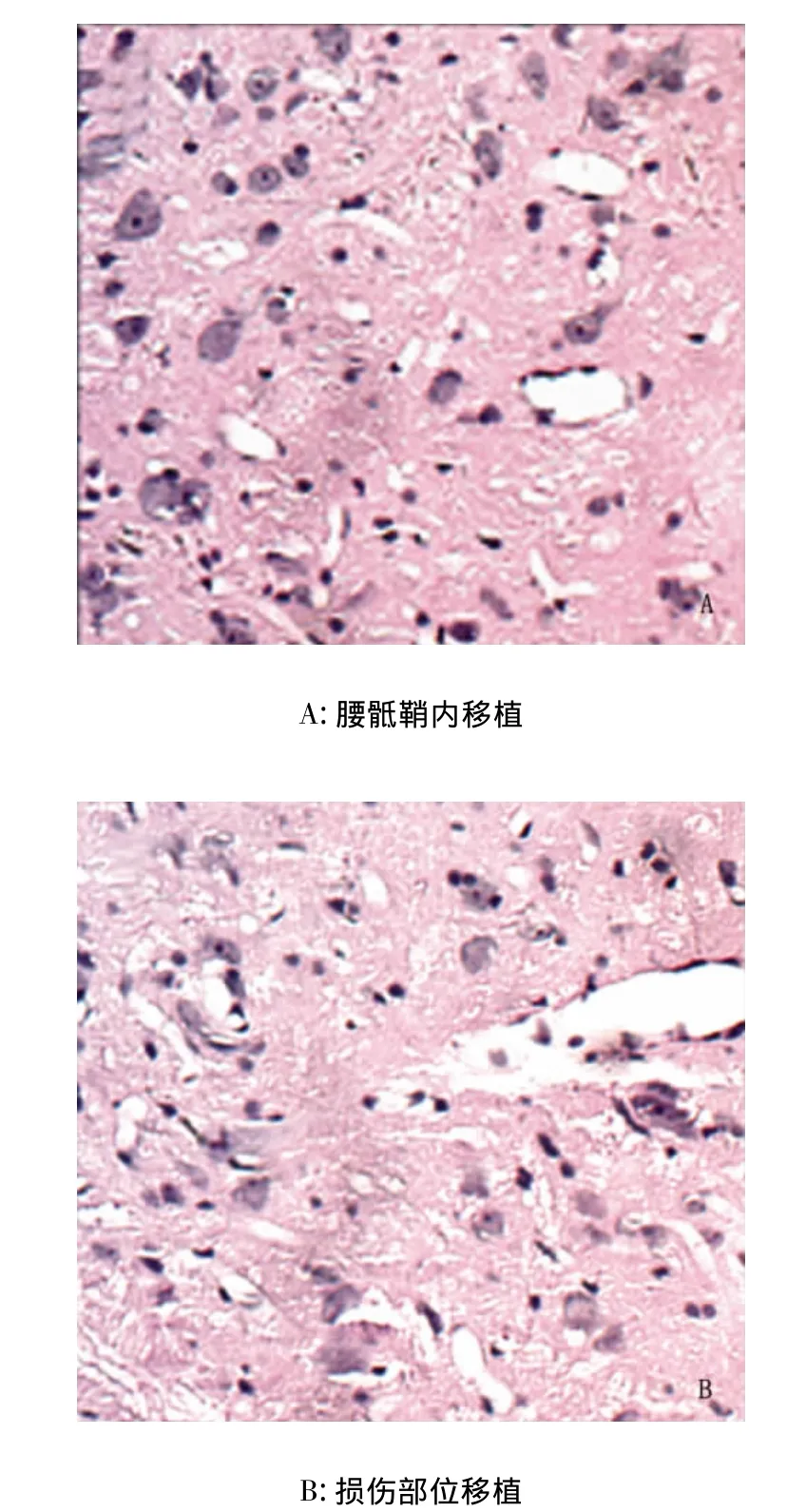
圖2 HE染色結果(×200)
3 討論
脊髓組織損傷后功能的恢復與重建極其困難,主要的原因歸咎于不斷加重的繼發性損害及神經元受損后難以自我修復[7~10]。BMSCs具有多向分化潛能且有較強的可塑性,是當前研究神經損傷細胞移植治療的主要種子細胞之一。BMSCs在體內的遷移、定居、分化受多種因素的影響,宿主體內特有的微環境及其分泌的某些因子可能是促使BMSCs定居、分化的重要因素[11,12]。BMSCs移植到宿主體內后,不但可以挽救殘存的神經元,還可以替代神經元細胞發揮傳導功能的作用。BMSCs還可分泌多種神經營養因子,促進神經元再生保護殘存的神經元[13,14]。BMSCs治療 SCI的機制尚不清楚,但療效已得到了普遍的認同,目前BMSCs治療SCI可通過多種途徑移植進入宿主體內,究竟是哪種途徑能取得最佳的治療效果尚沒有統一的認識,為了取得更好治療效果,了解不同移植途徑的治療效果是非常必要的。
3.1 BMSCs移植治療可早期出現運動功能恢復 迄今為止,脊髓中樞神經損傷導致功能障礙等治療,最好的辦法似乎是集中的物理療法。運動訓練的目的是盡量減少功能障礙,最大限度恢復運動功能。認為其機制是神經可塑性發生了變化。然而,得出的結果很有限,獲得的功能往往很小,脊髓損傷的康復療法仍不能令人滿意。SCI的病理生理機制極其復雜,若要對其進行深入的研究就要建立一個標準化的、可重復的、與臨床接近的、可調控的SCI動物模型。我們在研究中考慮到SCI后可塑性、神經再生、移植等基礎研究,所以采用了脊髓半橫斷傷模型制作技術,成功造模標志為大鼠一側軀體及下肢痙攣性抽搐后癱瘓。在造模的過程中對脊椎骨破壞的技術方法進行了適當的改進,結果顯示,模型動物癱瘓率為100%。
運動功能的評價是衡量SCI治療效果的最有力標準。運動功能的評價方法也有很多種,例如BBB評分法、斜板實驗、聯合評分法及Tarlov評分法等。我們在實驗中采用了BBB評分法,該方法操作簡單,無需特殊設備,可較好的反映SCI嚴重程度和恢復程度。實驗結果顯示,細胞移植術后1周,各組大鼠后肢功能恢復均不理想,組間的BBB評分差異無統計學意義(P>0.05);術后2,3w細胞移植組與其他各組比較均有明顯的差異,有統計學意義(P<0.05),提示BMSCs移植治療SCI后,運動功能的恢復隨時間的延長而增強。組織結構的形態學評價結果顯示,模型組的組織形態主要呈結締組織樣結構,且有大量的空泡;細胞移植組,可見散在的核藍染細胞,組織內空泡數量明顯少于模型組。提示BMSCs可以填充組織缺損并定居于損傷部位。
3.2 不同移植途徑的效果分析 脊髓損傷處定位細胞移植可能會給局部帶來再次損傷的危險,故目前應用BMSCs細胞移植修復脊髓損傷多采用遠端移植法[15,16],因此遠處 BMSCs 移植,細胞對損傷部位的修復效果就成為研究熱點。許多研究已經表明[17~19],BMSCs具有定向遷移到某些特定組織的能力,特別是在這些組織發生損傷之后。2003年,有學者[20]將標記的BMSCs采用注射方法直接移植到小鼠心肌內,移植后1w發現供體BMSCs存在的新生血管出現在注射部位。
本實驗采用損傷部位移植和腰骶鞘內移植兩種方法移植BMSCs,探討不同途徑移植 BMSCs治療SCI的療效。結果顯示,腰骶鞘內移植后,運動功能的恢復均較局部移植的效果好。考慮可能因為局部移植是在原有損傷區域內進行細移植,在某種程度上加重了原有的損傷,導致組織修復延緩;而腰骶鞘內移植是在損傷的區域外進行,所以不會加重原損傷或延緩組織的修復過程。
形態學研究結果顯示,腰骶鞘內移植組較局部細胞移植組脊髓變性輕、軸突數目多、微囊數目少,可見神經纖維和血管增生、修復更明顯。結合運動功能評價結果提示,通過腰骶鞘內移植BMSCs療效好于經損傷部位直接移植細胞。雖然BMSCs治療脊髓損傷還存在許多未解之謎,隨著研究的逐步深入,BMSCs的特性將進一步闡明,BMSCs治療神經系統疾病的前景將更加廣闊。
[1]張增山,文益民,韓 夏,等.骨髓間充質干細胞移植治療成鼠脊髓損傷的研究[J].西北國防醫學雜志,2010,31(4):241-243.
[2]吳宗輝,賈功偉,虞樂華.骨髓間充質干細胞治療脊髓損傷的研究進展[J].細胞與分子免疫學雜志,2010,26(10):1057.
[3]Park IH,Zhao R,West JA,et al.Reprogramming of human somatic cells to pluripotency with defined factors[J].Nature,2008,451(7175):141-146.
[4]Blits B,Bunge MB.Direct gene therapy for repair of the spinal cord[J].J Neurotrauma,2006,23(3-4):508-520.
[5]李志營,步星耀,張圣旭,等.自體骨髓干細胞動員移植與手術移植治療脊髓損傷的實驗研究[J].中華臨床醫師雜志,2010,4(9):1587-1594.
[6]Chamberlain G,Fox J,Ashton B,et al.Concise review:mesenchymal stem cells:their phenotype,differentiation capacity immunological features,and potential for homing[J].Stem Cells,2007,25(11):2739-2749.
[7]Meuleman N,Tondreau T,Deforge A,et al.Human marrowmesenchymal stem cell culture serum-free medium allows better expfansion than classical alpha-MEM medium[J].Eur J Haematol,2006,76(4):309-316.
[8]Bonner JF,Blesch A,Neuhuber B,et al,Promoting directional axon growth from neural progenitors grafted into the injured spinal cord[J].J Neurosci Res,2010,88(6):1182-92.
[9]Liu S,Xu GY,Johnson KM,et al.Regulation of interleukin-1 beta by the interleukin-1 receptor antagonist in the glutamate-injured spinal cord:endogenous neuroprotection[J].Brain Res,2008,22(1231):63-74.
[10]Ferguson AR,Christensen RN,Gensel JC,et al.Cell death after spinal cord injury is exacerbated by rapid TNF-α-induced trafficking of GluR2-lacking AMPARs to the plasma membrane[J].J Neurosci,2008,28(44):11391-400.
[11]Tsuchiyama T,Nakamoto Y,Sakai Y,et al.Optimal amount of MCP-1enhances antitumor effects of suicide gene therapy against hepatocellular carcinoma by M1 mcrophage activation[J].Cancer Sci,2008,99(10):2075-2082.
[12]Tsai MC,Shen LF,Kuo HS,et al.Involvement of acidic firbroblast growth factors in spinal cord injury repair processes revealed by a proteomics approath[J].Mol cell Proteomics,2008,7(9):1668-1687.
[13]Okutan O,Solaroglu I,Beskonakli E,et al.Recombinant human erythropoietin decrease MPO and caspase-3 activity and improves early functional results after spinal cord injury in rats[J].J Clin Neurosci,2007,14(4):364-368.
[14]Nakamura S,Yamada Y,Baba S,et al.Culture medium study of human mesenchymal stem cells for practical use of tissue engineering and regenerative medicine[J].Biomed Mater Eng,2008,18(3):129-136.
[15]Hematti P.Role of mesenchymal stromal cells in solid organ transplantation[J].Transplant Rev,2008,22(4):262-273.
[16]Bareeyre FM.Neuronal repair and replacement in spinal cord injury[J].Neuro Sci,2008,(265):63-72.
[17]Imai M,Watanabe IM,Suyama K,et al.Delayed accumulation of activated macrophages and inhibition of remyelination after spinal cord injury in an adult rodent model[J].Neurosurg spine,2008,8(1):58-66.
[18]Chen WF,Sung CS,Jean YH,et al.Suppressive effects of intrathecal granulocyte colony-stimulating factor on excessive release of excitatory amino acids in the spinal cerebrospinal fluid of rats with cord ischemia:role of glutamate transporters[J].Neuroscience,2009,162(3):101-110.
[19]Elizabete Sant Anna da Costa,Antonia Lima Carvalho,Ana Maria Blanco Martinez,et al.Strapping the spinal cord:An innovative experimental model of CNS injury in rats[J].Journal of Neuroscience Methods,2008,170(1):130-139.
[20]Li XH,Yu XY,Lin QX,et al.Bone marrow mesenchymal stem cellsdiferentiate into functional cardiac phenotypes by cardiac microenvironment[J].J Mol Cell Cardiol,2006,54(8):3254-3266.

