慢性肺炎衣原體感染是慢性阻塞性肺病(COPD)的危險因子
周海英,胡志雄,張 熙,余竹元
2.復旦大學附屬中山醫院,上海 200032
慢性阻塞性肺疾病(簡稱慢阻肺,Chronic obstructive pu lm onary disease,COPD)是一種慢性氣道阻塞性疾病的統稱,主要指具有不可逆性氣道阻塞的慢性支氣管炎和肺氣腫兩種疾病。COPD是嚴重危害人類健康的常見病、多發病,預計到2020年為止,COPD是全世界第3主要死亡原因[1],死亡率居呼吸系統疾病之首。2006版《全球倡議》指出,在全球范圍內,吸煙是COPD最常見的危險因素。但是流行病學資料表明其他各種病因也可以參與,肺炎衣原體(Ch lam yd ia pneumoniae,Cpn)是急性和慢性上下呼吸道感染的明確原因,從體外和體內研
究得到的資料表明,Cpn感染可以參與COPD的兩個主要組成——小氣道疾病和肺氣腫的發展[2]。本研究對Cpn感染者分別給予阿奇霉素或安慰劑治療,旨在探討慢性Cpn感染和COPD之間可能的相關性。
1 材料與方法
1.1 材料 收集2005年7月-2010年9月來院就醫COPD患者165例為觀察組,其中男 105例,女 60例,平均年齡(68±10)歲,吸煙(546±178)支/年;選擇同期來院參加呼吸疾病體檢的老人80例為對照組,其中男52例,女28例,平均年齡(69±9)歲,吸煙(529±148)支/年。以上兩組在性別、年齡和年吸煙支數方面均無統計學差異(P>0.05)。
1.2 方法
1.2.1 臨床檢測 (1)單核細胞(PBMC)中Cpn-Ag的檢測:采集靜脈血3 m L EDTA抗凝,離心后吸出血漿備用。PBM C的分離:剩余血細胞用等量的等滲PBS稀釋混勻,再沿離心管壁緩慢加入到含有3 m L淋巴細胞分離液的離心管中。然后于室溫2 600 r/m in離心30 m in,用吸管小心吸出含PBMC的云霧狀層,低滲PBS洗滌PBMC 3次后備用。在每份PBMC標本中加入一定量PBS,使其成細胞懸液(約106個細胞/m L)。每份標本各取 2份 PBMC懸液10μL,于同一玻片上滴成2個圓點,其中1點作為空白對照。將玻片置于微波爐低火1min、中火1.5m in修復抗原,然后用丙酮固定。室溫涼干后,在每張玻片的一個圓點上加10μL PBS(即空白點),另1圓點(即測定點)上加 10μL熒光素標記的肺炎衣原體單克隆抗體(FITC-TT-401)稀釋液(用含0.01%伊文藍的PBS稀釋TT-401原液,工作濃度 1∶40),并置37℃恒溫水浴箱中孵育90 m in。孵育后的玻片于PBS中清洗3次后,再于蒸餾水中清洗3次,吹風機吹干。熒光顯微鏡下(HBO200汞燈,第1濾片:BG-12,第2片:CG-13和WILD8705)觀察大小均勻的特征性蘋果綠亮點。測定點內的熒光亮點數減去空白點內的熒光亮點數后的差數,作為判斷Cpn-Ag陽性的依據。抗原陽性判斷參照M uh lestein等[3]標準:強陽性(≥100個亮點/圓點),陽性(10~99個亮點/圓點),弱陽性(可疑陽性,5~9個亮點/圓點),陰性(≤4亮點/圓點)。(2)血漿中 Cpn-IgA、Cpn-IgG和 Cpn-IgM 滴度檢測,應用ELISA方法。(3)應用意大利COSMED公司的肺功能測定儀進行FEV1/FVC(%)指標的測定。
1.2.2 診斷標準 (1)COPD診斷標準:符合中華醫學會呼吸病學分會制定的COPD診斷分期分級標準,排除COPD以外影響肺功能的疾病和其他系統的嚴重疾病,受試前6h內未吸入短效支氣管擴張劑,12h內未吸入長效支氣管擴張劑,所有患者均攝 X線胸片。(2)肺炎衣原體感染標準:Cpn-IgA ≥1∶16,Cpn-IgG≥1∶64和 IgM≥1∶32[4]。
1.2.3 阿奇霉素或安慰劑治療研究 觀察組組COPD患者中的Cpn感染者用阿奇霉素治療,口服阿奇霉素劑量15mg?kg-1?d-1,每d2次,10d為 1個療程[5],對照組中的 Cpn感染者用安慰劑(淀粉片,單盲)治療[6]。入院當天和治療結束后第2d采集空腹血,用于檢測 PBMC中的Cpn-Ag,血漿中Cpn抗體效價的變化。
1.2.4 評價方法 臨床癥狀評分:根據COPD三大主要癥狀(咳嗽、咯痰、氣促),每個癥狀的嚴重程度不同進行SGRQ記分[7]。
1.3 統計學分析 計數資料用χ2檢驗,計量資料以平均數±標準差描述,治療前后用配對t檢驗,P<0.05有統計學意義。用STATA軟件進行相關分析和回歸分析。
2 結 果
2.1 COPD觀察組與對照組的Cpn急、慢性感染率情況 Cpn-Ag和Cpn-IgM代表急性感染標記物,Cpn-IgA和Cpn-IgG代表慢性感染標記物,檢測結果見表1。
2.2 兩組Cpn感染患者經阿奇霉素或安慰劑治療前后 Cpn-IgA、Cpn-IgG和 Cpn-IgM滴度改變情況。結果見表2。
2.4 兩組Cpn感染患者阿奇霉素或安慰劑治療前后臨床癥狀評分及FEV1/FVC(%)的變化 變化結果見表3。
2.5 相關分析和回歸分析 對COPD和性別 、吸煙、年齡、Cpn滴度進行相關分析,顯示COPD性別無相關性,P>0.05;與吸煙、年齡、Cpn滴度都有相關性,P值均小于0.05。在校正吸煙之后,多重線性回歸分析顯示,P=0.000,可信區間為[44.5316,61.3027]。與年齡的P=0.025,與Cpn滴度的P=0.006,與SGRQ計分的 P=0.049.

表1 兩組 Cpn急性、慢性感染率比較Tab.1 Comparison of acuteand chronic in fection rates of Cpn in two groups
3 討 論
國內外研究資料表明,多數COPD患者曾被肺炎衣原體(Cpn)感染過,Cpn感染可能參與COPD的兩種病變:小氣道疾病和肺氣腫[8]。本文以Cpn-Ag和Cpn-IgM 作為急性感染指標,通過對2組人群進行Cpn感染標記物檢測,觀察組Cpn急性感染率為51.5%(85/165),與對照組8.8%(7/80)比較差異有統計學意義(P<0.001),說明Cpn急性感染與COPD的加重關系密切,可能是COPD急性加重期的重要誘因之一。同時以Cpn-IgA和Cpn-IgG為慢性感染的指標,觀察組Cpn慢性感染率為63.0%(104/165),對照組為 18.8%(15/80),兩者之間差異具有顯著性差異(P<0.001)。胡志雄等[9]對有Cpn感染的COPD患者加用阿齊霉素治療,取得了較好療效,本研究擬采用阿奇霉素或安慰劑治療,來探討慢性Cpn感染和COPD之間可能的相關性。從表2可見,治療前后比較,觀察組中的Cpn-IgM抗體滴度明顯下降,差異有統計學意義(P<0.001),表3中觀察組的SGRQ計分和FEV1/FVC(%)癥狀改善也有顯著性差異(P<0.001)。從表2結果還可見觀察組治療后Cpn-A g、Cpn-IgA和Cpn-IgG滴度下降均無統計學意義(P>0.05),與van Zandbergen等[10]的報道一致。在Cpn感染患者中阿奇霉素治療對減少呼吸系統癥狀是有效的,尤其是COPD急性加重期,但對COPD穩定期或慢性Cpn感染患者尚需進一步觀察。慢性感染指標Cpn-IgA和Cpn-IgG抗體滴度下降無顯著性差異表明阿奇霉素很難完全殺滅肺炎衣原體,體外實驗亦證明阿奇霉素不能抑制單核細胞內的衣原體生長[11]。體內肺炎衣原體存在于單核細胞內,因此活抗原的存在不能被阿奇霉素根除,這可能與肺炎衣原體有獨特的依賴宿主細胞的發育周期有關,這也為今后研究如何完全殺滅體內的肺炎衣原體提供新的研究方向。
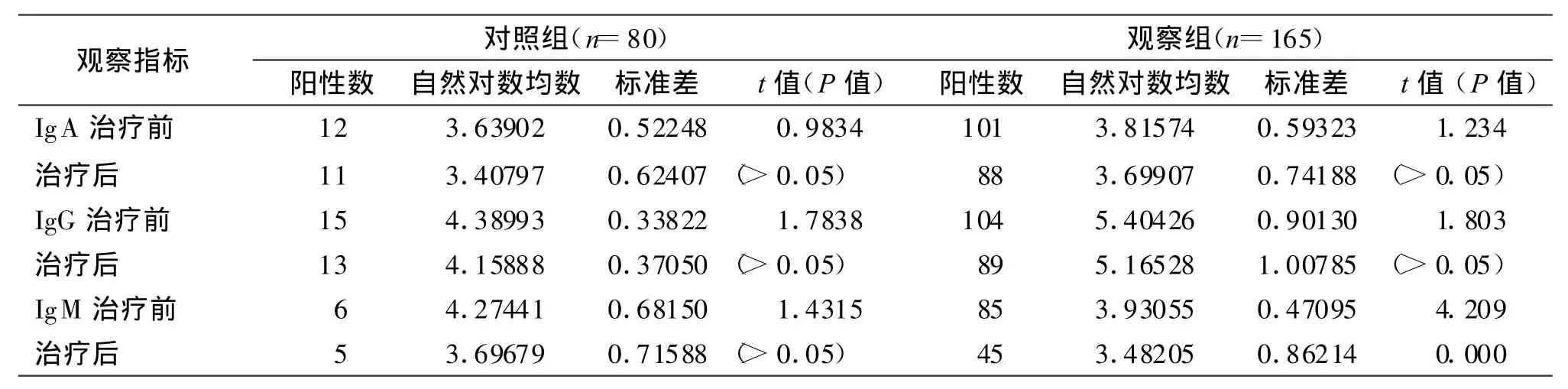
表 2 兩組治療前后 Cpn-IgA、-IgG和-IgM滴度的變化Tab.2 Changes of titers of Cpn-IgA,-IgG,and-IgM in two groups before and after treatment
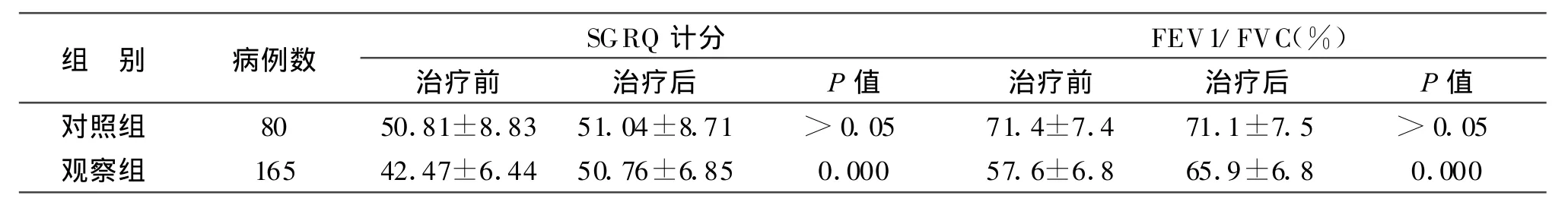
表3 兩組治療前后臨床癥狀計分和FEV1/FVC(%)的變化Tab.3 Changes of clinical symptoms scoreand FEV1/FVC(%)in two groupsbeforeand a fter treatment
SGRQ計分和FEV1/FVC(%)是反映COPD嚴重性的指標[12],通過對COPD和Cpn-IgG滴度、性別、年齡及吸煙支數進行相關回歸分析,顯示COPD與性別無相關性,P>0.05;與吸煙、年齡和Cpn-IgG滴度都有相關性,P值均小于0.05。在校正吸煙之后,多重線性回歸分析顯示,P=0.000,可信區間為[44.5316,61.3027]。與年齡的P=0.025,與Cpn-IgG滴度的 P=0.006,與 SGRQ計分的P=0.049。因此,慢性Cpn感染和COPD之間有顯著的統計學相關性,并且隨著Cpn-IgG滴度增加有一種降低肺功能的趨勢。分析結果提示,慢性Cpn感染可能是COPD發生、發展的獨立危險因素。K ru ll等[13]的實驗證明,肺炎衣原體TW-183株能激發人小氣道表皮細胞和支氣管表皮細胞株BEAS-2B,使其分泌粒細胞巨噬細胞集落刺激因子(GM-CSF)。Cpn還能引發一種早期的前炎癥信號放大系統,導致GM-CSF釋放。Cpn誘導的表皮細胞因子釋放可能導致于炎癥性氣道疾病如COPD或支氣管哮喘。COPD是炎性和免疫病因學的結合,肺氣腫是繼發于氣道阻塞。Cpn與COPD相關性的全部臨床意義有待于進一步研究。
[1]G roneberg DA,Chung KF.M odels of chronic obstructive pulm onary disease[J].Respir Res,2004,5:18.
[2]Brandén E,Koyi H,Gnarpe J,et al.Chronic Chlamyd ia pneumon iae infection is a risk factor for the development of COPD[J].Respir Med,2005,99(1):20-26.
[3]Muhlestein JB,Hamm ond EH,Carlquist JF,et al.Increase inciden ce of Chlamydia species w ithin the co ronary arteries of patien ts w ith symptomatic atherosclerotic versus other forms of cardiovascular disease[J].JAm Coll Cardiol,1996,27(7):1555-1561.
[4]Fan P,Dong F,H uang Y,etal.Ch lam yd ia pneumoniae secrection of a proteases-likeactivity factor for deg rading host cell transcription factor required form ajo r histocompatibility complex antigen expresion[J].Infection Immunity,2002,70(1):345-349.
[5]Lee PI,Wu MH,H uang LM,et al.An open,random ized,comparative study of clarithromycin and erythromycin in the treatment of children with community-acquired pneumonia[J].JM icrobiol Immunol Infect,2008,41(1):54-61.
[6]Brandén E,Koyi H,Gnarpe J,et al.Interm ittent azith romy cin treatment for respiratory symp tom s in patients w ith ch ronic Ch lamydia pneumoniae in fection[J].Scand J Infect Dis,2004,36(11-12):811-816.
[7]Medinas Amorós M,Mas-Tous C,Renom-Sotorra F,et al.H ealth-related quality of life is associated w ith COPD severity:a com parison betw een the GOLD staging and the BODE index[J].Ch ron Respir Dis,2009,6(2):75-80.
[8]M iyashita N.Ch lamy dia pneum oniae infection[J].Kekaku,2006,81(9):581-588.
[9]胡志雄,周海英,張熙,等.克拉霉素聯合噻托溴胺治療慢性阻塞性肺疾病(COPD)療效[J].中國人獸共患病學報,2011,27(2):120-123.
[10]van Zandbergen G,Gieffers J,Kothe H,et al.Ch lamy dia pneumoniae m ultiply in neu trophilg ranulocytes and delay their spontaneous apoptosis[J].J Imm unol,2004,172(3):1768-1776.
[11]Baker CL,Monz BU,et al.Cost effectiveness of tiotropium for chronic obstructive pu lmonary disease:a system atic review of the eviden ce[J].JMed Econ,2010,13(3):403-417.
[12]Seemungal TA,Lun JC,DavisG,et al.Plasma homocysteine is elevated in COPD patients and is related to COPD severity[J].Int JChron Obstruct Pu lmon Dis,2007,2(3):313-321.)
[13]K rull M,Bockstaller P,Wupermann FN,et al.M echanisms of Ch lamy doph ila pneumoniae mediated GM-CSF release in human bronchial epithelial cells[J].Am JRespir Cell Molto Biology,2006,3(3):375-382.

