讓學生體會化學有功于人類——《二氧化硫的性質和作用》教學設計
魯衍旭 楊華文 黃愛民
(1寶應縣安宜高中 江蘇 寶應 225800;2寶應縣教育局教研室 江蘇 寶應 225800)
一、教學背景
由于預習、由于資料、由于媒體、由于網絡,把許多原先認為需要探究,學生才能知道的內容,變成了己知,以至于許多探究演變為了“知道謎底來猜謎”,很難真正從心、智、情三方面體驗探究。如果把本課定位于酸雨的探究,就可能陷入上述窘境;本課(蘇教版)相對簡單的化學知識,卻能在人類生態災難之一的酸雨問題中發揮重大作用;最近重讀宋心琦教授《什么是化學學科的大問題》一文中“盡管環境問題的產生和作為自然科學之一的化學并無直接的關系,但是由于人們在談及污染問題時,多以污染物的存在和危害性為依據(例如上個世紀70年代發現的與臭氧空洞生成有關的氟里昂和近日由有毒奶粉引出的三聚氰胺事件),自然會聯想到與研究和合成物質密切相關的化學,當人們不能嚴格分清化學學科和包含著化學過程的物質生產過程之間的差別時,把環境污染問題更多地歸因于化學,應當是一種可以理解的誤解。所以,依據一切(化學)物質都是化學的研究對象,因而簡單地把化學物質的存在等同于化學,即由所謂“處處有化學”推衍出來的“因為我們生活在一個物質世界中,化學不可須臾別離,所以化學是最重要的基礎學科”和 “因為所有的污染物都是化學物質,所以化學是環境污染的罪魁禍首”兩種極端而片面的看法的同時存在,就不足為奇了。”這些都給我極大的觸動,產生了“用酸雨中化學知識為素材,讓學生真實體會化學有功于人類”的設計構想。
當確定了上述構想后,另一個問題又冒出來:用酸雨來承載教材(蘇教版)中二氧化硫的性質是合適的,但教材中二氧化硫的性質要比多年以考定教所圈定的內容要少許多,如:SO2易液化,SO2不能使石蕊試液褪色,SO2有氧化性、與H2S反應方程式,氯氣與SO2和H2O或H2SO3反應方程式,溴水與SO2的反應方程式,高錳酸鉀與SO2的反應現象……這些內容要補充嗎?最后,考慮到必修課程的性質、課堂的容量、學生的可接受及本課的上述設計構想,舍棄了;新授課,不能急于求全。
二、設計思路
將SO2性質的學習與酸雨問題的思考進行有機融合,以尋找和設計驗證酸雨問題解決中所用化學知識的方式,讓學生體會化學是如何在其中發揮作用的,感受有功于人類的化學,從理性層面上,形成對化學學科穩定、持久的美好情感;并以此美好情感來促進對SO2性質的學習。具體流程如下:
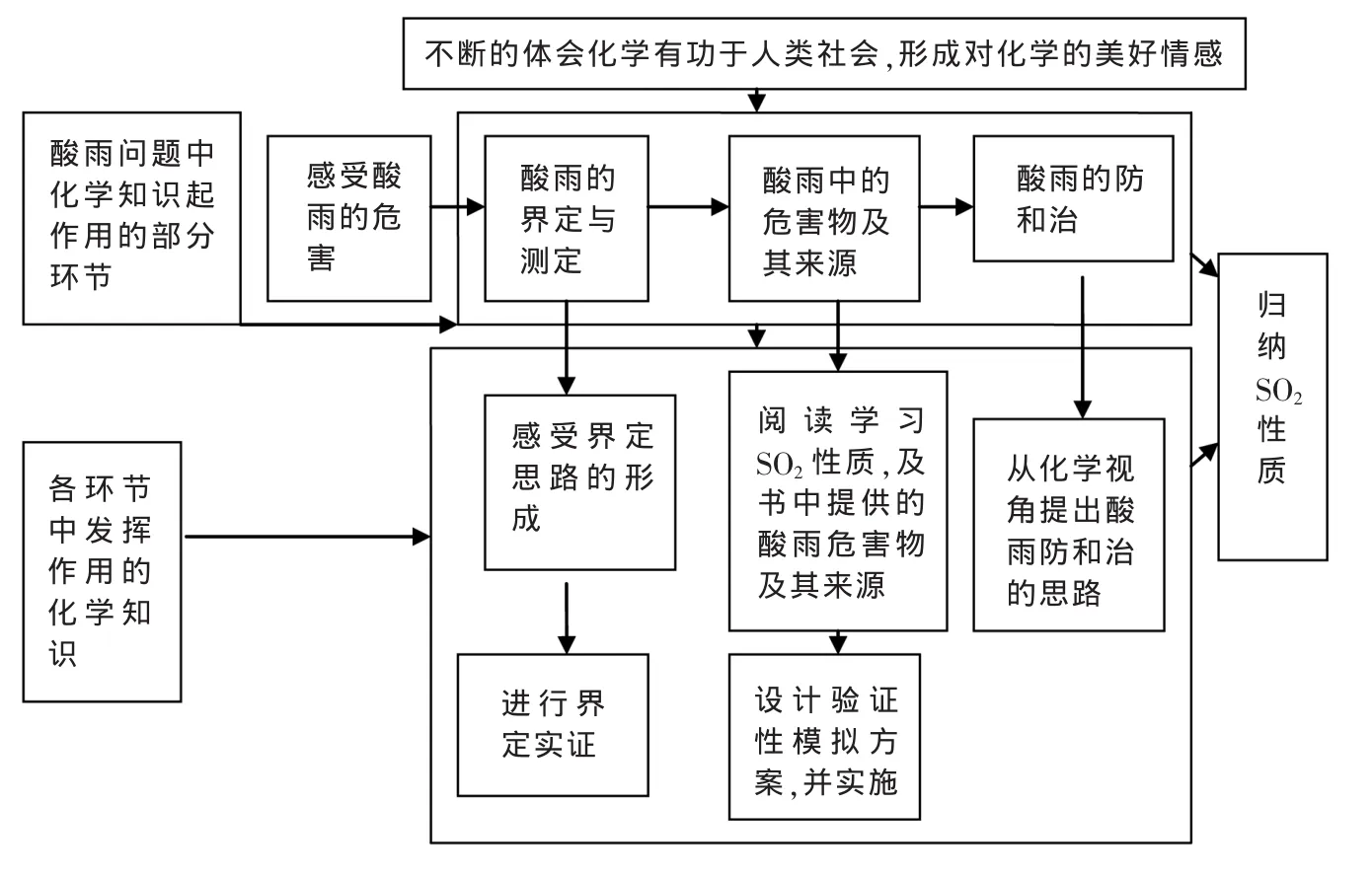
三、教學目標
知識與技能:知道硫酸型酸雨的形成原因、過程;掌握SO2主要性質。
過程與方法:通過閱讀、思考、交流、討論,理解在解決酸雨問題中發揮作用的化學知識,并用實證的方法驗證這些知識的可信度。
情感態度與價值觀:通過“酸雨產生不是化學之過,酸雨解決化學在發揮積極作用”的體驗,讓學生體會化學有功于人類社會,形成對化學的美好情感。
四、教學過程
1.感受酸雨危害之烈
酸雨污染每年給我國造成損失超過1100億元:
據新華社北京2004年10月9日電:中國環境科學研究院、清華大學等單位的研究結果表明,由二氧化硫等導致的酸雨污染每年給我國造成損失超過1100億元,整個大氣污染所造成的損失每年約占我國GDP的2%至3%。 (投影l)
酸雨襲擊南極:
令人震驚的是,南極也觀測到了酸雨,而且是比較強的酸雨。例如,中國南極長城站1998年4月曾先后8次觀測到酸雨,其中最低pH值只有4.45。長城站的鐵質房屋和塔臺被銹蝕得成層剝落,有的不得不進行更新。為了減緩腐蝕,每年要刷2-3次油漆。(投影2)
知識回顧:
初中我們己經知道 “人們通常把pH小于5.6的降雨稱為酸雨”。“我國的能源消耗中,燃煤約占70%,燃煤排放的二氧化硫進入大氣后,形成硫酸型酸雨”;“20世紀90年代末,我國酸雨區面積高達200萬平方千米,是世界三大酸雨區之一。”(投影3)
“酸雨危害很大,它進入湖泊、江河會導致魚類死亡,影響水生生物的生長和繁殖;它進入農田會使土壤酸化,導致礦物營養元素流失,破壞農作物和森林的生長;酸雨還能使橋梁、藝術品、建筑物、機器等腐蝕損壞;酸雨更會危害人體的健康。”(投影4)
設計意圖:讓學生對酸雨的危害有較為深切的感受,為深入思考下面的“在解決酸雨問題的過程中,化學是怎樣發揮積極作用的?”營造心理層面的動機驅動。
2.創設情境,從整體上尋找在解決酸雨問題中化學可發揮作用的環節
師:酸雨是一種環境災難,人類社會是一定要解決酸雨問題的;請大家設想一下:在人類解決酸雨問題的過程中,如果你是化學家,你可以在哪些環節上運用化學知識,參與其中呢?閱讀教材P88-89中有關酸雨的內容,會對你有所啟發。
師板書課題:二氧化硫的性質和作用
生:思考、閱讀、討論、交流、歸納整理如下:
在解決酸雨問題的過程中,化學知識可以在以下環節上發揮作用:
環節1:化學幫助我們界定了酸雨的概念,并提供了判斷酸雨的實驗方法。
環節2:化學幫助我們尋找酸雨中的危害物(具體以我國的硫酸型為例,下同)。
環節3:化學幫助我們尋找酸雨中的危害物的來源
環節4:從化學角度制定了酸雨防和治的思路
師:大家的設想很好!好在這些環節的前后順序體現了問題的研究序:是什么(環節1)→為什么(環節2、3、4)→怎么辦(環節5),好在能充分的運用化學視角來研究問題。
設計意圖:讓學生在具體的情境中,以“解決酸雨問題中的化學家”的身份,從化學視角切入問題,可極大地發揮學生主體作用,在幫助學生歸納后,采用了言之有物的激勵評價,既可激發學生學習熱情,又可幫助學生深化對問題的理解。
3.進入解決酸雨問題中化學可發揮作用的具體環節教學
師:下面我們依次進入上述各環節,具體了解化學知識發揮作用的過程。環節1中,提到化學幫助我們界定了酸雨的概念:人們通常把pH小于5.6的降雨稱為酸雨。這個概念的具體來歷在書上并沒有,不過從化學角度看可由兩條路徑,其一是實驗測量雨水的PH,記錄對應危害情況,找出造成危害的臨界值并以此為界,但這種方法因危害情況難以調查,無法實施;另一方法是先合理推想:地球生態系統,就是在有空氣中CO2溶解雨水參與下形成的,故有空氣中CO2溶解的雨水盡管呈酸性,卻不會造成生態災難,因此它不是酸雨,是正常降雨;可見酸雨之酸性應比正常降雨強;再采用實驗法,測出空氣中CO2溶解水形成飽和液的pH并以此為界。顯然后一思路是可行的,因此,請大家設計實驗測出這個pH。
生:收集潔凈空氣通入蒸餾水中到飽和,測飽和液pH。
師:如何收集潔凈空氣?如何讓它順利通入水中?怎么知道飽和?幾個組測出的數據不同怎么辦?有沒有更簡便的方法?
生思考、交流、討論,師參與、點撥,最后師生共同選定兩法:①用大注射器吸入少量蒸餾水后,針尖朝下吸氣,針尖朝上排氣,反復二十次后,開始用pH試紙測量pH,以后每十次吸、排氣測1次,直到pH幾乎相同為止;②將養金魚的小壓縮機出氣管,插入盛放在小燒杯中的蒸餾水(20mL)中(注意氣管洗凈和固定,防止通氣后氣管滑出),接通電源、打開開關通氣,通氣2分鐘開始測量pH,以后每30秒測1次,直到pH幾乎相同為止。幾個組測出的數據不同,可以像“中央臺青歌賽”上一樣,去掉最高、最低值后,算均值。
生實施實驗:由于儀器準備不足的原因,選擇了前一種方案進行實驗。
師:酸雨概念的界定由化學完成了,那么對真實的降雨來說,判定它是否為酸雨,用什么化學方法來做?
生齊答:用pH試紙測pH值。
設計意圖:讓學生在探究酸雨界定的“思路形成→實驗原理→實驗方案”過程中,體驗探究的科學本質是依據(界定思路的合理、可行)和證據(最好有實驗支撐),感受實驗原理與實驗方案巨大差異,讓學生注意實驗方案可行和簡約;通過環節一,驗證了初中的知識,清楚了這個界定的由來,也體會了化學在酸雨是什么的問題解決立了第一功。
師:對于環節二和環節三的結論,大家可以從書上的圖讀出,請大家全面有條理的將結論表達出來。
生思考、交流、討論、展示:酸雨中的危害物是H2SO4,來源是化石燃料燃燒、含硫金屬礦物的冶煉、硫酸的生產中產生的釋放到空氣中的SO2,從來源物SO2到危害物H2SO4的變化過程,有兩個并行的途徑①SO2+H2O=H2SO3、2H2SO3+O2=2H2SO4②2SO2+O2=2SO3、SO3+H2O=H2SO4
師:容易體會到,上述化學知識成功地解釋了硫酸型酸雨中的危害物及其產生過程;如果我們能模擬出這個過程,那上述解釋就更為可信了。請大家嘗試設計實驗驗證。
生思考、交流、討論,師參與、點撥,最后師生共同擬定下列驗證點:
①證實老師提供的氣體確為SO2。
②用雙氧水代替氧氣,來模擬SO2被氧化為H2SO4的過程,特別注意檢出是否有SO42-生成。
師:請大家閱讀書P88-89二氧化硫相關內容后,就上述內容設計實驗方案。
生思考、交流、討論,師參與、點撥,最后師生共同認定書上P88頁的觀察與思考中的實驗1、2、3,只要對其稍加改動,就是很好的方案;改動后的敘述如下:
實驗1:用針筒抽取老師提供的氣體85 mL后,再吸入15mL蒸餾水,用橡皮塞堵住針筒前端,振蕩(這比直接向集氣瓶中加水振蕩要環保,但老師提供的氣體瓶子最好是質地較軟的塑料瓶,以方便抽氣),然后將5mL水溶液加入小燒杯,用pH試紙測其pH值,記錄,待下課后再測其pH(目的是通過pH變化,反映H+濃度變化,進而分析其中是否有弱酸H2SO3向強酸H2SO4的轉化,這個比下面“用雙氧水代替氧氣,來模擬SO2被氧化為H2SO4的過程”更真實,但因耗時過多而被淡化處理)。
實驗2:向試管中加入5mL水溶液,滴加品紅溶液,振蕩,然后套上小氣球加熱試管,觀察加熱前后溶液顏色的變化 (目的是用SO2的漂白性鑒定老師提供的氣體是否為 SO2)。
實驗3:向另一試管加入最后5mL水溶液,滴加氯化鋇溶液,再滴加0.5mL3%的過氧化氫溶液,振蕩,觀察過氧化氫加入前后的現象(目的是通過過氧化氫加入前無沉淀、后有沉淀,說明在過氧化氫的氧化下確實有硫酸生成,增加了酸雨生成解釋的可信度)。
設計意圖:能自學的內容讓學生自學,但要重視自學結果的評價(沒用再現,而用了展示和應用于酸雨問題的方法),這樣才能做到學生主體作用發揮的有效、高效。對知識進行實證,是一種學習方法,也是批判、質疑、不盲從的科學態度,因此,輕視對知識進行驗證,貶低驗證性實驗的價值是沒有什么道理的。
師:對于酸雨防和治,既需要包括化學在類的各種自然科學的理論和技術支撐,又需要人的環保意識的提高,還需要國家的立法、執法,最后還要國際合作。不過化學既然可以出力,那么請大家從化學的視角出發,提出自己的想法,也是應該的,大家討論吧!
生思考、交流、討論,師參與、點撥,最后師生共同擬定了下列防和治的思路:
(1)基于元素守恒,如果在燃料中沒有硫元素,就不會產生硫酸型酸雨,因此可以①開發新能源,不用含硫燃料②對含硫燃料進行脫硫處理。
(2)阻斷SO2進入大氣,使生成硫酸的反應因反應物缺失,無法進行①固硫——將SO2變為硫酸鹽②分離出SO2加以綜合利用,如制硫酸。
(3)化學方法中和酸雨帶來的酸性。
4.歸納解決酸雨問題中發揮作用的化學知識
師:酸雨并不是化學、化學家造成的,但日常生活中卻常常把環境污染歸罪于化學,通過以上分析,我們又知道了酸雨問題的解決是需要化學發揮作用的,也就是環境問題的解決還要依靠化學,這樣看來:把環境污染歸罪于化學是一種誤解,化學對于人類社會有功,化學將還會在包括環境保護在內的各個方面發揮其巨大作用。下面請大家把在酸雨問題解決中發揮作用的化學知識歸納一下。
生思考、交流、討論、展示:
①SO2無色、有刺激性氣味的氣體,有毒。
②SO2易溶于水,與水的反應為:SO2+H2O=H2SO3水溶液呈酸性,SO2是酸性氧化物。
③SO2能漂白某些有色物質(如能漂白品紅溶液,不能漂白pH試紙),漂白是因為生成物無色,加熱后恢復原色則說明生成物不穩定;這與HClO、H2O2以及活性炭的漂白原理有本質的不同。
④SO2能與 O2反應:2SO2+O2=2SO3, 體現了 SO2的還原性。
⑤H2SO3能與O2、H2O2反應,體現了H2SO3的還原性,其中與O2的反應為2H2SO3+O2=2H2SO4。
設計意圖:讓學生在回味有功于人類的化學的同時,對化學知識進行梳理,有美好感情支配下的知識梳理,應該高效。

