尖晶石型鋰離子篩的制備及其吸附性能
(中南大學 冶金科學與工程學院,湖南 長沙,410083)
鋰是國民經濟和國防建設中重要的戰略資源[1]。鋰在新型高能電池、航空航天技術、超輕高強度的鋰鋁合金和核聚變發電等領域有廣泛的應用[2?3]。自然界的鋰資源主要賦存于海水、鹽湖鹵水、地熱水和花崗偉晶巖型礦床中,其中礦石中鋰的儲量不足總儲量的3%。從長遠意義看,陸上鋰資源將不能滿足日益增長的需求,因此,迫切需要開發鹽湖鹵水、海水和地熱水等稀鋰液態資源[4]。從稀鋰溶液中提取鋰以離子交換與吸附法最為綠色經濟已成共識[5],該技術的關鍵就是制得吸附性能良好的鋰離子篩(又稱鋰吸附劑)。國內外在鋰離子篩的制備方面已經取得了一定的成績,報道已合成的經處理后有吸附能力的氧化物有LiMn2O4,Li1.6Mn1.6O4[6],Li1.33Mn1.67O4[7],LiMnO[8]和 LiMnO2[9]等,這些錳氧化物在一定濃度的酸(如鹽酸、硫酸、硝酸等)下洗滌,洗去鋰離子,便可得到錳系離子篩,此離子篩對溶液中的鋰離子有特殊記憶功能,尤其對從海水中提取鋰離子具有選擇性高、吸附量大的優點,但在吸附理論研究方面還不完善。為此,本文作者用0.5 mol/L HCl對事先用液相法合成的鋰離子篩前驅體 LiMn2O4進行酸洗脫鋰制得鋰吸附劑λ-MnO2,再將離子篩在不同pH和不同Li+濃度溶液中進行吸附,得到離子篩吸附時的動力學和吸附等溫線,同時運用XRD和SEM進行相應表征。離子篩λ-MnO2在含鋰溶液中對Li+重新吸附,干燥得到吸附Li+后的固體離子篩材料(記為(Li)Mn2O4)。
1 實驗部分
1.1 鋰離子篩的制備
將一定量制備好的尖晶石型鋰離子篩前驅體LiMn2O4加入事先盛有過量(H+相對Li+過量)0.5 mol/L HCl溶液的燒瓶中,于室溫(25 ℃)浸漬進行酸浸洗脫,至前驅體中鋰基本洗脫完全。酸洗充分后用純水沖洗3遍,干燥得到鋰離子篩,以λ-MnO2表示。
1.2 離子篩吸附性能的研究
將0.2 g離子篩置于50 mL不同pH含有過量Li+的溶液中(LiCl,LiOH和HCl調整pH,溶液中含鋰質量濃度約為 250 mg/L,與鹽湖鹵水中鋰質量濃度接近,此時測得所配制LiOH溶液pH為12.95),于25 ℃靜態吸附至吸附平衡。取上清液測溶液中鋰錳含量,按下式計算鋰離子篩對鋰離子的吸附容量,研究溶液pH與吸附容量的關系和離子篩的吸附動力學。
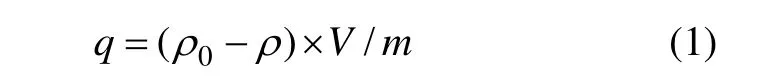
式中:q為每克鋰吸附劑吸附 Li+的含量,mg/g;ρ0為Li+起始質量濃度,mg/L;ρ為不同時間的Li+質量濃度,mg/L;V為溶液的體積,L;m為吸附劑的質量,g。
另外,本實驗還考察了鋰離子濃度對吸附容量的影響。以NaOH調節溶液的pH為12.95,在此pH下配制不同濃度的含鋰溶液,研究離子篩吸附容量與Li+濃度的關系及其吸附等溫線。
1.3 產物的分析與表征
采用X線衍射儀(Rigaku Dmax 2550型,日本)對離子篩前驅體和離子篩吸附前后的樣品進行X線衍射分析,工作參數如下:Cu Kα靶(λ=0.154 056 nm),掃描電壓為40 kV,電流為100 mA,步寬為0.02°,掃描速度為 2 (°)/min,掃描范圍為10°~85°。用掃描電子顯微鏡(JSM?6360lv型,日本)觀察前驅體和離子篩的微觀形貌。采用原子吸收法(TAS?990 F型,北京普析通用儀器有限責任公司制造)測定溶液中鋰離子和錳離子的含量。
2 實驗結果與討論
2.1 鋰離子篩的制備
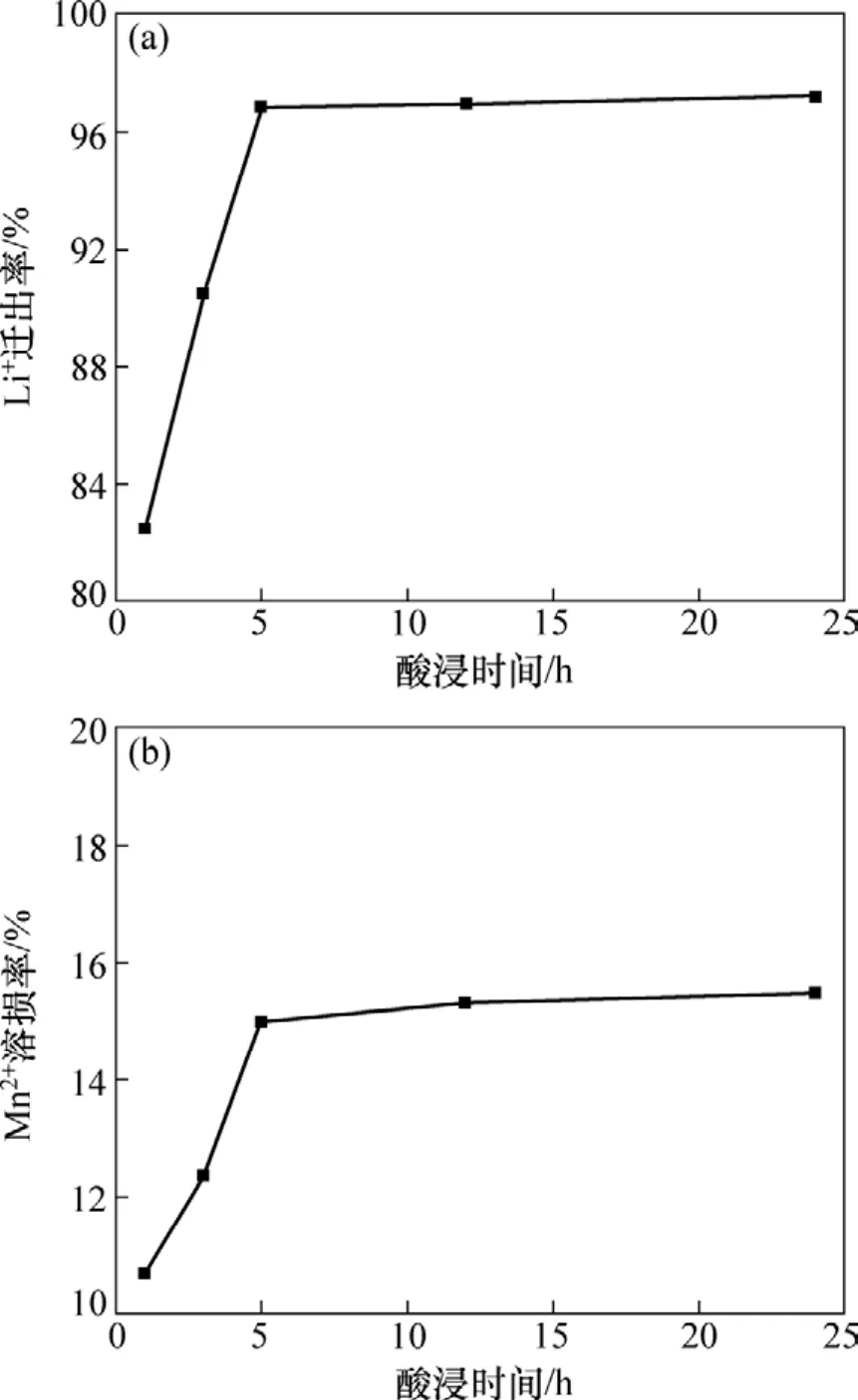
圖1 離子篩前驅體洗脫效果與酸洗時間的關系Fig.1 Curves of elution effect with elution time
圖 1所示為用 0.5 mol/L鹽酸對離子篩前驅體LiMn2O4進行酸洗脫鋰,鋰的遷出率和錳的溶損率隨時間變化的情況。由圖1(a)可知:前5 h溶液中鋰離子濃度幾乎呈直線上升,隨后趨于平緩;而圖1(b)中錳的溶損也在5 h后基本達到平衡。這表明酸洗脫鋰過程很快,5 h就能基本完成。由圖1可知:酸洗時間越長,洗脫時鋰的遷出率則越高,但同時吸附劑中錳的溶損率也越大,5 h酸洗LiMn2O4中鋰的遷出率為97%,而錳的溶損率也達到15%。
對離子篩前驅體的酸浸過程,現主要有2種不同的反應機理進行解釋:一種是離子交換機理,即認為LiMn2O4在酸浸過程中發生如下離子交換反應[10]:
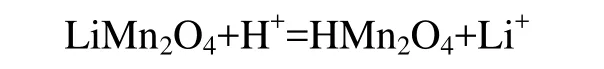
另一種為氧化還原機理,即Mn3+發生歧化反應[11]:
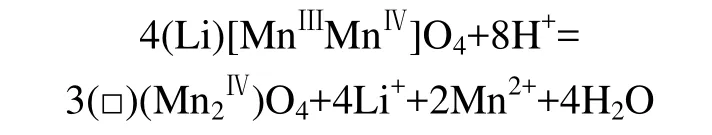
其中:(□)表示晶格內的空隙,Mn的平均化合價為+3.5。由于Mn3+發生歧化反應,生成Mn4+和Mn2+,Mn4+留在尖晶石骨架中形成λ-MnO2,而Mn2+溶解于溶液中,使Mn的有效離子半徑減小。這也在一定程度上解釋 LiMn2O4在 Li+遷出后其尖晶石結構不變,而只是晶胞常數略減小的原因。
2.2 吸附性能的研究
2.2.1 吸附容量與溶液pH的關系
由實驗得到鋰吸附飽和容量隨 pH的變化關系如圖2所示。由圖2可以看出:在酸性溶液中λ-MnO2對Li+離子的吸附極其微弱,甚至在pH<3時,離子篩沒有對Li+沒有吸附,反而因pH低使離子篩中殘留的鋰有少量遷出,在中性溶液中,λ-MnO2對Li+的吸附仍然很少,當溶液pH=7.13時,吸附容量只有 0.9 mg/g。隨著溶液堿性的增加,λ-MnO2對 Li+的吸附能力逐漸增強;當pH<11時,吸附容量隨pH的增大呈緩慢增加趨勢,當pH>11時,吸附容量發生了突變,由2.2 mg/g增加到pH為12.95時的23.75 mg/g,但這與λ-MnO2的理論吸附容量38.4 mg/g仍有一定差距。
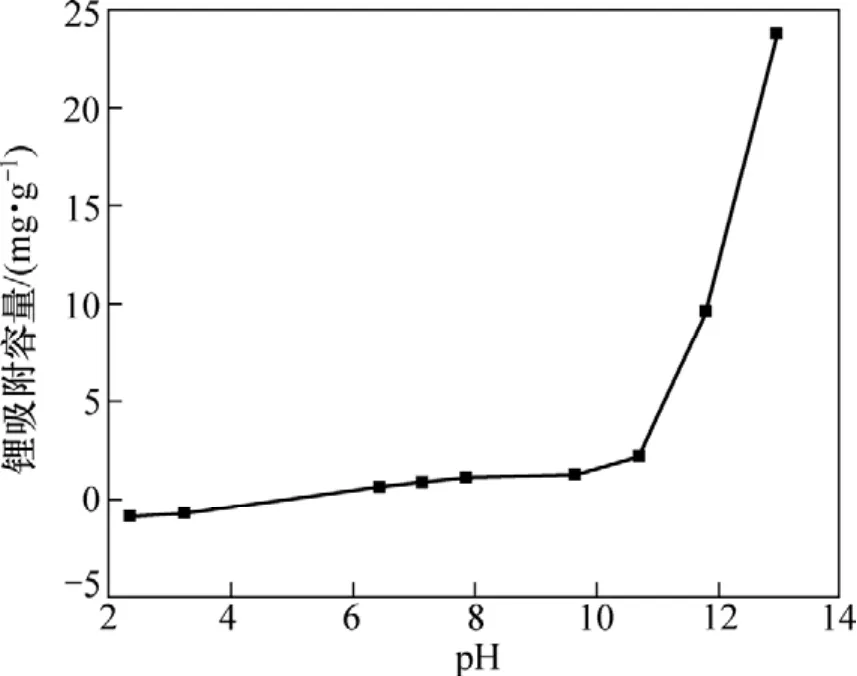
圖2 離子篩吸附容量與溶液pH的關系Fig.2 Relationship between adsorptive capacity and pH
鐘輝等[12]認為在離子篩的吸附中心具有酸式解離能力的OH基團,可與Li+按等量交換反應進行,即:
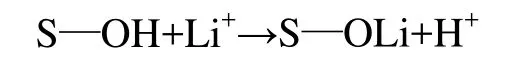
離子篩的官能基團具有三元酸的性質,最后一類OH基團只有在pH>11.5時才能參加離子交換反應。基于這種機理,在鋰溶液酸性較大時,不利于離子篩的解離,因而,此時離子篩的交換容量較低,即鋰的吸附容量較低;隨著溶液 pH的增大,離子篩的解離度增大,因而,其對鋰的吸附能力增大。
由于離子篩λ-MnO2對Li+的吸附是釋放H+、消耗OH?的過程,隨著溶液 pH的增大,反應向正方向進行,因此,離子篩對 Li+的吸附容量隨 pH的增加而增大。
2.2.2 吸附容量與吸附時間的關系及其吸附動力學
將一定量的離子篩置于pH為12.95的LiOH溶液中,并于25 ℃水浴加熱,間隔一定時間取上清液分析離子篩對鋰的吸附容量,得到如圖3所示的曲線。由圖3可知:離子篩的吸附交換速率較快,在較短時間內就能達到平衡,吸附1 h鋰的吸附容量為17.8 mg/g,到 24 h基本達到平衡,48 h鋰的吸附容量為 23.75 mg/g。
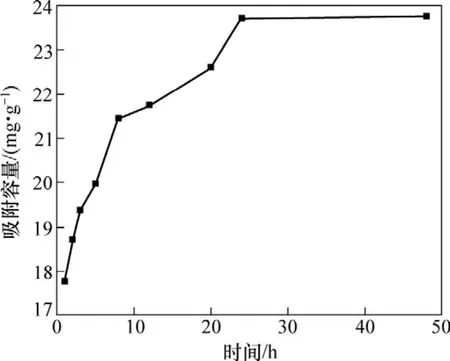
圖3 離子篩吸附容量與吸附時間的關系Fig.3 Relationship between adsorptive capacity and time of adsorption

吸附劑對金屬離子的吸附動力學研究已有不少報道,目前偽一級動力學模型(式(2))和偽二級動力學模型(式(3))被廣泛應用來研究吸附機理[13?14],確定吸附過程的速率常數。式中:qe和qt分別為在吸附平衡和吸附時間為t時吸附劑對 Li+的吸附容量,mg/g;k1和k2分別為偽一級動力學模型和偽二級動力學模型吸附速率常數,單位分別為 h?1和 g·mg?1·h?1。
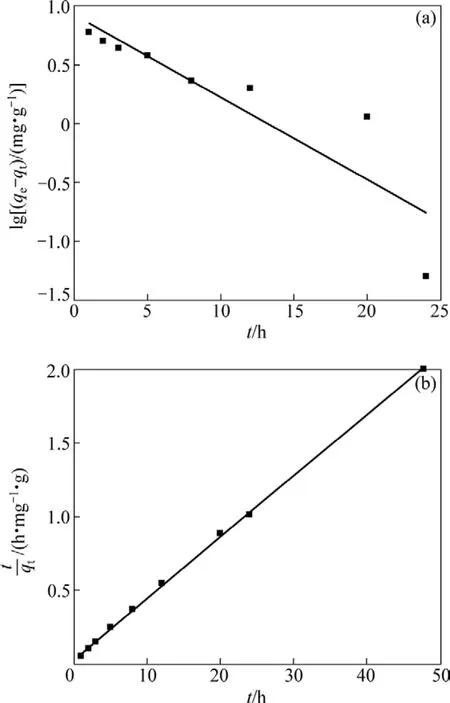
圖4 LiOH溶液中鋰吸附的偽一級動力學和偽二級動力學曲線Fig.4 Pseudo-first-order and pseudo-second-order kinetic plots for Li+ adsorption in LiOH solution

表1 LiOH溶液中鋰吸附的動力學參數Table 1 Kinetic parameters for Li+ adsorption in LiOHsolution
用偽一級動力學方程和偽二級動力學方程對圖 3中曲線進行線性擬合,結果如圖4和表1所示。由圖4和表1可以看出:用偽二級動力學方程擬合的線性相關系數比偽一級動力學方程擬合的大,達到0.999 4。所以認為吸附劑在LiOH溶液中的吸附動力學符合偽二級動力學模型,根據偽二級動力學方程,求出反應的速率常數為 0.050 9 g·mg?1·h?1,平衡吸附容量分別為24.39 mg/g,此吸附容量與圖3中實驗得到的平衡吸附容量23.75 mg/g相近。這進一步說明吸附劑在LiOH溶液中的吸附符合偽二級動力學模型,表明吸附過程主要為化學吸附,吸附劑對鋰離子的吸附為單分子層吸附[15]。
2.2.3 吸附容量與Li+濃度的關系及其吸附等溫線
以NaOH調節溶液的pH為12.95,在此pH下配制不同濃度的含鋰溶液,得到離子篩吸附容量與 Li+濃度的關系如圖5所示。由圖5可知:Li+濃度對離子篩吸附容量有一定的影響。當Li+濃度為0.02 mol/L時離子篩的吸附容量為 21.8 mg/g;而當 Li+濃度為 0.1 mol/L時,離子篩的吸附容量為24.16 mg/g。
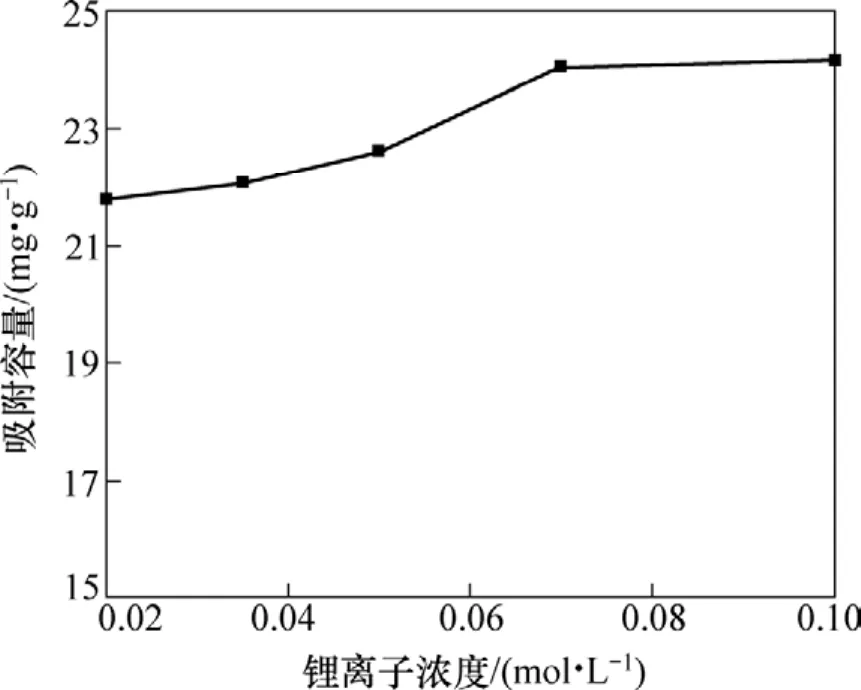
圖5 吸附容量與Li+濃度的關系Fig.5 Relationship between adsorptive capacity and Li+ concentration
鋰吸附劑對Li+的吸附可以通過Langmuir吸附等溫方程(式(4))和 Freundlich吸附等溫方程(式(5))擬合[16]。

式中:ρe為吸附平衡后溶液中Li+的質量濃度,mg/L;qe為平衡吸附容量,mg/g;qm為最大吸附容量,mg/g;KL為Langmuir實驗常數,L/mg;n和KF為與吸附容量和吸附速率有關的Freundlich常數。
分別用Langmuir吸附等溫方程和Freundlich吸附等溫方程對離子篩在不同濃度的含鋰溶液中平衡時的濃度和吸附容量進行擬合,結果如圖6和表2所示。從圖6和表2可以看出:用Langmuir吸附等溫方程進行擬合的線性關系比Freundlich擬合的好,線性相關系數達到0.990 4,表明Li+的吸附符合Langmuir吸附等溫方程,最大吸附容量為24.29 mg/g,與圖5中在Li+濃度為0.1 mol/L時離子篩的吸附容量24.16 mg/g相近。
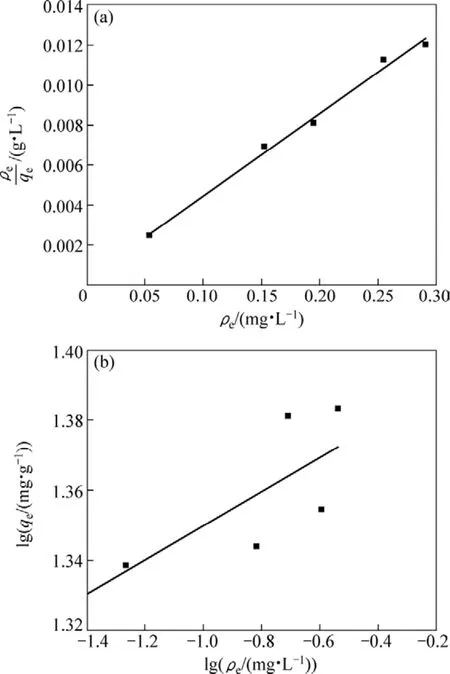
圖6 Langmuir和Freundlich等溫線Fig.6 Langmuir and Freundlich isotherms curves
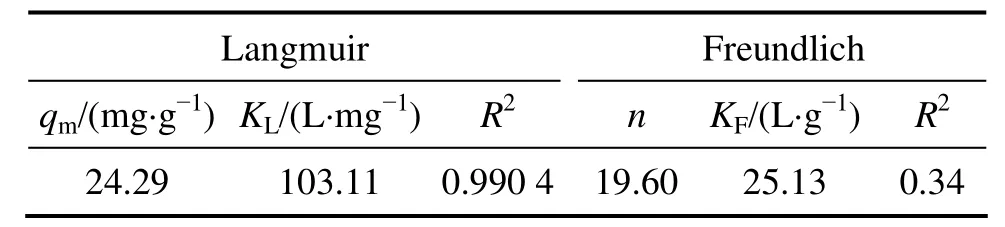
表2 鋰吸附劑的等溫吸附模型及參數Table 2 Type and parameters of isothermal adsorption of Li-adsorbent
2.3 離子篩吸附Li+前后的結構和形貌
鋰離子篩前驅體經過酸洗所得酸洗后物理論上就是鋰離子篩(又稱鋰吸附劑)。這種鋰離子篩在某種理論上可認為是鋰離子被氫離子完全替代后的尖晶石結構錳氧化物,可簡寫為λ-MnO2。而根據離子交換機理,吸附Li+后的離子篩理論上又替代H+的位置,轉化為LiMn2O4。對此選取前驅體及其離子篩吸附前后的樣品,用X線衍射對其進行結構分析,確定其與標準的λ-MnO2晶體結構是否存在差別,最后用掃描電鏡分析其外部形貌和結晶情況相對于其前驅體是否發生了變化。離子篩前驅體及其離子篩吸附前后的 XRD圖譜和SEM照片分別如圖7和圖8所示。
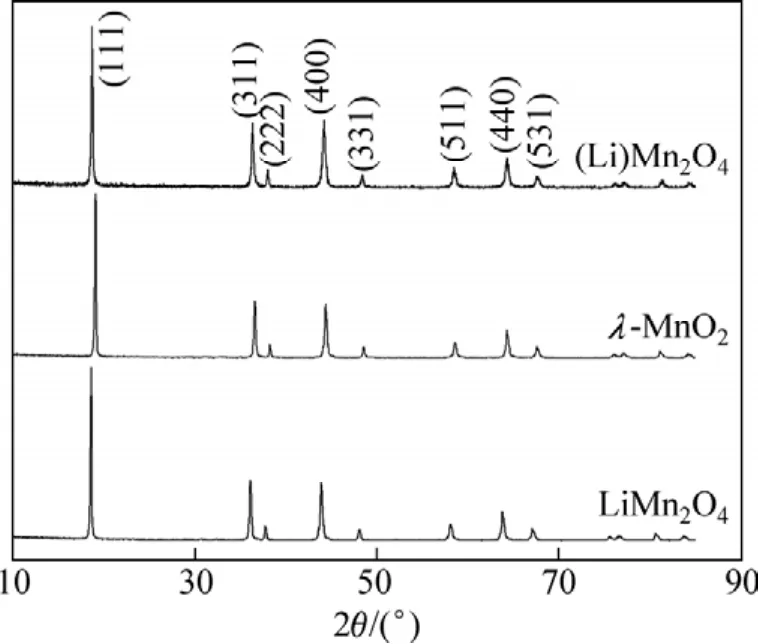
圖 7 LiMn2O4,λ-MnO2和(Li)Mn2O4的XRD圖譜Fig.7 XRD patterns of LiMn2O4, λ-MnO2 and (Li)Mn2O4

圖8 LiMn2O4,λ-MnO2和(Li)Mn2O4的SEM照片Fig.8 SEM images of LiMn2O4, λ-MnO2 and (Li)Mn2O4
由圖7可知:酸浸洗脫后得到產物結構與酸浸前LiMn2O4的相似,仍保持尖晶石結構,各特征衍射峰所對應的角 2θ對應于前驅體 LiMn2O4向高角度方向移動。這說明鹽酸對LiMn2O4的酸浸過程中,隨著Li+的遷出,H+的遷入,使晶胞發生了收縮,晶胞常數a有所減小,形成了細微的空腔。這是H+半徑小于Li+半徑所致。這是離子篩具有篩效應而能夠吸附鋰離子的微觀原因。對照標準XRD圖譜,離子篩吸附鋰后,其圖譜與離子篩的圖譜比較,各特征峰數目未變,其峰高和峰間距也沒發生明顯的改變,這說明離子篩在吸附鋰后其產物的尖晶石晶體骨架結構未發生變化,只是各特征峰的位置對應于離子篩有向低角度移動。可見:在離子篩吸附鋰的過程中,隨著交換反應的進行,原先H+的位置又被Li+取代;離子篩吸附過程中,由鋰離子替代氫離子后其晶胞又擴大,從而與前驅體的晶體結構基本一致。這在一定程度上也說明鋰離子篩的吸附交換是成功的。
由圖8可以看出:產物是粒徑在0.5~2 μm范圍內的粉末材料,顆粒之間較為松散,這是由于焙燒過程中放出CO2和O2,使顆粒內部產生較多的孔隙,從而形成聯通的網絡結構,這有利于離子在結構中的遷出和嵌入。離子篩前驅體顆粒不夠均勻,但粒子團聚嚴重。離子篩吸附后的顆粒則比較均勻,晶粒發育更為成熟,顆粒粒度較吸附前要小,但仍有部分團聚。
4 結論
(1) 鋰離子的遷出和錳的溶損與洗脫的時間有關。洗脫時間越長,鋰的遷出率則越高,但同時錳的溶損率也高。
(2) 離子篩對Li+的吸附容量隨著pH升高而增大,pH為12.95的LiOH溶液中離子篩的吸附容量為23.75 mg/g。
(3) 吸附過程符合偽二級動力學方程和 Langmuir等溫吸附方程。吸附過程主要為化學吸附,對鋰離子的吸附為單分子層吸附。
(4) 鋰離子篩吸附交換前后晶體結構只發生了細微變化,但都是尖晶石結構,離子篩吸附鋰后與前驅體的晶體結構基本一致。
[1] Hamzaoui A.H, M′nif A, Hammi H, et al. Contribution to the lithium recovery from brine[J]. Desalination, 2003, 158(1/3):221?224.
[2] Panero S, Ciuffa F, D'Epifano A, et al. New concepts for the development of lithium and proton conducting membranes[J].Electrochimica Acta, 2003, 48(14/16): 2009?2014.
[3] Jannik J, Maier J. Nanocrystallinity effects in lithium battery materials. Aspects of nano-ionics. Part IV[J]. Physical Chemistry Chemical Physics, 2003, 5(2/3): 5215?5220.
[4] 董殿權, 張鳳寶, 張國亮, 等. LiMg0.5Mn1.5O4的合成及對 Li+的離子交換選擇性[J]. 無機化學學報, 2004, 20(9): 1126?1130.DONG Dian-quan, ZHANG Feng-bao, ZHANG Guo-liang, et al.LiMg0.5Mn1.5O4synthesis and its selectivity to Li+exchange[J].Chinese Journal of Inorganic Chemistry, 2004, 20(9):1126?1130.
[5] Koyanaka H, Matsubaya O, Koyanaka Y, et al. Quantitative correlation between Li adsorption and H content in manganese oxide spinelλ-MnO2[J]. Journal of Electroanalytical Chemistry,2003, 559(15): 77?81.
[6] Chitrakar R, Kanoh H, Miyai Y, et al. A new type of manganese oxide (MnO2·0.5H2O) derived from Li1.6Mn1.6O4and its lithium ion-sieve properties[J]. Chemistry of Materials, 2000, 12(10):3152?3157.
[7] ZHANG Yong-cai, WANG Hao, WANG Bo, et al. Low temperature synthesis of nanocrystalline Li4Mn5O12by a hydrothermal method materials[J]. Research Bulletin, 2002,37(8): 1411?1417.
[8] LIU Zhan-qiang, WANG Wen-lou, LIU Xian-ming, et al.Synthesis of nanostructured spinel LiMnO by hydrothermal method at 70 ℃ [J]. Inorganic Chemistry Communications, 2004,7(2): 308?310.
[9] Myung S T, Komaba S, Kumagai N. Hydrothermal synthesis and electrochemical behavior of orthorhombic LiMnO2[J].Electrochimica Acta, 2002, 47(20): 3287?3295.
[10] Clearfield A. Inorganic ion exchangers, past, present and future[J]. Solvent Extraction and Ion Exchange, 2000, 18(4):655?678.
[11] Huter J C. Preparation of a new crystal form of manganese dioxideλ-MnO2[J]. Journal of Solid State Chemistry, 1981, 39(2):142?147.
[12] 鐘輝, 殷輝安. 偏鈦酸型離子交換劑表面性質與選擇吸附性研究[J]. 離子交換與吸附, 2003, 19(1): 55?60.ZHONG Hui, YIN Hui-an. Study on the properties of the surface and absorb of Li+ion-exchange of H2TiO3type[J]. Ion Exchange and Adsorption, 2003, 19(1): 55?60.
[13] Barkat M, Nibou D, Chegrouche S, et al. Kinetics and thermodynamics studies of chromium(VI) ions adsorption onto activated carbon from aqueous solutions[J]. Chemical Engineering and Processing, 2009, 48(1): 38?47.
[14] Benhammou A, Yaacoubi A, Nibou L, et al. Adsorption of metal ions onto Moroccan stevensite: Kinetic and isotherm studies[J].Colloid and Interface Science, 2005, 282(2): 320?326.
[15] Naiya T K, Bhattacharya A K, Das S K. Removal of Cd (II) from aqueous solutions using clarif i ed sludge[J]. Colloid and Interface Science, 2008, 325(1): 48?56.
[16] WANG Lu, MENG Chang-gong, HAN Mei, et al. Lithium uptake in fixed-pH solution by ion sieves[J]. Colloid and Interface Science, 2008, 325(1): 31?40.

