載脂蛋白E對蛛網膜下腔出血后小鼠皮質神經細胞凋亡的影響
田艷霞,徐愛軍,劉 樺,盧鶴翔,李 冉,高俊玲
(河北聯合大學基礎醫學院,河北唐山063000)
載脂蛋白E(Apolipoprotein,apoE)在中樞神經系統不但在脂質代謝中起到重要作用,而且,在抗炎、抗興奮毒性等方面也有作用[1-3],臨床資料顯示,蛛網膜下腔出血(subarachnoid hemorrhage,SAH)病人的腦積液中apoE水平降低表明apoE可能與SAH的發病及其愈后有關。apoE全蛋白分子量大,不能通過血腦屏障,影響了外源性的治療性應用。近來研究合成了來自apoE受體結合區的擬apoE 12肽,分子量為1410D。擬apoE對實驗性SAH有治療作用[4],但其作用機制尚有待探討。本試驗選用外源性的擬apoE1410肽段作為SAH后的干預因素,觀察在SAH后apoE對額葉皮質神經細胞凋亡的影響及其可能的作用機制,以期為臨床治療SAH提供新的實驗依據。
1 材料與方法
1.1 實驗動物 健康雄性ICR小鼠210只,體重30-35 g,北京維通利華公司提供。小鼠隨機分成:①對照組;②SAH組;③apoE治療組。每組又分別劃分為傷后10 min、30min 、1h 、3h 、24h 、48h 、72h 7個時相組。
1.2 主要儀器和試劑 Cty-c兔抗鼠多克隆抗體(武漢博士德公司);Caspase-3兔抗鼠多克隆抗體(武漢博士德公司);山羊SABC法檢測試劑盒(武漢博士德公司);DAB顯色試劑盒(武漢博士德公司);TUNEL試劑盒(Roche公司);擬apoE1410(美國北卡州立大學)。
1.3 方法
1.3.1 動物給藥方法 apoE治療組以0.6 mg/kg,術前30分鐘開始第一次,每12小時一次,共用三天,其它兩組只注射生理鹽水。
1.3.2 小鼠SAH模型的建立 按照Bederson[5]等方法加以修改,采用非開顱血管內穿刺法制備小鼠SAH模型,自右側頸外動脈插入經酒精處理的玻璃纖維至大腦中與大腦前交叉處的Villis環前部,刺破血管造成SAH。
1.3.3 免疫組織化學 按試劑盒說明進行,一抗(稀釋度為1∶100)4℃下孵育24 h,用相同稀釋比的PBS替代一抗作陰性對照,DAB溶液顯色。鏡下觀察陽性細胞胞漿呈棕黃色。陽性細胞免疫反應性強弱用Motic Med 6.0數碼醫學圖像分析系統分析其平均光密度值(OD)的大小來表示。
1.3.4 原位細胞DNA斷裂檢測(TUNEL法) 標本制備步驟同免疫組化。TUNEL標記反應混合液(陰性對照只加等量核苷酸反應液不含酶,其余均相同)37℃孵育1 h,POD-轉化液37℃孵育30 min,DAB顯色劑避光顯色。鏡下觀察,核呈藍色的為陽性細胞。TUNEL陽性細胞數取其目鏡網格測微尺200倍光鏡視野下隨機計數10個小鼠皮質陽性細胞數(個/高倍視野)作為分析對象進行比較。
2 結果
2.1 Ctyc及Caspase-3的蛋白表達 Ctyc免疫陽性反應呈棕黃色沉淀,定位于胞漿。對照組小鼠大腦額葉皮質偶見Cytc免疫陽性細胞。與對照組相比出血組Ctyc于SAH1小時略有表達、3小時明顯升高,24小時大量表達,48 h后逐漸下降,與出血組比較apoE治療組免疫陽性反應在各時相點均降低,以24 h、48 h、72 h差異顯著(P<0.05)。見表1。
Caspase-3陽性細胞胞漿著棕黃色。對照組小鼠大腦額葉皮質Caspase-3免疫反應偶見表達。與對照組相比,SAH組3小時偶見Caspase-3免疫陽性反應;24 h明顯升高,48 h大量表達,72小時逐漸下降。與出血組比較,apoE治療組免疫陽性反應在各時相點均降低,以 24 h、48 h、72 h差異顯著(P<0.05)。見表2。
表1 各組 Cytc免疫活性比較(±s,n=5)
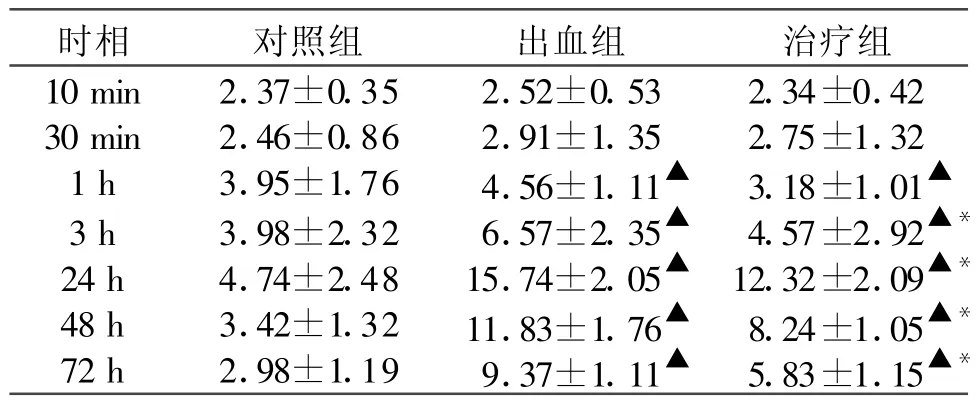
表1 各組 Cytc免疫活性比較(±s,n=5)
注:與對照組相比 ▲P<0.05,與出血組相比 *P<0.05
時相 對照組 出血組 治療組10 min 2.37±0.35 2.52±0.53 2.34±0.42 30 min 2.46±0.86 2.91±1.35 2.75±1.32 1 h 3.95±1.76 4.56±1.11▲ 3.18±1.01▲3 h 3.98±2.32 6.57±2.35▲ 4.57±2.92▲*24 h 4.74±2.48 15.74±2.05▲ 12.32±2.09▲*48 h 3.42±1.32 11.83±1.76▲ 8.24±1.05▲*72 h 2.98±1.19 9.37±1.11▲ 5.83±1.15▲*
表2 各組 Caspase-3免疫活性比較(±s,n=5)
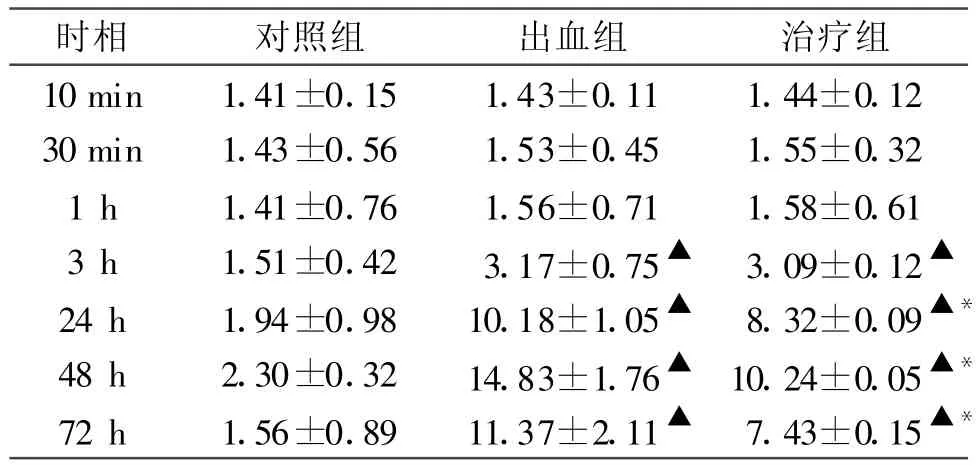
表2 各組 Caspase-3免疫活性比較(±s,n=5)
注:與對照組相比▲P<0.05,與出血組相比 *P<0.05
時相 對照組 出血組 治療組10 min 1.41±0.15 1.43±0.11 1.44±0.12 30 min 1.43±0.56 1.53±0.45 1.55±0.32 1 h 1.41±0.76 1.56±0.71 1.58±0.61 3 h 1.51±0.42 3.17±0.75▲ 3.09±0.12▲24 h 1.94±0.98 10.18±1.05▲ 8.32±0.09▲*48 h 2.30±0.32 14.83±1.76▲ 10.24±0.05▲*72 h 1.56±0.89 11.37±2.11▲ 7.43±0.15▲*
2.2 原位細胞凋亡檢測結果 對照組小鼠大腦額葉皮質TUNEL陽性細胞偶見。SAH組細胞凋亡數明顯增多,72 h達高峰。與對照組相比,SAH組的細胞凋亡數顯著增多;apoE治療組在各時相點凋亡細胞數目不同程度減少,以 24 h、48 h、72 h差異顯著(P<0.05)。見表3。
表3 皮質 TUNEL陽性細胞數量比較(±s,n=5)
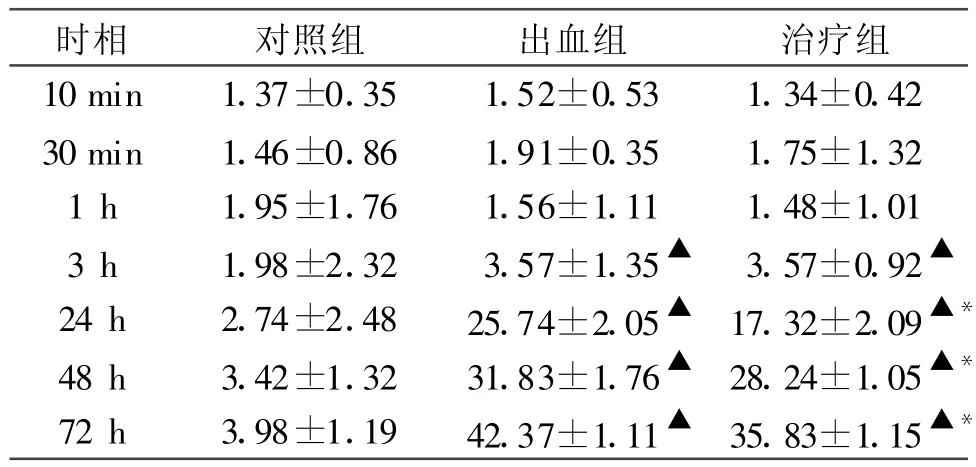
表3 皮質 TUNEL陽性細胞數量比較(±s,n=5)
注:與對照組相比▲P<0.05,與出血組相比 *P<0.05
時相 對照組 出血組 治療組10 min 1.37±0.35 1.52±0.53 1.34±0.42 30 min 1.46±0.86 1.91±0.35 1.75±1.32 1 h 1.95±1.76 1.56±1.11 1.48±1.01 3 h 1.98±2.32 3.57±1.35▲ 3.57±0.92▲24 h 2.74±2.48 25.74±2.05▲ 17.32±2.09▲*48 h 3.42±1.32 31.83±1.76▲ 28.24±1.05▲*72 h 3.98±1.19 42.37±1.11▲ 35.83±1.15▲*
2.3 相關性分析 Cytc與TUNEL陽性細胞數呈直線正相關(r=0.817,P<0.01)、Caspase-3與 TUNEL陽性細胞數呈直線正相關(r=0.921,P<0.01)、Cytc與 Caspase-3呈直線正相關(r=0.525,P<0.01)。
3 討論
SAH是由于各種原因使血液進入顱腔或椎管內的蛛網膜下腔所引起的綜合征,分原發性和繼發性兩種。前者主要緣于血管壓力過高出血量大引發嚴重并發癥,如腦血管痙攣、顱內高壓、腦水腫等,后者的損傷機制比較復雜,涉及多種內源性損傷因子(如谷氨酸)的釋放,最終引起神經細胞死亡,導致神經功能障礙。最近研究發現[6],SAH后的神經元缺損也可以由細胞凋亡引起,其凋亡現象已在人和動物實驗中所證明[7、8]。本實驗中TUNEL陽性細胞于出血后24小時顯著表達、48小時明顯升高、72小時達高峰。可見,SAH時神經細胞死亡可能通過神經元凋亡途徑引起。
細胞色素C(Cytochrome,Cytc)是線粒體呼吸鏈必須的一類色素蛋白,除參與細胞呼吸活動外,在激活和誘導細胞凋亡方面具有重要意義。在神經元凋亡過程中,Cytc通過線粒體外膜釋放,在ATP/dATP的參與下,在胞質中與Apaf-1結合形成寡聚體,A-paf-1通過氨基酸與Caspase-9前體的功能前區相互作用凋亡信號刺激使其從線粒體釋放至細胞液,之后激活半胱氨酸蛋白酶Caspase-3啟動凋亡級聯反應[9]。大量實驗證實,凋亡的發生似乎是蛋白酶級聯切割過程,Caspase-3在這一過程中處于核心位置,被稱為死亡蛋白酶,不同的蛋白酶切割Caspase-3促其激活,活化的Caspase-3又切割不同的底物,形成蛋白酶級聯切割放大機制,構成凋亡的下游事件,最終導致細胞產生凋亡形態學和生化特征。研究發現將Cytc注入不同類型的細胞,發現其可誘導細胞凋亡[10],抑制Cytc的釋放能減輕腦損傷[11]。Clark等[12]在控制性皮質沖擊傷模型中也證實了Caspase-3的活化參與了,急性腦損傷后腦組織的丟失,并觀察到Caspase-3在24小時達到高峰,應用Caspase-3抑制劑后凋亡減輕。Kuawabara等[13]在椎動脈穿刺模型中發現,出血后早期(4小時)即可檢測到Caspase-3,并且持續48小時。本實驗中SAH3 h即可以檢測到Cytc的增加,24 h達高峰 ,48 h后下降,并且Cytc與TUNEL相關分析呈高度正相關,證實在此模型中Cytc的產生可能參與SAH后皮質神經細胞凋亡。本實驗中,出血后24小時,皮質神經元中Caspase-3的表達呈逐漸增多趨勢,于48小時達高峰,在頂葉及相鄰的額葉、枕葉、顳葉皮質均可見Caspase-3大量表達,與假手術組比較差異顯著(P<0.01)。此外,Caspase-3蛋白的分布與表達其時相性及空間分布與其相鄰切片所標記的TUNEL陽性細胞分布大致符合。Cyt-c與Caspase-3呈正相關。以上結果表明SAH后可能通過線粒體釋放Cytc激活Caspase-3途徑,導致神經細胞發生凋亡。
apoE是正常人血漿脂蛋白中重要的載脂蛋白成分,主要功能為運輸并介導某些脂蛋白與相應的受體。近年來apoE在中樞神經系統疾病中的作用引起了廣泛關注。內源性apoE或腦室內apoE全蛋白通過下調中樞神經系統炎癥反應、減輕氧化應激等作用發揮神經保護作用[14]。研究證實SAH后給予外源性apoE明顯改善了腦缺血和SAH的預后[15],但具體機制尚不明確。本實驗結果表明apoE在明顯降低凋亡數量的同時,對Cytc及Caspase-3其蛋白表達量也相應減少,且TUNEL陽性細胞數與Cytc、Cytc與 Caspase-3、Caspase-3 與 TUNEL陽性細胞數均呈正相關,這也提示了apoE有明顯的腦保護作用,而且其機制可能是通過減低Cytc的釋放減少Caspase-3途徑的凋亡而發揮其腦保護作用。
[1]盛寶英,喬香蘭,王明禮.興奮性氨基酸與腦梗死的臨床研究[J].中國急救醫學,2000,21(12):715.
[2]Montal M.Mitochondria,glutamate neurotoxicity and the death cascade[J].Biochimica et Biophysica Acta,1998,1366(1-2):113.
[3]Yoonki Lee a,Mitsuo Aonoa,Daniel Laskowitz b,David S.Warner a,c,Robert D.PearlsteincApolipoprotein E protects against oxidative stress in mixedneuronal-glial cell cultures by reducing glutamate toxicity[J].Neurochemistry International,2004,44(2):107.
[4]Gao JL,Wang HC,Laskowitz DT,etal.A novel apoe-derived peptide therapeutic reduces vasospasm and improves outcome in a murine model of subarachnoid hemorrhage[J].Neurocritical care,2006,4(1):25.
[5]Bederson J B,Germano M,Guarino L.Cortical blood flow and cerebral perfusion pressureina new noncranioto my model of subarachnoid hemorrhage in rats[J].Stroke,1995,26(6):1086.
[6]Bramlett HM,Dietrich WD.Pathophysiology of cerebral ischemia and brain trauma:Similarities and differences[J].J Cereb BloodFlow Metab,2004,24(2):133.
[7]Kaya SS,Mahmood A,Li Y,et al.Apoptosis and expression of p53 response proteins and cyclin D1 after cortical impact in rat brain[J].Brain Res,1999,818(1):23.
[8]Shaw K,Mackinnom MA,Raghupathi R,et al.TUNEL-positive staining in white and grey matter after fatal head injury in man[J].Clin Neuropathol,2001,20(3):106.
[9]Niquet Jseo DW,Waseterlain CG.Mitochondrial pathways of neuronal necrosis[J].Biochem Soc Trans,2006,34(Pt6):1347.
[10]Zhivotovsky B,Orrenius S,Brustugun OT,et al.Injectde cytochrome C induced apopyosis[J].Nature,1998,29,391(66):449.
[11]MullerGJ,La ssmann H,Jo hansen FF.Anti-apoptotic signaling and failure of apoptosis in the ischemic rat hippocamus[J].Neurobiol Dis,2007,25(3):582.
[12]Clark RS,Kochanek PM,Watkins SC,et al.Caspase-3-mediated neuronal death after traumatic brain injury in rats[J].Neurochem,2000,74:740.
[13]Cernak I,Chapman SM,Hamlin GP,et al.Temporal characterisation of pro-and anti-apoptotic mechanisms following diffuse traumatic brain injury in rats[J].Clinical Neuroscience,2002,9(5):565.
[14]LaDu MJ,Shah JA,Reardon CA,et al.Apolipoprotein E and apolipoprotein E receptors modulate A beta-induced glial neuroinflammatory responses[J].Neurochem Int,2001,39(5-6):427.
[15]Junling Gao,Haichen Wang,Huaxin Sheng,et al.A novel apoe-derived therapeutic reduces vasospasm and improves outcome in a murine model of subarachnoid hemorrhage[J].Neurocrit Care,2006,4(1):25.

