鹽酸曲美他嗪分散片的制備與質量控制
劉海蓉
(南京大學口腔醫學院南京市口腔醫院,江蘇 南京 210008)
鹽酸曲美他嗪分散片的制備與質量控制
劉海蓉
(南京大學口腔醫學院南京市口腔醫院,江蘇 南京 210008)
目的 對鹽酸曲美他嗪分散片的制劑工藝和質量控制方法進行研究。方法 根據處方和制備工藝制備鹽酸曲美他嗪分散片,采用高效液相色譜法測定其有關物質,紫外分光光度法測定其含量和溶出度。結果 所制鹽酸曲美他嗪分散片質量穩定,主要質量參數分散均勻性符合要求。結論 鹽酸曲美他嗪分散片的設計合理,質量可控,穩定性好。
鹽酸曲美他嗪;分散片;質量控制
鹽酸曲美他嗪是法國施維雅公司研制的一種新型抗心肌缺血藥物,由日本Kyoto制藥公司在日本首先上市,商品名為Vastarel,迄今已在90多個國家廣泛使用。鹽酸曲美他嗪具有對抗腎上腺素、去甲腎上腺素及加壓素的作用,能降低血管阻力,增加冠狀動脈及循環血流量,促進心肌代謝及心肌能量的產生,同時也能降低心肌耗氧量,從而改善心肌氧的供需平衡[1]。鹽酸曲美他嗪用于心絞痛的預防和治療,具有臨床療效顯著、可與其他藥物合用、不良反應小等優點。近年來,隨著臨床研究的深入開展,鹽酸曲美他嗪也逐漸應用在冠狀動脈粥樣硬化性心臟病、急性心肌梗死等其他心血管疾病的治療[2-3]。目前國內鹽酸曲美他嗪制劑皆為普通片劑或膠囊,但心絞痛常發病突然,患者急性發病時極有可能會發生吞服藥物困難。分散片作為新興劑型,具有崩解迅速、服用方便的特點,可吞服、咀嚼含吮或以水分散成均勻且口感良好的混懸液服用,尤其適合老人及吞服困難者或者特殊環境下的患者服用,可增加患者的順應性[4]。因此,我院研制了鹽酸曲美他嗪分散片。現將其制備和質量控制方法報道如下。
1 儀器與試藥
ZRS-4型智能溶出試驗儀(天津大學無線電廠);UV-2201型紫外-可見分光光度計(日本島津公司);TDP型單沖壓片機(上海天祥制藥機械有限公司);SPD-10A/LC-10AT型高效液相色譜儀(日本島津公司);Agilent 1100型自動進樣器(美國安捷倫公司)。鹽酸曲美他嗪對照品(中國藥品生物制品檢定所,批號為132381-200803);鹽酸曲美他嗪(山東科源制藥有限公司,批號為080912);微晶纖維素(批號為080717)、磷酸氫鈣(批號為080309)均由安徽山河藥用輔料股份有限公司生產;交聯聚維酮(美國國際特品公司,批號為03400119204);交聯羧甲基纖維素鈉(美國FMC公司,批號為TN08820465);阿司帕坦(常州法碼泰克藥用輔料有限公司,批號為07102218);硬脂酸鎂(湖州展望藥業有限公司,批號為20080107)。
2 方法與結果
2.1 處方與制備
2.1.1 處方
鹽酸曲美他嗪20 g,微晶纖維素66 g,磷酸氫鈣45 g,交聯聚維酮8 g,交聯羧甲基纖維素鈉6 g,阿司帕坦4 g,硬脂酸鎂1 g,2%羥丙基甲基纖維素溶液(以50%乙醇配制)適量,共制成1 000片。
2.1.2 制備工藝
將鹽酸曲美他嗪原料過100目篩,其余輔料過80目篩,取處方量的鹽酸曲美他嗪與微晶纖維素、磷酸氫鈣、阿司帕坦和交聯聚維酮充分混合均勻;用2%羥丙基甲基纖維素乙醇(50%)溶液濕法制粒,過內徑0.850 mm(24目)篩制得濕顆粒,烘干至水分不高于2%,制得干顆粒;將干顆粒以內徑1.190 mm(16目)篩整粒,加入硬脂酸鎂和交聯羧甲基纖維素鈉,混合均勻;根據顆粒含量計算片重,壓片,得鹽酸曲美他嗪分散片。
2.2 質量控制
2.2.1 有關物質檢測(高效液相色譜法)
色譜柱以十八烷基硅烷鍵合硅膠為填充劑;流動相為用磷酸調 pH至 2.8的0.025 mol/L磷酸二氫銨溶液-甲醇(80∶20);檢測波長為232 nm;流速為1.0 mL/min。精密稱取本品細粉適量,約相當于鹽酸曲美他嗪15 mg,置25 mL量瓶中,加流動相超聲溶解并稀釋至刻度,搖勻,濾過,取續濾液作為供試品溶液;精密量取續濾液1 mL,置100 mL量瓶中,加流動相稀釋至刻度,搖勻,作為對照溶液。取對照溶液10 μL,注入液相色譜儀,調節檢測靈敏度,使主成分色譜峰的峰高為記錄儀滿量程的10% ~20%;再精密量取供試品溶液與對照溶液各10 μL,分別注入液相色譜儀,記錄色譜圖至主成分峰保留時間的3倍。供試品溶液色譜圖中如有雜質峰,各雜質峰峰面積的和不得大于對照溶液主峰面積的1.5倍(1.5%)。結果本品有關物質含量為0.32%。
2.2.2 含量測定(紫外-可見分光光度法)[5]
取本品20片,精密稱定,研細,精密稱取適量(約相當于鹽酸曲美他嗪20 mg),置100 mL量瓶中,加0.05 mol/L的硫酸溶液適量,超聲使鹽酸曲美他嗪溶解,放冷,用0.05 mol/L的硫酸溶液稀釋至刻度,搖勻,濾過,精密量取續濾液5 mL,置50 mL量瓶中,用0.05 mol/L的硫酸溶液稀釋至刻度,搖勻,照2005年版《中國藥典(二部)》附錄ⅣA紫外-可見分光光度法在232 nm波長處測定吸光度,按C14H22N2O3·2 HCl的吸收系數()為286計算,即得。結果本品相對百分含量為99.6%。
2.2.3 分散均勻性
按照2005年版《中國藥典(二部)》附錄ⅠA規定操作,取本品2片,置100 mL水中振搖,水溫(20±1)℃,應在3 min內崩解,混懸液應能全部通過2號篩(內徑0.850 mm)。結果本品2 min內全部崩解,混懸液完全通過2號篩,表明分散均勻性良好。
2.2.4 溶出度測定
溶劑選擇:鹽酸曲美他嗪在水中易溶,故選用水為溶出介質。
測定波長選擇:本品的溶出溶液在0.05 mol/L硫酸溶液中、(232±2)nm波長處具有明顯的吸收特征,而處方量空白輔料同法測定則在232 nm波長附近無吸收,故選擇232 nm為測定波長。
線性關系考察:取鹽酸曲美他嗪20 mg,精密稱定,用0.05mol/L的硫酸溶液配制成質量濃度分別為 4.0,8.0,12.0,16.0,20.0,24.0 μg/mL的溶液,在232 nm波長處測定吸光度,以吸光度(A)對溶液質量濃度(C)進行線性回歸,得回歸方程 A=0.027 8 C+0.017 2,r=0.999 9(n=6)。結果表明,鹽酸曲美他嗪質量濃度在4.0 ~24.0 μg/mL 范圍內與吸光度線性關系良好。
回收率試驗:分別精密稱取不同量的鹽酸曲美他嗪和空白輔料,混勻,用0.1 mol/L硫酸溶液配制成分別含主藥50%,80%,100%的溶液,每個質量濃度配制3份,作為供試品溶液。另取鹽酸曲美他嗪對照品適量,用0.1 mol/L的硫酸溶液配制成每1 mL約含鹽酸曲美他嗪20 μg的溶液,作為對照品溶液。取上述溶液,照紫外-可見分光光度法在232 nm波長處分別測定吸光度。結果平均回收率為99.8%,RSD=0.75%(n=9),表明方法回收率良好。
溶出曲線測定:取本品和市售普通片,照溶出度測定法,分別于 3,6,10,15,20,30 min 時取樣,測定溶出曲線。結果所制鹽酸曲美他嗪分散片溶出速率以及最終溶出度均優于市售普通片(圖1)。
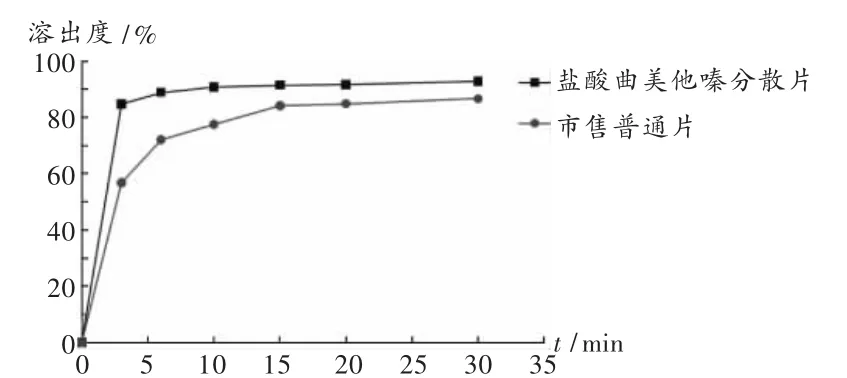
圖1 鹽酸曲美他嗪分散片和市售普通片的溶出曲線
溶出度測定:取本品,照2005年版《中國藥典(二部)》附錄ⅩC第一法溶出度測定法,以水500 mL為溶出介質,轉速為75 r/min,操作15 min,取溶液適量,濾過,精密量取續濾液5 mL,置10 mL量瓶中,用0.1 mol/L的硫酸溶液稀釋至刻度,搖勻,照2005年版《中國藥典(二部)附錄ⅣA紫外-可見分光光度法在232 nm波長處測定吸光度,按C14H22N2O3·2HCl的吸收系數()為286計算每片的溶出量,限度為標示量的75%。結果本品溶出度為(91.7±2.2)%(n=6)。
2.3 穩定性考察
分別將市售包裝的樣品于溫度40℃、相對濕度75%的恒溫恒濕條件下加速試驗6個月,樣品于留樣室(溫度25℃、相對濕度60%)自然放置24個月,檢查主要質量指標。結果見表1。
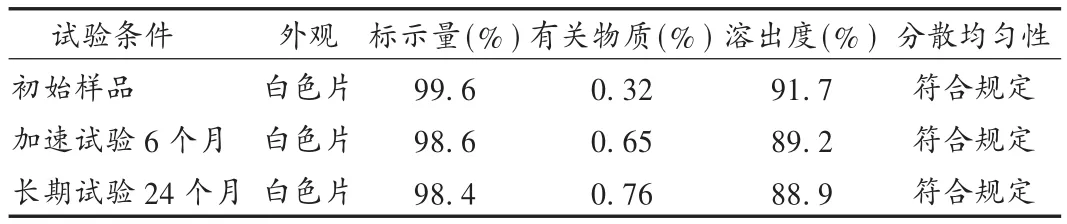
表1 穩定性考察結果
3 討論
分散均勻性是分散片質量控制的一個重要指標,結合主藥性質選擇適合的崩解劑是處方制備中的關鍵因素之一。交聯聚維酮是近年來開發的優良新輔料之一,具有很強的吸水膨脹性和優良的崩解性能,在水中可迅速表現出高的毛細管活性和優異的水化能力[6]。選擇交聯聚維酮內加、交聯羧甲基纖維素鈉外加的聯合使用方式,充分利用不同崩解劑的不同作用原理,能夠使鹽酸曲美他嗪分散片迅速崩解,還可提高主藥溶出度。本品在儲藏過程中可能產生降解產物,為保證產品的質量穩定,在曲美他嗪片質量標準基礎上,分散片的質量標準增加了有關物質的檢查項,采用高效液相色譜法檢測,并進行了方法學研究。長期穩定性試驗結果表明,本品質量穩定,經加速試驗6個月、長期穩定性試驗24個月后,含量、溶出度和有關物質等項目均符合規定。
[1]羅先虎,羅 勇.曲美他嗪的臨床應用與研究進展[J].實用心腦肺血管雜志,2009,17(12):1 114-1 117.
[2]范金英.曲美他嗪治療冠心病的臨床療效[J].中國實用醫藥,2009,4(12):80-82.
[3]沈 寧,王 偉.曲美他嗪與急性心肌梗死的研究進展[J].醫學綜述,2009,15(20):3 149-3 152.
[4]徐 成,金 春,周自桂,等.乳酸左氧氟沙星分散片的制備與質量研究[J].醫藥導報,2009,28(5):642-645.
[5]WS-10001-(HD-1254)-2002,國家藥品標準·曲美他嗪片[S].
[6]鄭少杰,韓章遠,韓永龍.藥用輔料交聯聚維酮的應用進展[J].中國藥房,2010,21(13):1 244-1 246.
Preparation and Quality Control of Trimetazidine Hydrochloride Dispersion Tablets
Liu Hairong
(School of Stomatology, Nanjing Stomatological Hospital, Nanjing University, Nanjing,Jiangsu,China 210008)
Objective To study the preparation and quality control of Trimetazidine Dihydrochloride Dispersion Tablets.Methods The HPLC method was established for the related substances determination.The content and dissolution determination was established by UV spectrophotometry.Results The uniformity of disperse of Trimetazidine Dihydrochloride Dispersion Tablets was qualified.Conclusion The preparation was reasonable,controllable and stable.
trimetazidine hydrochloride;dispersion tablets;quality control
TQ460.6;R972+.3
A
1006-4931(2011)07-0032-03
2009-11-18)
劉海蓉,女,主要從事臨床藥學工作,(電話)025-83374241(電子信箱)lhr441441@163.com。

