貯藏玉米中優勢腐敗霉菌M13的分離與鑒定
岳曉禹,徐 軍,張恒業,孫忠偉,李 欣,劉相東
(1.鄭州牧業工程高等專科學校質檢系,河南鄭州 450011; 2.中國農業大學工學院,北京 100083; 3.蘇州國發創業投資控股有限公司,江蘇蘇州 215128)
貯藏玉米中優勢腐敗霉菌M13的分離與鑒定
岳曉禹1,2,徐 軍1,張恒業1,孫忠偉3,李 欣1,劉相東2
(1.鄭州牧業工程高等專科學校質檢系,河南鄭州 450011; 2.中國農業大學工學院,北京 100083; 3.蘇州國發創業投資控股有限公司,江蘇蘇州 215128)
貯糧的安全關系到國計民生,對其中的腐敗微生物進行分析研究具有重要意義。從貯藏玉米中分離到一株優勢腐敗霉菌M13,通過形態特征觀察和ITS序列分析,將該菌株初步鑒定為米曲霉(Aspergillus oryzae),并構建了其系統發育樹,更是提供了一種準確可靠且簡單易行的糧食真菌鑒定技術。
玉米,形態特征,ITS序列分析,系統發育樹
貯糧品質關系到食品生產及飼料加工安全,當環境溫濕度滿足霉菌生長的條件后,貯藏玉米就有可能發生霉腐現象[1],不僅影響其貯藏穩定性和安全性,而且還會使其食用及加工工藝品質下降。更有甚者會產生黃曲霉毒素等真菌毒素及霉菌的其他有毒代謝產物[2],從而對人類健康和牲畜飼養的安全造成嚴重威脅[3-5]。霉菌的種類和數量能基本反映糧食的安全狀況。對玉米中存在的腐敗或病原霉菌進行分離和鑒定,是實現玉米安全貯藏的重要一步。隨著分子生物學技術的發展,rDNA內轉錄間隔區(internal transcribed spacer,ITS)序列分析技術由于穩定性好和測序方便,已廣泛地運用到真菌種屬水平的分類鑒定研究中[6-9]。本文從貯藏玉米中分離、純化出其中占優勢的霉菌菌株,對其中一株進行了鑒定,以了解貯藏玉米的優勢霉菌,為糧食的科學貯藏和食品安全控制提供參考。
1 材料與方法
1.1 材料與儀器
玉米 產于許昌;馬鈴薯葡萄糖瓊脂培養基(Potato Dextrose Agar,PDA) 附加抗菌素;查氏培養基(Czapek’s Agar,CA),查氏酵母膏培養基(Czapek Yeast Extract Agar,CYA),10mg/mL鏈霉素、6×上樣緩沖液(Loading buffer)、50×TAE電泳緩沖液、10mg/mL溴化乙錠(EB)貯存液、1mol/L Tris-HCl (pH8.0)、0.5mol/L EDTA(pH8.0)、TE緩沖液、10% CTAB-0.7mol/L NaCl、提取緩沖液、氯仿∶異戊醇(24∶1) 配制上述試劑所用的藥品均為分析純;TaqDAN聚合酶、蛋白酶K、RNase酶 北京天根生物技術公司。

表1 ITS rDNA PCR擴增反應體系
凝膠成像系統Biosens SC 810 上海山富科學儀器有限公司;PCR儀 Primus 96 Advanced 德國Peqlab公司;穩壓穩流電泳儀EPS-300 上海天能科技有限公司;顯微攝像頭DEM 杭州數明科技有限公司。
1.2 實驗方法
1.2.1 貯藏玉米中主要霉菌的分離、純化與保存
取3份供試玉米置于滅菌平板中,加入適量無菌水,使其水分活度達0.97后,在28℃下培養。待其長出霉菌后,挑取形態各異的菌株,劃線接種到PDA培養基平板上,28℃培養。之后反復進行平板劃線,直至得到形態不同的單菌落。供試菌株于沙土管中長期保存,或PDA斜面上培養后于4℃臨時保存備用。
1.2.2 真菌菌株的形態學觀察 將不同形態的菌株點接種在PDA培養基、查氏培養基、查氏酵母膏培養基固體平板上,28℃培養12d,觀察菌落形態特征。觀察菌落在培養基中的顏色、菌落形成是否規則、菌落大小、菌絲體是否發達等。
固體培養基中插片培養3~5d,待菌絲附著在蓋玻片上時,取出,于顯微鏡下觀察。鏡檢孢子形狀、菌絲體有否橫隔膜,孢子梗形態結構等。
1.2.3 系統發育學方法鑒定
1.2.3.1 菌體的培養與收集 菌株的培養∶將分離得到的菌株,在PDA斜面上活化后,接種到含200mL PDA液體培養基的500mL三角瓶中,28℃、180~200r/min搖床培養至對數生長后期,鏡檢,驗純。
菌體的收集∶驗純后的菌絲培養液,用2層無菌紗布過濾,然后用無菌去離子水洗滌2~3次,再用TE緩沖液洗滌1次,無菌濾紙盡量擠干水分,置于Ep管中,于-20℃保存備用。
1.2.3.2 絲狀真菌總DNA的提取 采用CTAB法,參考文獻[10-13]的方法提取總DNA,有改動。對所提取的DNA樣品,采用1%瓊脂糖平板凝膠電泳,EB染色,5μL上樣,紫外檢測其提取質量。
1.2.3.3 PCR擴增 引物∶以基因組DNA為模板,根據酵母rDNA保守區段設計引物,擴增待鑒定菌株的ITS區域(ITS1-5.8S rDNA-ITS2)[12]。
ITS區域∶正向引物∶GGA AGT AAA AGT CGT AAC AAG G,反向引物∶TCC TCC GCT TAT TGA TAT GC。引物由“上海生工生物工程技術服務有限公司”合成。
擴增反應體系∶PCR反應體系為30μL,每次反應均設陰性對照(不加模板)。具體組成見表1。
擴增程序∶按下述程序進行擴增ITS rDNA基因。預變性94℃ 5min;變性94℃ 30s;退火55℃30s;延伸72℃ 40s;重復步驟40個循環;最終延伸72℃ 7min。擴增產物于-20℃下保存。
PCR產物檢測∶瓊脂糖凝膠電泳檢測產物,以標準DNA分子量作對照。電泳結束后,用紫外凝膠掃描儀掃描、照相,檢測擴增片斷長度與產量。
1.2.3.4 ITS rDNA堿基序列分析 將電泳檢測后的PCR產物送上海生工生物工程技術服務有限公司測序,測序所用引物與做PCR所用引物為同一對引物。測序結果經校對后采用 BLAST(BasicLocal Alignment Search Tool)程序,在國際生物技術信息中心(NCBI)GenBank數據庫(http∶//www.ncbi.nlm. nih.gov)中進行序列相似性比對搜索,查看堿基序列相似性。
1.2.3.5 系統發育樹分析 利用BLAST程序,將所測得的ITS序列與GenBank數據庫中已知菌株的ITS序列進行比對,依據比對結果,選取同源性適當較高的已知菌株的ITS序列和所測菌株的ITS全序列一起建立系統發育樹。用MEGA4.0軟件采用鄰接法(Neighbor-Joining,NJ法)和最大簡約法(Maximum Parsimony,MP法)構建系統發育樹[14],自展值為1000。
1.2.4 菌種鑒定 根據菌株的形態學特征,結合系統發育學結果,參考資料對分離純化后的菌株進行鑒定[15-17]。
2 結果與分析
2.1 貯藏玉米中優勢腐敗霉菌的分離純化
貯藏玉米經過適當培養,生長出肉眼清晰可見的霉菌,這些霉菌為腐生型,對貯藏糧食均會帶來營養、衛生、安全等方面的危害,必須予以足夠重視。
經過在PDA培養基上的劃線純化,可以分離、純化出形態不同的霉菌。本文對經過適當培養后,以肉眼明顯可見,占生長優勢的霉菌作為分離純化對象,分離、純化出形態各異的霉菌,并對分離得到的M13菌株采取形態學方法,結合系統發育學,進行鑒定。
2.2 M13菌株的鑒定
2.2.1 M13菌株的形態學特征 M13鏡檢和菌落形態觀察,參見圖1~圖4。

圖1 M13菌株插片鏡檢
M13菌株鏡檢觀察,分生孢子頭散生,分生孢子幼時洋梨形或橢圓形,成熟后大多變為球形或近球形。分生孢子梗生自基質或氣生菌絲,生于氣生菌絲者較短,壁通常粗糙,頂囊近球形或燒瓶形。
M13菌株在PDA培養基上,27℃、7d菌落直徑
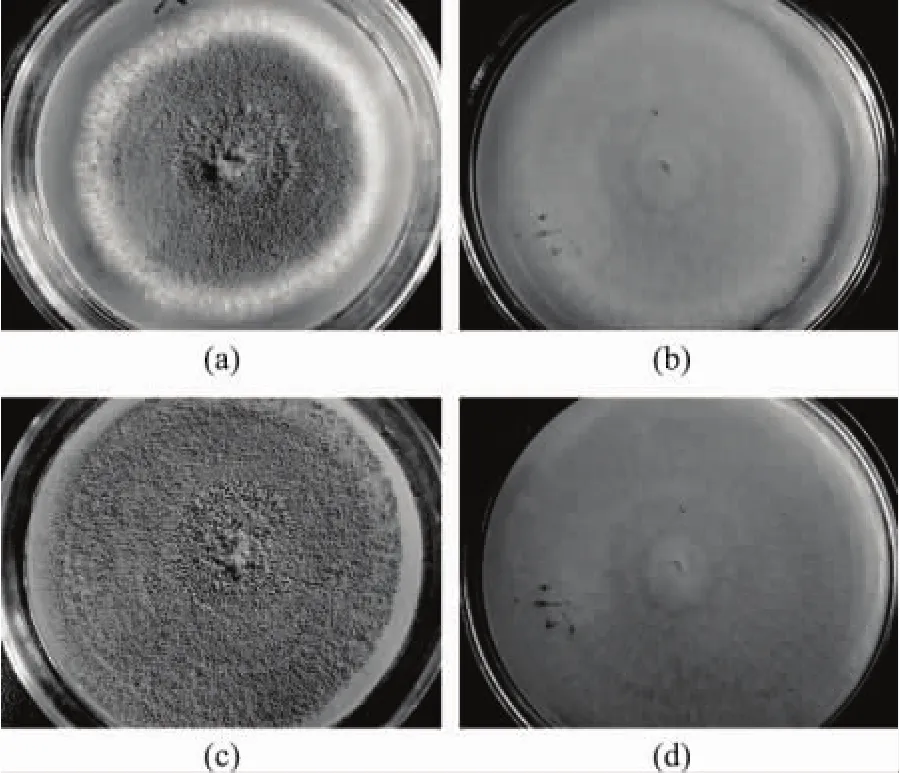
圖2 菌株M13在PDA培養基上的菌落形態

圖3 菌株M13菌株在查氏培養基上的菌落形態

圖4 菌株M13菌株在查氏酵母膏培養基上的菌落形態
M13菌株在查氏培養基上菌落生長較快,27℃、7d直徑65mm;質地較厚,具有輻射狀溝紋,中央現絮狀;初為白色、黃色,繼變為淡黃褐色至淡綠褐色,但不呈真正的綠色;菌落反面呈淡粉紅色至淡褐色,有輻射狀溝紋。
M13菌株菌落在查氏酵母膏瓊脂上27℃、7d直徑可達80mm;質地較厚,中央呈絮狀,具輻射狀溝紋,有菌核;菌落呈厚絨毛狀;初為白色,青色,淡黃褐色,后變為黃褐色至綠褐色,菌落反面淡粉紅色,可見輻射狀溝紋。
2.2.2 M13菌株的ITS序列同源性分析
2.2.2.1 DNA的提取 將所培養菌種的菌絲收集后,用CTAB法提取DNA。將提取的DNA進行1%瓊脂糖電泳,見圖5。由圖5中可以看出,其可以用于下一步PCR擴展。

圖5DNA瓊脂糖電泳
2.2.2.2 PCR檢測 采用所選取的引物,對不同霉菌基因組 DNA進行特異性擴增,均可以獲得約為590bp的ITS片段的PCR產物,如圖6所示。由圖6中可以看出,擴增片段約為580bp。
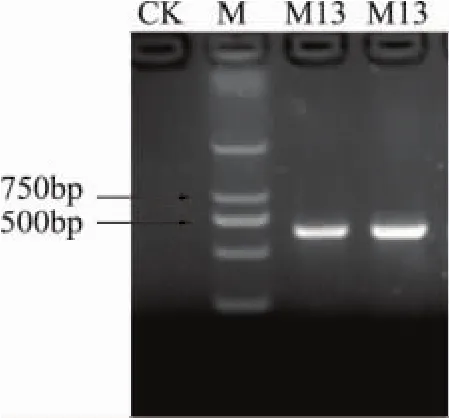
圖6 引物PCR擴增產物檢測圖譜
2.2.2.3 測序結果 M13菌株的ITS測序結果如下(580bp,包含18S rDNA的部分序列;ITS1、5.8S、ITS2處的全部序列;28S rDNA的部分序列)∶

將得到的M13菌株的序列在GenBank中進行同源搜索,運用DNAMAN軟件(Version 5.2.2)進行比對。結果表明,M13菌株與米曲霉(A.oryzae,EU409806)的 ITS、5.8S rDAN的序列同源性均為100%。
2.2.3 以ITS序列為基礎的系統發育樹構建 本研究用距離矩陣法(distance matrix method)中的鄰接法(neighbor-joining)以及最大簡約法(maximum parsimony,MP)構建系統發育樹,用自展法(bootstrap)檢驗系統樹的可靠性,自展次數為1000次,建樹選取的參比菌種見表2。利用MEGA 4.0軟件構建得到系統發育樹,如圖7所示。

表2 M13建樹選取的參比菌株

圖7 以ITS序列為基礎構建的M13菌株的系統發育樹
NJ法以及 MP法中 M13與米曲霉Aspergillus oryzae(AB000533)、黃 曲 霉Aspergillusflavus(FJ216383)、昆蟲曲霉Aspergillus nomius(DQ467976)、寄生曲霉Aspergillus parasiticus(DQ026005)聚為一枝。
2.3 鑒定結果
依據文獻[15-17],綜合M13菌株的形態特征、序列同源性以及系統發育樹結果,根據Renske[18]等認為真菌通過ITS區域比對,序列相似性≥99%可鑒別為相同種,初步鑒定該菌為米曲霉(Aspergillus oryzae)。米曲霉 (A.oryzae)歸類于叢梗孢目(Moniliales),叢梗孢科 (Moniliaceae),曲霉屬(Aspergillus)。
3 結論
本研究以傳統的形態學特征的鑒定為依據,同時采用rDNA ITS序列的比較分析,確定玉米中分離到的一株優勢腐敗霉菌為米曲霉(A.oryzae),并構建了其系統發育樹。米曲霉(A.oryzae)較多地被發現于發酵食品中,它可以釀制醬、醬油和味精,也可用來生產乳酸和糊化淀粉,很多資料中都把米曲霉歸為黃曲霉群(A.flavusGroup)。
長期以來真菌主要是依據其形態特征進行鑒定,但是形態性狀的生長受生長環境和生長時期的影響,鑒定的結果受主觀因素的影響也較大,因而基于形態性狀特征對真菌進行分類鑒定有一定的局限性。真菌核糖體DNA內轉錄間隔區(ITS)在進化上比編碼區快,種內的不同菌株之間高度保守,但在種間變化極大,ITS序列分析體現的是堿基差異,可為真菌學的研究提供豐富的遺傳信息,對真菌的鑒定有更好的準確性和靈敏性[19-21],同時借助 GenBank等生物數據庫的大量信息,從分子水平為真菌的準確分類、鑒定提供科學依據。本實驗進行的菌屬的鑒定,與傳統的真菌分類主要根據真菌菌株的形態特征、生長特性與生理生化指標相比,提升了真菌分類鑒定的可靠性。結果表明,形態特征、結合rDNA ITS序列分析能夠有效地進行貯糧中霉菌的鑒定,實驗結果也為分析影響貯藏糧食及飼料品質的主要腐敗微生物,開展生態貯糧研究提供了一定的參考價值和依據。
[1]黃淑霞,蔡靜平,田海娟.主要糧食品種儲藏期間霉菌活動特性研究[J].中國糧油學報,2010,25(1):99-102.
[2]Bennett J W,Klich M.Mycotoxins[J].Clinical Microbiology Reviews,2003,16(3):497-516.
[3]Pitt J I.Toxigenic fungi and mycotoxins[J].Br Med Bull,2000,56:184-192.
[4]Creppy E E.Update of survey,regulation and toxic effects of mycotoxins in Europe[J].Toxicol Lett,2002,127:19-28.
[5]蔡靜平.糧油食品微生物學[M].北京:中國輕工業出版社,2002.
[6]LI Zihui,FENG Xianmin,LU Siqi,et al.Molecular phylogeny of Pneumocystis based on 5.8S rRNA gene and the internal transcribed spacers of rRNA gene sequences[J].Science in China Series C:Life Sciences,2008,51(5):445-452.
[7]Geml J,Laursen G A,Timling I,et al.Molecular phylogenetic biodiversity assessment of arctic and boreal ectomycorrhizal Lactarius Pers.(Russulales;Basidiomycota)in Alaska,based on soil and sporocarp DNA[J].Molecular Ecology,2009,18(10): 2213-2227.
[8]AlaeiL H,De Backer M,Nuytinck J,et al.Phylogenetic relationships of Puccinia horiana and other rust pathogens of Chrysanthemum× morifolium based on rDNA ITS sequence analysis[J].Mycological Research,2009,113(6/7):668-683.
[9]Tedersoo L,Suvi T,Jairus T,et al.Revisiting ectomycorrhizal fungi of the genus Alnus:differential host specificity,diversity and determinants of the fungal community[J].The New Phytologist,2009,182(3):727-735.
[10]White T J,Bruns T,Lee S,et al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]. New York:Academic Press Inc,1990.
[11]Schabereiter-Gurtner C,Pinar G,Lubitz W,et al.An advanced molecular strategy to identify bacterial communities on art objects[J].Journal of Microbiological Methods,2001,45: 77-87.
[12]魏曉星.葡萄穗霉(Stachybotrys sp.)的分離鑒定及其β-葡萄糖苷酶的性質分析[D].北京:中國農業大學,2005.
[13]謝麗源,張勇,鄧科君,等.基于rDNA ITS序列分析的桑黃真菌菌株分子鑒定[J].食品科學,2010,31(9):182-186.
[14]Tamura K,Dudley J,Nei M,et al.MEGA4:molecular evolutionary genetics analysis(MEGA)software version 4.0[J]. Molecular Biology and Evolution,2007,24(8):1596-1599.
[15]魏景超.真菌鑒定手冊[M].上海:上海科技出版社,1979.
[16]中國科學院中國孢子植物志編輯委員會.中國真菌志第五卷.曲霉屬及其相關有性型[M].北京:科學出版社,1997.
[17]中國科學院微生物研究所編寫組.常見與常用真菌[M].北京:科學出版社,1973.
[18] Renske L,Paul A L,Than W K,et al.Molecular Identification of Ectomycorrhizal Mycelium in Soil Horizons[J]. Applied and Environmental Microbiology,2003,69(1):327-333.
[19]張傳博,蘇曉慶.幾種基于基因組DNA的真菌分類技術研究進展[J].貴州師范大學學報:自然科學版,2006,24(1): 113-118.
[20]蘇楊,張政,楊齊,等.纖維素降解真菌A25-2的分離、鑒定及其產纖維素酶的酶學特性[J].基因組學與應用生物學,2010,29(3):427-433.
[21]Agarwal M,Shrivastava N,Padh H.Advances in molecular marker techniques and their applications in plant sciences[J]. Plant Cell Reports,2008,27(4):617-631.
Isolation and identification of predominant spoiling strain M13 of mold in the stored maize
YUE Xiao-yu1,2,XU Jun1,ZHANG Heng-ye1,SUN Zhong-wei3,LI Xin1,LIU Xiang-dong2
(1.Zhengzhou College of Animal Husbandry Engineering,Zhengzhou 450011,China; 2.College of Engineering,China Agricultural University,Beijing 100083,China; 3.Suzhou International Development Venture Capital Holding Co.,Ltd.,Suzhou 215128,China)
It is very significant to research spoilage microorganisms in stored maize.A predominant strain of mold in the stored ice was isolated and identified.According to its morphological observation,phylogenetic analysis of ITS sequence and the reference manual related microbial identification,the strain was preliminary identified as Aspergillus oryzae.The measurement can be used as an accurate,reliable and straightforward method to identify the original species of the stored maize and explore genetic diversity.
maize;morphological characteristics;analysis of ITS sequence;phylogenetic tree
TS201.3
A
1002-0306(2011)11-0183-05
2011-08-04
岳曉禹(1974-),男,博士研究生,講師,研究方向:食品微生物。
2011年河南省重點科技發展計劃(112102110034);2011年度河南省教育廳自然科學研究計劃項目(2011A550014);鄭州牧專博士科研啟動資金項目(5040190)。

