菠蘿蛋白酶工業化提取工藝的改良及酶學性質研究
王 燕,趙力超,陳潔蘭,劉曉娟,劉 欣
(華南農業大學食品學院,廣東廣州 510642)
菠蘿蛋白酶工業化提取工藝的改良及酶學性質研究
王 燕,趙力超,陳潔蘭,劉曉娟,劉 欣*
(華南農業大學食品學院,廣東廣州 510642)
以菠蘿莖為原料,利用微濾除雜、超濾濃縮分離得菠蘿蛋白酶濃縮液,再通過硫酸銨法進行沉淀,最后進行真空冷凍干燥制取菠蘿蛋白粗酶;而為了驗證其酶學性質,采用Sephadex G-100柱層析和DEAE-52離子交換層析制得純度較高的菠蘿蛋白酶。結果表明:菠蘿莖打漿后原液通過微濾除雜、超濾濃縮,再采用90%硫酸銨沉淀等工序后,純化倍數達1.44,是目前工廠制酶的1.19倍,酶活收率與原液相比只降低9%,具有工業化生產的優越性;經Sephadex G-100柱層析和DEAE-52柱層析后,達到電泳純,可滿足醫藥用酶所需,存在很好的市場應用價值;且該菠蘿蛋白酶的酶學性質與有關報道基本一致,最適反應pH在5~6之間,最適溫度60℃,重金屬離子如Cu2+、Fe2+、Pb2+等對菠蘿莖蛋白酶活抑制較大,而Na+、K+、Ca2+則表現出不同程度的激活作用。
菠蘿莖蛋白酶,提取,純化,酶學性質
我國菠蘿資源豐富,菠蘿莖是菠蘿采收后留下的副產物,每公頃產量達37.5~45t[1],除少量用于提取菠蘿蛋白酶外,大部分未得到利用。目前用于工業化生產菠蘿蛋白酶的主要方法為傳統工藝的高嶺土吸附法和單寧沉淀法,以及新工藝的超濾濃縮法。其中高嶺土吸附法工藝操作步驟繁瑣,消耗原材料較多,設備要求較高,且酶活總回收率低[2-3];單寧沉淀法工藝操作相對高嶺土吸附法簡單,原材料消耗少,所需設備少,但酶活回收率較低[2-3];超濾法操作步驟少,條件溫和,降低了酶活損失,但所得酶制品中含有雜蛋白較多[2-4],所得酶活性不足以滿足醫藥級別及食品中對酶活要求較高的應用。而常規蛋白分子的分離提取常用硫酸銨沉淀法[5],其對于蛋白(酶)具有顯著的鹽析作用,可以通過控制硫酸銨加入量,以分級鹽析的方式對粗提液中的酶進行預提純。目前,硫酸銨沉淀法已普遍用于多種酶的工業化生產中,如大蒜蒜酶中試生產[6]、果膠酶濃縮工藝[7]等,但是僅僅利用硫酸銨沉淀法對酶進行純化,酶活回收率較低,不利于工業化生產。本文先利用微濾除雜、超濾濃縮分離得菠蘿蛋白酶濃縮液,再結合硫酸銨沉淀法,建立一整套菠蘿蛋白酶工業化生產工藝。超濾膜濃縮后采用硫酸銨沉淀,可減少樣品體積,大大減少硫酸銨的用量,而硫酸銨沉淀得酶膏,可減少真空冷凍的干燥預冷和干燥時間,降低生產成本。通過方法的組合,優化菠蘿莖蛋白酶提取工藝,得到純度和酶活回收率均高于原工廠酶的食品級用酶。同時,本文還對新工藝制得的酶的性質進行了測定,以期證明采用該工藝得到的菠蘿蛋白酶能保持目前使用的菠蘿蛋白酶原有的性質,且純化倍數和酶活回收率均較高,更有利于工業化生產。菠蘿蛋白酶分離提取技術的開發及其應用,可提高菠蘿廢棄物的綜合利用價值,加快菠蘿蛋白酶產業的發展。
1 材料與方法
1.1 材料與設備
菠蘿莖、原工廠酶 由湛江徐聞縣美侖生物制品有限公司提供;其它試劑 均為分析純。
752 型紫外可見分光光度計 上海精密科學儀器有限公司;FD-1PF真空冷凍干燥機 北京德天佑科技發展有限公司;Vivaflow 200超濾系統及其超濾離心管 Vivascience AG公司;ф1.6×80cm層析柱 上海嘉鵬科技有限公司;恒流泵、紫外檢測儀 上海清浦滬西儀器廠;MINI-PROTEANⅡ型電泳儀 Bio-RAD公司;日立UV-3010型紫外可見分光光度計日本日立公司。
1.2 實驗方法
1.2.1 工藝流程 菠蘿莖→壓榨→原液→低速離心→清液→微濾→透過液→超濾→濃縮液→硫酸銨沉淀→酶膏→透析脫鹽→真空冷凍干燥→精制酶
1.2.2 工藝要點
1.2.2.1 壓榨 將菠蘿莖洗凈,用壓榨機壓出汁液,然后用紗布過濾。
1.2.2.2 離心和微濾 5000r/min離心10min,上清液采用0.22μm膜進行過濾,得淺黃色菠蘿莖蛋白酶清液。
1.2.2.3 超濾 參考王平諸[4]的方法。先將截留分子量10000u的中空纖維超濾膜用水洗0.5h→堿洗0.5h→水洗0.5h,用去離子水測水通量(J0),菠蘿莖清液經5000r/min離心10min,0.22μm膜過濾后進行超濾濃縮,在泵提供的動力下,調節至固定流速,在一定操作溫度下,調節進出口壓力,溶液經微濾后進入超濾膜中。反復循環,濃縮至體積約為原體積的1/10。結束后,用水循環洗滌超濾膜0.5h,再用堿洗0.5h,最后再用水洗滌至恢復原來的水通量。
1.2.2.4 硫酸銨沉淀法 一級沉淀:取適量濃縮液,加入適量的硫酸銨,使其飽和度分別為10%、20%、30%、40%、50%、60%、70%、80%、90%,于低溫下靜置0.5h。10000r/min離心5min,沉淀用與樣品等體積的0.02mol/L pH=7.0 PBS溶解,分別測定上清液和沉淀的酶活和蛋白含量,計算收率和純化倍數,確定分級沉淀的初始和最終飽和度。分級沉淀:取適量濃縮液,轉入離心管中,按一級沉淀得到的分級沉淀的初始和最終飽和度加入硫酸銨,使其分別達到分級沉淀硫酸銨初始和最終飽和度,于低溫下靜置0.5h,之后操作同一級沉淀,測定酶活和蛋白含量。
1.2.3 純化方法
1.2.3.1 Sephadex G-100層析 取適量酶粉溶于1mL 0.02mol/L pH=7.0 PBS緩沖液,10000r/min冷凍離心5min,取上清液通過SephadexG-100層析(1.6cm×60cm),用0.02mol/L pH=7.0 PBS緩沖液進行洗脫,洗脫液流速為0.5mL/min,分別測定酶活和蛋白A280,計算收率和純化倍數。
1.2.3.2 DEAE-52離子交換柱層析 取Sepadex G-100層析酶活管,混合,測定體積,低溫凍結,真空冷凍干燥后溶于1mL 0.02mol/L pH=7.0 PBS緩沖液,10000r/min冷凍離心5min,取上清液上柱(1.6cm×40cm)。采用梯度洗脫的方式,洗脫液A:0.02mol/L pH=7.0 PBS緩沖液,洗脫液B:0.02mol/L pH=7.0 PBS緩沖液(內含0.5mol/L NaCl),各100mL,線性洗脫,洗脫液流速為1mL/min,測酶活和蛋白A280,計算收率和純化倍數。
1.2.4 測定方法
1.2.4.1 蛋白質含量的測定 參考裴顯慶[8]采用的考馬斯亮藍G-250法,以牛血清蛋白做標準蛋白,與Bradford試劑作用,用分光光度計在595nm處測定吸光度,樣品同樣處理,再通過標準曲線測定并算得蛋白含量。
1.2.4.2 菠蘿莖蛋白酶酶活測定 參考施特爾馬赫[9]采用的酪蛋白法。1min內酶水解酪蛋白釋放出相當于1μg/mL酪氨酸在275nm波長處的吸收度為1個活力單位。
1.2.4.3 SDS-PAGE電泳 參考丁宵霖等[10]的方法,將蛋白質樣品適量與5×上樣緩沖液(Loading Buffer)在離心管中混合,100℃加熱2~10min,8000r/min離心5min,用微量注射器將樣品20μL加入樣品孔中。采用濃縮膠75V,分離膠80~100V,電泳約2.5h,直到溴酚藍指示劑電泳到距膠邊緣1cm時停止電泳。小心取下凝膠,用考馬斯亮藍R-250染液染色30min,用考馬斯亮藍R-250脫色液脫色過夜,觀察結果。
2 結果與討論
2.1 菠蘿莖蛋白酶濃縮液的制備
壓榨后的菠蘿莖蛋白酶原液需迅速過濾后放入-20℃保存,防止酶活力降低。提取前將處于-20℃保存的菠蘿莖蛋白酶原液解凍,5000r/min離心10min,以除去不溶性雜質。上清液采用0.22μm膜進行預過濾,以除去微生物、一些大分子蛋白和多糖等膠體物質,得淺黃色菠蘿莖蛋白酶清液。再將清液進行超濾濃縮,一方面溶液中的小分子物質經中空纖維膜的內壁滲透出來成為超濾液而排出;另一方面,料液通過蠕動泵循環打入超濾膜,溶液中的酶蛋白等大分子物質得以保留并得到濃縮。
2.2 硫酸銨鹽析法提取菠蘿莖蛋白酶
菠蘿蛋白酶是典型的巰基蛋白酶,是一種分子量為33000u的蛋白質[9]。硫酸銨是強電解質,有強烈的水化作用,可破壞蛋白質顆粒表面的水化膜,并能中和蛋白質顆粒所帶的電荷,使蛋白質在溶液中凝聚而析出。但只有達到蛋白質等電點時,其才易于沉淀,不同蛋白質有不同等電點,即硫酸銨鹽析濃度不同,且不同蛋白質硫酸銨鹽析的最佳次數不同[10],因此,需對其進行硫酸銨一級沉淀和分級沉淀實驗。
2.2.1 硫酸銨一級沉淀結果 經超濾濃縮后酶液進行硫酸銨一級沉淀,實驗結果如圖1和圖2所示。
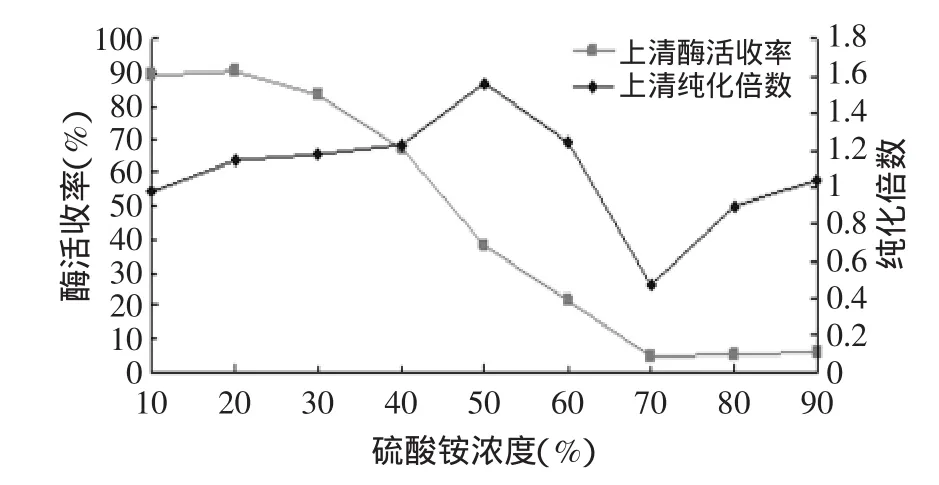
圖1 上清酶活收率和純化倍數的變化
由圖1可知,菠蘿莖蛋白酶濃縮液上清部分的酶活收率隨硫酸銨飽和度的增加呈現逐步下降的趨勢,當硫酸銨的添加量達到70%時,上清的酶活收率為4.51%,上清已基本沒有酶活;當硫酸銨濃度達到50%時,上清純化倍數達到最高值1.57倍,但酶活收率只有38.08%;硫酸銨添加濃度為20%時,上清酶活收率為90.42%,純化倍數為1.15倍。綜合考慮上清酶活收率和純化倍數,確定兩步沉淀的初始硫酸銨濃度為20%。

圖2 沉淀酶活收率和純化倍數的變化
由圖2可知,隨著硫酸銨濃度的增加,沉淀部分的酶活收率呈現逐步上升的趨勢,在硫酸銨濃度達到70%時,沉淀部分酶活收率達到最大值95.49%,隨后酶活收率趨于穩定;就沉淀部分的純化倍數而言,10%、20%濃度硫酸銨所得沉淀的純化倍數較高,分別為2.29和1.58倍,但酶活收率分別只有10.70%和9.58%,30%~70%濃度硫酸銨所得沉淀的純化倍數均小于1,純化效果不好,而90%濃度硫酸銨沉淀的純化倍數相對較高,為1.43倍,酶活收率達94.21%。綜合考慮沉淀酶活收率和純化倍數,確定硫酸銨濃度為90%作為分級沉淀的終濃度。
2.2.2 硫酸銨分級沉淀結果 在一級沉淀確定的初濃度和終濃度下,進行硫酸銨分級沉淀,并與一級沉淀結果進行對比,實驗結果如表1所示。
由表1可知,采用20%~80%分級沉淀所得的酶活收率和純化倍數均比一級沉淀的低,而采用90%一級沉淀所得酶純化倍數最高,酶活收率僅降低0.36%。綜合考慮酶活收率和純化倍數,濃縮液一級沉淀使用90%硫酸銨所得結果最好。同時比較工廠精制酶,90%硫酸銨沉淀所得酶純度是工廠酶的1.19倍,該精制酶代表工廠目前生產的最高水平,因此本工藝提取的酶在純度上具有優越性。

表1 硫酸銨沉淀結果
2.2.3 硫酸銨沉淀酶液的電泳結果 在進行了硫酸銨一級和分級沉淀確定最優工藝后,為確定純化效果,進行了不同處理酶的電泳實驗,結果如圖3所示。

圖3 濃縮液硫酸銨沉淀電泳圖
由圖3可知,菠蘿莖原液中含有較多的雜蛋白;濃縮液80%和90%硫酸銨沉淀中,分子量大于目標蛋白的雜帶已消失,分子量小于20ku的雜帶也明顯減少,這說明濃縮液經過硫酸銨沉淀后純化效果明顯。從電泳圖上也可看出,濃縮液80%和90%硫酸銨沉淀所得酶純度較工廠精制酶高,主要表現為分子量小于20ku雜帶區域顏色較工廠精制酶淺,即該部分雜蛋白較少,說明采取濃縮后硫酸銨沉淀的方式確實使酶的純度得到提高。
2.3 菠蘿莖蛋白酶的純化
為研究菠蘿莖蛋白酶酶學性質,對其進一級分離純化,制備純酶。
2.3.1 Sephadex G-100柱層析純化菠蘿莖蛋白酶Sephadex G-100柱層析純化結果如圖4所示。

圖4 菠蘿莖蛋白酶Sephadex G-100柱層析圖譜
由圖4可知,采用Sepadex G-100柱層析后,得到3個蛋白峰,其中第二個蛋白峰具有酶活,而第一和第三個蛋白峰基本無酶活,說明菠蘿莖蛋白酶與其它雜蛋白已基本分開。
2.3.2 DEAE-52離子交換柱層析純化菠蘿莖蛋白酶Sepadex G-100柱層析的酶活管經DEAE-52離子交換柱層析結果如圖5所示。
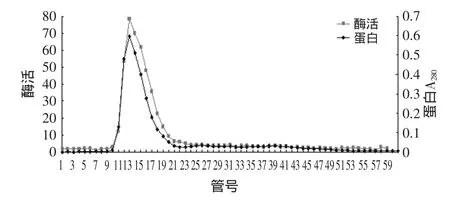
圖5 菠蘿莖蛋白酶DEAE-52離子交換柱層析圖譜
由圖5可知,經DEAE-52離子交換柱層析后,菠蘿莖蛋白酶只有一個酶活峰和一個蛋白峰,說明已實現了菠蘿莖蛋白酶與其它雜蛋白分開。
2.3.3 SDS-PAGE電泳檢驗 經DEAE-52離子交換柱層析制得菠蘿莖蛋白酶純酶,為進一步考察驗證酶分子的純度,進行了電泳實驗,實驗結果如圖6所示。

圖6 菠蘿莖蛋白酶純酶電泳圖
由圖6可知,經純化后所得菠蘿莖蛋白酶純度較高,在5%濃縮膠、12%分離膠電泳中表現出一條帶,說明所得酶已達到電泳純。同時,以相對遷移率對log分子量作圖,求得菠蘿莖蛋白酶分子量為24.5ku。
2.4 菠蘿莖蛋白酶純化表
為比較不同工藝下制得菠蘿莖蛋白酶的優劣,繪制了純化表,結果如表2所示。

表2 菠蘿莖蛋白酶純化表
由表2可知,隨純化倍數的提高,菠蘿莖蛋白酶的酶活收率逐步降低。與工廠現有工藝相比,采用超濾濃縮和硫酸銨沉淀相結合的提取方法,酶活收率和純化倍數均有較大提高,且工藝步驟相對簡便,成本較低,符合工業上提取高活力菠蘿蛋白酶的需要。而菠蘿莖蛋白酶經Sephadex G-100柱層析和DEAE-52柱層析后,純化倍數大大提高,該酶分子已達到電泳純,雖經過該處理酶活收率大大降低,最終只有約25%左右,但該生產工藝可滿足市場的不同需求,特別是醫藥用酶,因此若能將酶活收率的降低部分轉嫁到產品的成本上,提高產品的附加價值,也存在很好的市場應用價值。
2.5 菠蘿莖蛋白酶酶學性質研究
2.5.1 pH對菠蘿莖蛋白酶活力的影響 進行了不同pH體系酶活力實驗,結果如圖7所示。
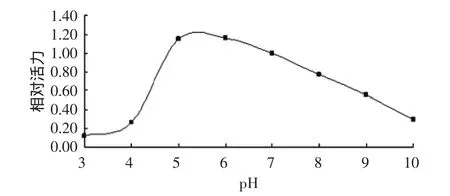
圖7 菠蘿莖蛋白酶最適反應pH
由圖7可知,菠蘿莖蛋白酶的最適反應pH在5~6之間,為弱酸性,這與林文光[13]研究結果一致。當pH小于5,即在較酸性環境下反應速度迅速降低;當pH>6,隨著pH的增大,酶比活逐漸降低,相比酸性環境,在堿性環境中有一個較廣的適應區間。
2.5.2 溫度對菠蘿莖蛋白酶活力的影響 進行了不同溫度下的酶活力實驗,結果如圖8所示。

圖8 菠蘿莖蛋白酶最適反應溫度
由圖8可知,在一定范圍內,隨著溫度的升高,酶的比活逐漸增大,在60℃時達到最大值,即此溫度酶具有最大反應速度,這與趙武玲等[14]和章佩芬[15]報道的菠蘿蛋白酶最適溫度在55~65℃之間的結果大體一致。隨后,當溫度繼續升高,酶的比活逐漸降低,這主要是因為高溫會使酶的蛋白結構受到破壞、變性,以致酶活變小甚至失活。酶在反應中的最適溫度實際上是酶反應速度與酶變性速度綜合影響的結果[16]。在實際應用中,它與反應時間的長短有關,反應時間越長,測得的最適溫度會有所降低。由此可見,菠蘿莖蛋白酶的最適反應溫度約為60℃。
2.5.3 金屬離子對菠蘿莖蛋白酶活力的影響 配制不同種類和濃度金屬離子進行實驗,結果如表3所示。
由表3可知,重金屬離子如Cu2+、Fe2+、Pb2+等對菠蘿莖蛋白酶活抑制較大,且隨著濃度的增大迅速抑制酶活,這與易元龍[17]的研究結果一致;而Na+,K+,Ca2+則表現出不同程度的激活作用,這與P.Kaul,H.A.[18]等研究金屬離子對木瓜蛋白酶的影響所得結果相一致。重金屬離子對菠蘿莖蛋白酶酶活基本表現出一種抑制作用,這主要由于菠蘿蛋白酶是一種巰基蛋白酶,極易發生氧化反應,而多數金屬離子又是氧化反應的催化劑,或直接與巰基有螯合作用,從而使酶活降低。因此,在生產應用過程中應盡量避免與金屬離子接觸。

表3 金屬離子對菠蘿莖蛋白酶酶活的抑制率(%)
3 結論
研究中采用微濾除雜、超濾濃縮和硫酸銨沉淀等方法組合分離純化菠蘿蛋白酶,采用超濾方式進行濃縮,一方面可以減少酶液的體積、硫酸銨的用量,同時降低了其對產品純度的影響;另一方面,超濾也可達到一定純化酶的效果,除去原液中一些分子量比目標酶小的分子。超濾濃縮法屬物理分離手段,低溫無相變,不易對酶活力產生影響。綜合考慮產品質量和生產的實際問題,在工廠生產制備精制酶時,推薦采用超濾濃縮結合90%硫酸銨沉淀的方式對菠蘿莖蛋白酶進行分離提取。
本實驗改良工藝制得的菠蘿蛋白酶酶學性質與有關報道的菠蘿蛋白酶基本一致,最適反應pH在5~6之間,最適溫度60℃,重金屬離子如Cu2+、Fe2+、Pb2+等對菠蘿莖蛋白酶活抑制較大,而Na+、K+、Ca2+則表現出不同程度的激活作用。
若實際生產過程對酶純度要求非常高,特別是醫藥級別所需菠蘿莖蛋白酶純度較高,則需制備純酶。本實驗菠蘿莖蛋白酶經Sephadex G-100柱層析和DEAE-52柱層析后,純化倍數大大提高,分別為原液的1.83倍和1.91倍,電泳實驗證實該酶分子達到電泳純。
[1]舒肇甦,韓廣勇,鄧光仙.我國菠蘿加工與綜合利用現狀[J].保鮮與加工,2006(3):4-7.
[2]李淑喜,黎新明.菠蘿蛋白酶的提取及其在醫藥中的應用[J].廣州化工,2009,37(2):52-53,57.
[3]王平諸,孫君社,李魁.菠蘿蛋白酶三種生產工藝的比較[J].河南化工,2002(7):1-3.
[4]王平諸,楊輝,高孔榮,等.超濾濃縮提取菠蘿蛋白酶的研究[J].食品與發酵工業,1993(5):33-37.
[5]曲延平.高活性菠蘿蛋白酶提取技術取得新突破[J].果蔬加工,2006(4):46.
[6]曹紅.大蒜蒜酶中試生產工藝、酶學性質及質量標準研究[D].烏魯木齊:新疆醫科大學,2008.
[7]丁鳳平,H Noritomi,K Nagahama.超濾技術在堿性果膠酶濃縮工藝中的應用(英文)[J].膜科學與技術,2001(6):53-58.
[8]裴顯慶.用考馬斯亮藍染色方法測定蛋白質含量[J].肉類研究,1990(1):36-37.
[9]施特爾馬赫.酶的測定方法[M].錢嘉淵譯.北京:中國輕工業出版社,1992:24.
[10]丁宵霖,朱雅東,羅磊.聚丙烯酰胺凝膠電泳研究豬血清蛋白硫酸銨分級鹽析[J].食品科學,2006,27(2):218-222.
[11]馬超,宋燁,吳茂玉,等.菠蘿蛋白酶的研究及應用進展[J].食品科技,2008(8):17-20.
[12]高娃.硫酸銨的鹽析作用[J].內蒙古教育學院學報:自然科學版,2000,12(3):45-46.
[13]林文光,鄒建云.菠蘿果皮蛋白酶的活性研究[J].云南熱作科技,1997,20(2):7-11.
[14]趙武玲.果實菠蘿蛋白酶的動力學研究[J].中國農業大學學報.1999,4(1):11-13.
[15]章佩芬,陳敏華,郭利平.菠蘿蛋白酶應用的性質研究[J].廣州食品工業科技,2002,18(2):16-17.
[16]李明春,陳創業,蔡振元.菠蘿蛋白酶的基本性質研究[J].華僑大學學報:自然科學版,1999,13(1):75-80.
[17]易元龍,李媚,謝濤,等.菠蘿果浸提液中菠蘿蛋白酉每的穩定性研究[J].廣西民族大學學報:自然科學版,2008,14(4):76-78.
[18]P Kaul,H A Sathish,V Prakash.Effect of metal ions on structure and activity of papain from Carica papaya[J].Nahrung/Food,2002,46(1):2-6.
Study on improvement of industrial extraction of bromelain and its enzymology characterization
WANG Yan,ZHAO Li-chao,CHEN Jie-lan,LIU Xiao-juan,LIU Xin*
(College of Food Science,South China Agricultural University,Guangzhou 510642,China)
A industrial production process for extraction of bromelain was studied.First,the concentrate of bromelain was enriched from the pineapple stalks by the ways of microfiltration and ultrafiltration.And then,the enzyme extracts were precipitated by the ammonium sulfate precipitation.Last,the bromelain was dehydrated by the vacuum freeze drying.On the basis of these,the high purity of bromelain was produced by the Sephadex G-100 and DEAE-52 ion column chromatography and its characterization was studied.The results showed that after the front process,1.44-fold purified bromelain was achieved,which purity than the old process was 1.19 times.The high purity of bromelain that was produced by the Sephadex G-100 and DEAE-52 ion column chromatography could reach the electrophoresis pure.This purified bromelain can satisfy the demand in medical treatment field,so it had higher market value.And the result of the characterization of this bromelain was consistent with earlier reports.The optimum pH and temperature of the purified enzyme were 5~6 and 60℃.The purified enzyme was inhibition by heavy metal ions such as Cu2+,Fe2+,Pb2+,and activation by the Na+,K+,Ca2+.
bromelain;extraction;purification;enzymology characterization
TS255.1
B
1002-0306(2011)10-0353-05
2010-10-08 * 通訊聯系人
王燕(1987-),女,碩士研究生,研究方向:食品科學。

