成骨細胞胞內胞外堿性磷酸酶含量比較
張英,袁月,孫富麗
(中國醫科大學附屬口腔醫院綜合急診科,沈陽 1 1 0 0 0 2)
堿性磷酸酶(alkaline phosphatase,ALP)廣泛存在于機體各組織器官中,主要是肝、腎、胎盤、小腸和骨。人體血清中ALP主要由肝臟及成骨細胞合成(幾乎各占50%),分別稱為肝源性及骨源性堿性磷酸酶。ALP是成骨細胞所分泌的一種酶蛋白,是成骨細胞分化的特異性標志,是最常見評價成骨細胞分泌功能的指標之一。所以,ALP的檢測結果對成骨細胞的研究有重要意義。目前檢測ALP的實驗方法很多,文獻中常用的方法可概括分為2類:直接取成骨細胞的培養基進行檢測、將成骨細胞破碎后進行檢測。成骨細胞分泌的ALP是細胞內多還是在細胞外多,對實驗方法的選擇及實驗結果都會造成一定影響。本實驗就此問題進行研究。
1 材料與方法
1.1 實驗動物與儀器、試劑
出生24 h的大鼠,雌雄不限,購自中國醫科大學動物實驗中心。主要儀器:超凈工作臺,培養箱,相差顯微鏡,低溫離心機。主要試劑:DMEM培養基(GIBCO公司,美國),胎牛血清(sigma公司),HEPES(AM-RESCO 公司,美國),青/鏈霉素、Ⅰ型膠原酶(Sigma公司,美國),胰蛋白酶(GIBCO公司,美國),ALP染色試劑盒(碧云天公司),Ⅰ型膠原免疫熒光染色試劑盒(abcam公司,美國),ALP含量測定試劑盒(昊柏公司)。
1.2 成骨細胞的分離、接種與傳代
采用酶交替消化法對成骨細胞進行分離[1]。將4只大鼠胎鼠浸泡于75%乙醇中5 min,取出后放入培養皿中,剝出顱骨,放入有雙抗的PBS液中浸泡。移入超凈臺內,用PBS將取下的顱骨沖洗3次。加入0.25%的胰酶,重復3次加入2 mL(1 mg/mL)的Ⅰ型膠原酶交替消化;收集消化液,加入4 mL高糖培養基終止消化。低溫離心機1 000 r/min離心10 min,棄去上清;將沉淀移入培養瓶中,加入5 mL10%高糖培養基;放入37℃5%CO2培養箱中培養1 h后,將培養瓶翻轉過來。以后每3 d換1次培養液,每5~7 d傳代1次。
1.3 成骨細胞鑒定
1.3.1 相差顯微鏡下觀察細胞形態
1.3.2 ALP染色:將培養第4代的成骨細胞在蓋玻片上爬片,多聚甲醛固定30 min。0.01 mol/L PBS洗3次,每次5 min。用碧云天ALP染色試劑盒染色,避光孵育24 h。
1.3.3 Ⅰ型膠原免疫熒光染色:用4%多聚甲醛固定30 min,應用abcam試劑盒染色,避光在熒光顯微鏡下觀察。
1.3.4 茜素紅染色:培養皿用PBS沖洗2次,95%乙醇固定10 min,雙蒸水沖洗3次。0.1%茜素紅-Tris-Hcl(pH 8.3)37℃,30 min。
1.3.5 ALP 含量測定:(1) 將傳代后 1 d、2 d、3 d 的細胞分別設定為第1,2,3組,每組各取5瓶,將每瓶的培養液取出設為對照組;將相同培養瓶瓶底的細胞消化下來,使用超聲波細胞粉碎機將細胞粉碎,設為實驗組。(2)將1 mL反應液R1加到比色杯中,37℃孵育3 min后加入20 μL待測樣品,攪勻并保溫30 s。(3)加入 250 μL 反應液 R2到比色杯中,攪勻并保溫30 s。(4)然后用酶標儀或分光光度計測定405 nm處2 min到10 min內的吸光度變化計算這2個時間點的OD值的差值,計算差值的平均值和標準差。
2 結果
2.1 相差顯微鏡下觀察成骨細胞形態
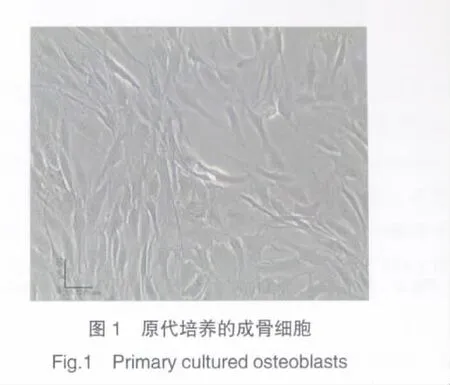
接種前成骨細胞呈體積均一的圓形細胞,接種24 h后,少量細胞開始貼壁生長,顯微鏡觀察貼壁生長細胞為長梭形或有2~3個突起,胞質透亮、飽滿。部分細胞突起為3~4個,體積較前明顯增大,似星形,顯示出較好的貼壁性,部分區域出現重疊生長以及輻射生長的現象。第2代細胞貼壁后增殖加快,形態以不規則形、長梭形、三角形為主,相鄰細胞彼此貼靠,細胞內及表面開始出現分泌物。見圖1。
2.2 ALP染色結果
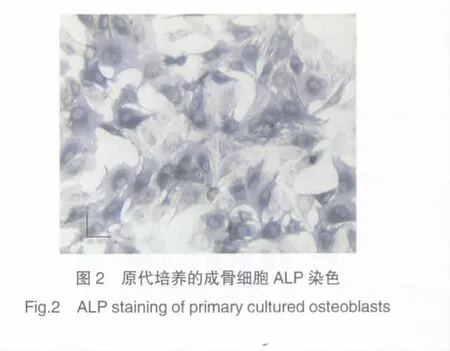
細胞均染色呈梭形、多角形,細胞質染色呈深藍色。見圖2。2.3 Ⅰ型膠原免疫熒光染色
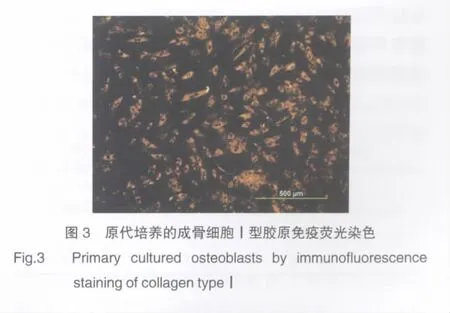
細胞均染色呈梭形、多角形,細胞質染色發出紅光。見圖3。
2.3 茜素紅染色
在顯微鏡下觀察,細胞間分泌的鈣結節被染成紅色。見圖4。

2.4 實驗組和對照組ALP含量比較
實驗結果說明:成骨細胞內分泌的ALP比成骨細胞外分泌的ALP高,差異有統計學意義。
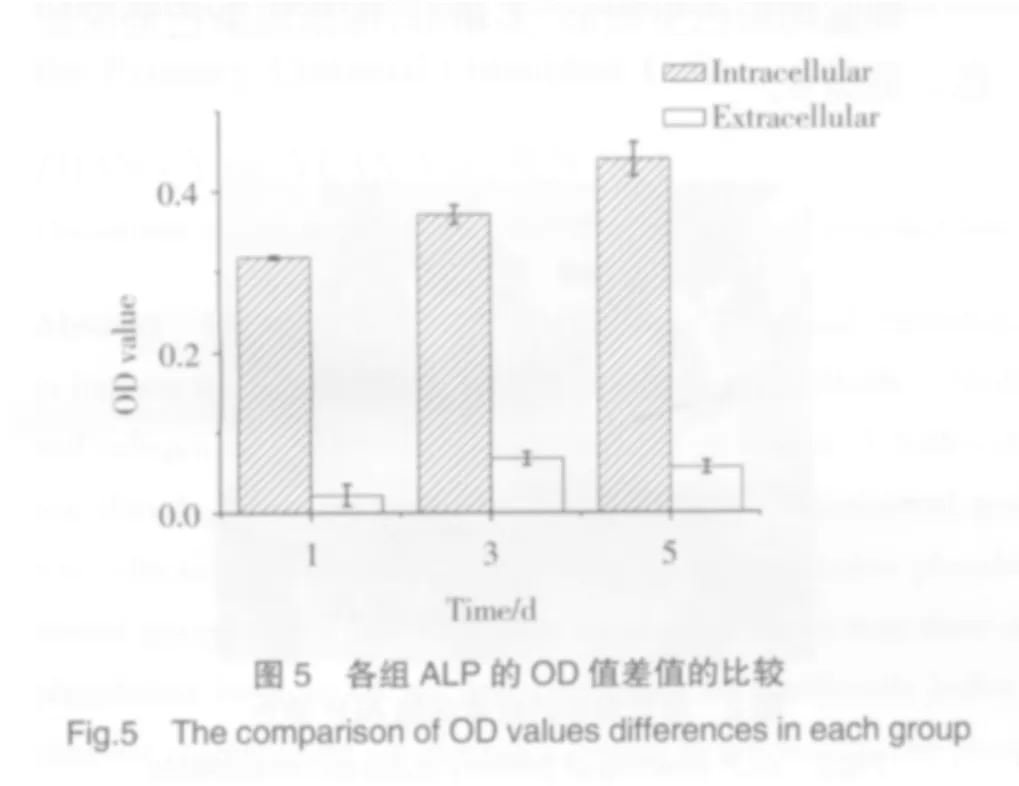
分別對細胞內和細胞外的3組數據進行單因素方差分析,P值結果如下表:從表1可以看出:當第1天與第5天、第3天與第5天進行ALP含量比較時,如果將細胞破碎檢測,結果有統計學意義,直接取培養液進行檢測,結果沒有統計學意義。故直接取培養液進行檢測的方法可能降低了差異大小,最終影響實驗結果的準確性。

表1 3組數據組間差異的分析結果(P)T a b.1 T h e a n a l y s i s r e s u l t s o f 3 d a t a g r o u p s(P)
3 討論
ALP是Suzuki等在1907年首先發現的,生理作用是非特異性水解磷酸單酯鍵,最適pH值為8.6~10.3,因此稱為ALP,臨床上長期用作診斷肝、膽和骨組織疾病的實驗室參數之一[2,3]。ALP主要產生于肝臟、骨和胎盤,也可產生于腎和小腸。有4種同工酶,分別為肝、骨、小腸和胎盤型。ALP廣泛存在機于體各組織器官中,主要是肝、腎、胎盤、小腸和骨。ALP活性是很多細胞如成骨細胞、牙周膜細胞、牙髓細胞等的功能及分化程度的指標。在細胞中表達的多少,反映出細胞的分化程度和功能狀態,因此定量檢測細胞內的ALP活性具有非常重要的意義。ALP是成骨細胞所分泌的一種酶蛋白,活性的高表達是成骨細胞分化的特異性標志[4,5],是最常見評價成骨細胞分泌功能的指標之一。ALP含量可以間接反應成骨細胞的功能,測定血清ALP含量可反映骨代謝活動。
目前,血清中ALP活性的檢測方法已成熟并廣泛應用于臨床。而對體外培養的細胞內ALP活性的檢測卻缺乏統一的標準方法,并且研究較少。目前文獻中關于體外培養細胞內ALP的檢測方法有很多種,可概括分為2類:直接取成骨細胞的培養基進行檢測,將成骨細胞破碎進行檢測。由于各實驗室條件不同,可以將后者分為反復凍融法破碎細胞[6]、使用Triton-X100[7]破碎細胞、使用超聲破碎儀破碎細胞。直接檢測培養基中的ALP這種方法[8],操作簡便,但成骨細胞內分泌的ALP比細胞外分泌的高,故該實驗方法降低了各比較組之間的差異,外低于內從而從側面影響實驗結果的準確性,如表2。Triton-X100是一種非離子型表面活性劑,對細胞起到打孔的作用,實驗方法簡便[9],但有化學試劑的參與將會對酶的活性或試劑的反應造成影響,而影響實驗的準確性。反復凍融的方法檢測ALP,屬于物理的方法,沒有化學試劑的參與,避免了對檢測試劑盒的影響,并且該方法操作相對簡單,但在反復凍融過程中容易對ALP的活性造成影響,從而影響了最終結果;本實驗采用超聲破碎儀破碎細胞,選用物理的方法破碎細胞,在破碎同時使用涼水物理降溫,盡量保存ALP的活性,使實驗更加真實、可靠。
故本實驗通過對成骨細胞內、外分泌ALP的檢測方法進行對比研究。結果證明:成骨細胞細胞內分泌的ALP與細胞外分泌的ALP差異有統計學意義,細胞內分泌的ALP高。在分組時,考慮到細胞在體外生長的周期,即可能的ALP分泌的變化。采用傳代后1 d、2 d、3 d,目的是使結果更加可信。并且,實驗組與對照組來自同一瓶細胞,排除了不同原代培養細胞對實驗結果可能造成的影響。
綜上所述,成骨細胞內分泌的ALP比成骨細胞外分泌的ALP高,差異有統計學意義。因此,建議盡量采用將細胞破碎的方法進行ALP含量的檢測,以提高結果的準確性。
[1]袁月,哈斯達萊,祝海霆,等.胎鼠成骨細胞原代培養方法研究[J].中國實用口腔科雜志,2010,3(10):607-609.
[2]湯新之,崔乃杰.臨床生物化學[M].天津:天津科學技術出版社,1999:107-108.
[3]Sinha P,Kottgen E.Alkaline phosphatase."laboratory and clinical implications[J].J Chromatogr,1988,42(9):419-444.
[4]Farley JR,Stilt-Coflfing B.Apoptosis may delermine the release of skeletal alkaline phosphatase activity from human osteoblast—line cel1[J].Calcif Tissue Int,2001,6868(1):43.
[5]Nguyen H,QiaIl JJ,Bhamagar RS,et al.Enhanced cell attachment and osteoblastic activity by P-15 peptide-coated matrix in hydrogels[J].Biochem Biophys Res Commun,2003,311(1):179.
[6]張學敏,馬文輝,時述山,等.正常人成骨細胞主要生物學特性的研究及意義[J].河北醫藥,2009,31(7):798-800.
[7]吳云剛,張志平.人骨髓基質干細胞體外誘導為成骨細胞的實驗研究[J].江西中醫學院學報,2007,19(1):74-75.
[8]樸成吉,蔣青,陳東陽,等.成人成骨細胞骨髓培養法與組織塊培養法的對比[J].中國組織工程研究與臨床康復,2007,11(23):4566-4569.
[9]陳小菊,王嫣,王蘭,等.誘導骨髓間充質干細胞向成骨細胞分化的實驗研究[J].重慶醫學,2009,38(10):1185-1187.

