海藻酸鹽支架-骨髓間充質干細胞復合物在急性肝衰竭大鼠體內的應用
林繼宗, 胡昆鵬, 陳署賢, 湯照峰, 林 楠, 許瑞云
(中山大學附屬第三醫院肝膽外科,廣東 廣州 510630)
海藻酸鹽支架-骨髓間充質干細胞復合物在急性肝衰竭大鼠體內的應用
林繼宗, 胡昆鵬, 陳署賢, 湯照峰, 林 楠, 許瑞云△
(中山大學附屬第三醫院肝膽外科,廣東 廣州 510630)
目的: 探討海藻酸鹽支架-骨髓間充質干細胞(BMSCs)復合物在急性肝衰竭大鼠體內應用的可能性,為人工肝組織的體內應用提供基礎。方法BMSCs用氯甲基苯甲酰氨熒光染料(CM-DiI)標記后種植于海藻酸鹽支架形成支架細胞復合物。動物分實驗組和對照組,構建70%肝切除大鼠模型,實驗組大鼠給予支架細胞復合物平鋪于肝臟創面上,對照組給予單純支架。4周后取出支架細胞復合物行熒光顯微鏡追蹤觀察;切片行白蛋白及糖原染色追蹤支架上細胞的分化;同時比較兩組大鼠生存率及肝功能變化情況。結果CM-DiI能很好地標記細胞。體內應用后BMSCs能夠在海藻酸鹽支架上分泌白蛋白,合成糖原。實驗組大鼠的生存率及肝功能改善情況優于對照組。結論海藻酸鹽支架-BMSCs復合物在急性肝衰竭大鼠體內能夠起到部分肝功能支持的作用。
海藻酸鹽支架; 骨髓間充質干細胞; 急性肝功能衰竭; 人工肝
目前,對于各種終末期肝臟疾病來說,肝移植是唯一的治療手段,但是由于供肝緊缺和終身的免疫抑制藥物治療大大限制了肝臟移植的應用。在這種情況下,為這些患者尋找另一種治療方法來替代肝臟移植便成為了新的焦點。近年來,肝組織工程的發展為各種終末期肝病的治療帶來了新的思路和希望[1]。肝組織工程即把合適的種子細胞與生物支架材料相結合,在一定的微環境下,經過誘導培養,形成一定量的肝實質細胞和組織,再移植到患者體內以修復或替代肝臟的功能;其最終目標是構建一個完整的、有功能的、可移植的肝臟。尋找合適的種子細胞和生物支架材料是肝組織工程的兩個首要任務。目前組織工程最有希望的種子細胞即骨髓間充質干細胞(bone marrow mesenchymal stem cells, BMSCs),它來源豐富,取材方便,具有多向分化潛能及低免疫源性等特點,而且目前眾多實驗研究表明BMSCs在體內外均能被誘導分化為肝細胞[2-3];而海藻酸鹽支架具有良好的親水特性、疏松多孔的立體結構和優越的組織相容性已經被作為細胞載體在組織工程上廣泛應用。本研究團隊在之前的研究中構建了BMSCs和海藻酸鹽三維支架復合物,并利用此復合物在體外進行人工肝組織的構建研究,研究發現二者有望成為肝組織工程新的種子細胞和細胞載體[4]。
目前,以生物反應器技術為基礎的生物人工肝更多的被應用于體外支持,但是由于技術的限制、高額的花費和護理上的特殊要求使得這項技術難以得到長期應用。因此,利用三維、多孔的生物材料和細胞移植技術為內容的肝臟組織工程在體內實現肝臟功能支持成為一個新的研究焦點[1]。為探討海藻酸鹽支架-BMSCs復合物是否適合體內應用,我們擬通過制作70%肝切除大鼠模型,將此復合物移植到大鼠體內,研究BMSCs的分化及此復合物對大鼠肝臟功能的支持作用,為生物人工肝的體內應用提供實驗基礎和依據。
材 料 和 方 法
1材料
Wistar大鼠購自中山大學動物實驗中心;海藻酸鹽購自Sigma;DMEM/F12 培養液購自Gibco;氯甲基苯甲酰氨熒光染料(chloro- methylbenzamido dialkyl-carbocyanine, CM-DiI)和Hoechst 33258購自Invitrogen;羊抗鼠白蛋白(albumin, ALB)抗體購自Sigma。
2方法
2.1BMSCs的分離、培養 按照文獻[5]介紹的方法分離培養BMSCs。
2.2海藻酸三維支架的制備 用0.1%PBS配制6%的海藻酸水溶液,攪拌均勻,高溫高壓(120 ℃、0.15 MPa)滅菌,4 ℃備用;種入細胞前用α-2MEM稀釋,終濃度為3%。吸取3%的海藻酸鈉水溶液700 μL滴入24孔塑料培養板的孔中,在孔內形成約1 mm厚度的圓盤,再滴入0.1% CaCl22 mL于圓盤上,靜置40 min。待凝膠形成后棄去CaCl2,改用2 mL α-2MEM浸泡,放入4 ℃冰箱,每24 h更換α-2MEM 1次,72 h后用于細胞培養。
2.3用CM-DiI標記BMSCs并種植于海藻酸鹽支架內 將CM-DiI用二甲基亞砜(dimethyl sulfoxide,DMSO)配成1 g/L溶液;選生長良好的3~6代BMSCs約5×106用DPBS(Dulbecco’s phosphate-buffered saline)制成細胞懸液約500 μL,加入CM-DiI液約5 μL,37 ℃孵育10 min,4 ℃冰箱放置20 min,PBS洗3遍后再重懸為50 μL的細胞懸液接種于海藻酸鹽支架內,剩余少量懸液接種于24孔板內觀察標記的情況。
2.4熒光纖維鏡下觀察CM-DiI標記的BMSCs的生長情況 將種植在24孔板內的支架細胞復合物放置于熒光顯微鏡下分別用普通光和波長在540~650 nm范圍內的光觀察。
2.5實驗分組 成年SD大鼠20只,雌雄各半,分為實驗組(A組)和對照組(B組),每組10只。
2.6部分肝切除大鼠模型的建立及海藻酸鹽支架-BMSCs復合物的植入 大鼠用5%水合氯醛以6 mL/kg腹腔內注射,麻醉成功后取腹部正中切口逐層開腹,分離剪斷肝周韌帶,采用絲線近肝門處結扎法依次切除肝左葉、中葉,用絲線切割法切除部分肝右上及右下葉,形成肝臟創面,約切除70%肝臟,創面壓迫止血,建立70%肝切除大鼠模型。將標記了CM-DiI的支架細胞復合物從24孔板內取出,平鋪在實驗組大鼠右肝創面上后關腹;對照組大鼠只單純平鋪海藻酸鹽支架后關腹。術后大鼠注意保溫,室溫維持在25~28 ℃。
3觀察指標
3.1大鼠術后生存率 術后每天觀察大鼠的生存情況并記錄大鼠的死亡時間至術后第4周。
3.2術后肝功能指標的變化 各組大鼠分別于術前、術后第1 d、第14 d從尾靜脈采血,在全自動生化分析儀上檢測大鼠天門冬氨酸氨基轉移酶(aspartate transaminase,AST)、丙氨酸氨基轉移酶(alanine aminotransferase,ALT)和白蛋白(albumin,ALB)。
3.3冰凍切片觀察支架細胞復合物情況 術后的第4周處死實驗組和對照組大鼠并取出支架-細胞復合物,在冰凍切片機內制成厚度約4微米的冰凍切片,置于熒光顯微鏡下觀察,Hoechst 33258染核觀察細胞形態及分布情況。
3.4免疫組化法檢測復合物內BMSCs的分化 4%多聚甲醛固定冰凍切片30 min后,用含0.01% Triton的PBS溶液漂洗3次,滴加3% H2O2溶液作用30 min,PBS溶液漂洗,滴加羊抗鼠ALB溶液,4 ℃孵化過夜,再用DAB顯色,蘇木素復染5 min,自來水沖洗,脫水、透明、常規中性樹膠封片,在普通顯微鏡下觀察。
3.5糖原染色觀察復合物內細胞糖原儲存的功能 另取部分切片,AAF液(5%冰醋酸+15%甲醛+85%無水乙醇)固定15 min,PBS洗3次,每次3 min;5 g/L高碘酸氧化10 min,蒸餾水稍洗,雪夫(Schiff)試劑避光染色20 min,5 g/L焦亞硫酸鈉滴洗3 min× 3次,蒸餾水稍洗,蘇木素復染5 min,流水浸洗,脫水、透明、常規中性樹膠封片,在普通顯微鏡下觀察。
4統計學處理
結 果
1熒光顯微鏡下觀察CM-DiI標記的BMSCs及支架-細胞復合物情況
在波長為540~650 nm范圍內可觀察到平面上的BMSCs呈長梭形,細胞膜全部紅染,熒光分布均勻,細胞核無紅染,核完整;支架上的BMSCs呈紅色的球形結構,團塊性聚集生長,見圖1。

Figure 1. The morphology of BMSCs labeled by CM-DiI (fluorescent microscopy, ×200). A: monolayer cells;B: cells in the alginate scaffold.
2熒光顯微鏡下觀察復合物冰凍切片
手術后第4周于A組大鼠腹腔中取出支架與細胞的復合物,冰凍切片可以看到強烈的紅色熒光沿著支架纖維分布,Hoechst 33258染核后,可以看到細胞黏附于支架纖維上沿著纖維生長,所有的細胞核周圍均有紅色熒光分布,見圖2;而B組切片內未見紅色熒光,Hoechst 33258染色后切片上可見少量藍色熒光。
3免疫組化法檢測復合物內BMSCs的分化
白蛋白免疫組化結果顯示,A組支架上的部分細胞周圍可見棕色顆粒,見圖3A;而B組大鼠支架上可見部分炎性細胞附著,但未見棕色顆粒,見圖3B。

Figure 2. The morphology of alginate scaffolds with BMSCs 4 weeks after transplanted into the rats (fluorescent microscopy, ×200). A: labeled by CM-DiI (red);B: labeled by CM-DiI (red) and Hoechst 33258 (blue).

Figure 3. The synthesis of albumin by the cells in alginate scaffolds (immunohistochemical staining, ×200). A: the liver of an acute hepatic failure rat transplanted with alginate scaffold and BMSCs; B: the liver of an acute hepatic failure rat transplanted with alginate scaffold alone.
4糖原染色檢測復合物內細胞儲存糖原的功能
糖原染色結果顯示,A組支架上的部分細胞胞漿紅染,見圖4A,已具備儲存糖原功能;而B組大鼠支架上可見部分炎性細胞附著,但未見胞漿紅染的細胞,見圖4B。

Figure 4. The synthesis of glycogen by the cells in alginate scaffolds (periodic acid-Schiff staining, ×400).A: the liver of an acute hepatic failure rat transplanted with alginate scaffold and BMSCs; B: the liver of an acute hepatic failure rat transplanted with alginate scaffold alone.

Figure 5. The cumulative survival rate of the two groups of rats. The rate of group A was higher than that of group B (n=10,Plt;0.05). A: the acute hepatic failure rats transplanted with alginate scaffold and BMSCs; B: the acute hepatic failure rats transplanted with alginate scaffold alone.
5大鼠生存率比較
實驗結束后A組大鼠共死亡2只,存活率為80%;B組死亡5只,存活率為50%。經log-rank檢驗發現,A組存活率高于B組(Plt;0.05)。
6大鼠肝功能指標比較
術前A和B組大鼠各項肝功能指標檢查均無顯著差異(Pgt;0.05), 表明實驗前兩組大鼠肝功能狀態基本一致。術后第1 d,兩組大鼠各項肝功能指標檢查也無顯著差異(Pgt;0.05)。術后第14 d,A組大鼠和B組大鼠ALT之間的差異有統計學意義(Plt;0.05),見表1。
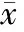
表1 各組大鼠肝功能指標的比較
討 論
急性肝衰竭、肝硬化、肝癌等肝臟疾病目前仍是醫學工作者面臨的難題,死亡率非常高。隨著20世紀90年代組織工程學概念的提出和不斷發展,肝組織工程成為終末期肝病治療的研究熱點并取得顯著進展。研發可供體內應用的人工肝臟是肝臟組織工程研究的焦點[6]。
肝組織工程研究的首要任務就是選擇可靠的細胞來源,并能提供足夠的細胞數量。BMSCs由于本身所具有的可塑性,在體外經特定誘導條件下可分化肝細胞,在肝臟組織的修復過程中,BMSCs又是肝細胞的重要肝外來源,可分化成肝干細胞及肝細胞,從而參與肝功能的修復和重構,使得BMSCs成為肝臟組織工程最有希望的種子細胞。至于材料的選擇方面,天然基質材料具有良好的細胞相容性和親和性,被廣泛應用于組織工程的細胞載體[7]。海藻酸是從褐藻中提取的一種酸性多糖, 由古洛糖醛酸與甘露糖醛酸組成的嵌段聚合物, 可與二價金屬離子絡合形成網狀開放晶格的水凝膠,其酶解產物對人體無毒害作用,而且該水凝膠具有很好的親水性, 營養物質易于滲透擴散[8]。在我們前期的研究工作中發現海藻酸支架有非常適合BMSCs生長的特性,BMSCs在海藻酸支架上能夠很好地黏附和擴增,在HGF和其它生長因子的作用下,BMSCs能夠被誘導向肝細胞方向分化,表現出肝細胞的特性,研究結果表明BMSCs有望成為肝組織工程新的種子細胞和細胞載體。
目前,利用BMSCs的特性來治療肝功能不全的研究大多都只局限于單純利用細胞移植技術,如門靜脈注射、脾臟注射、腹腔內或肝內注射等[9],將BMSCs移植到肝功能不全的動物模型體內后能改善動物的肝功能。但是,當注射較大細胞量時,單純的細胞移植也存在如門靜脈血栓形成、肺動脈或肝內血管栓塞、脾破裂等諸多不足[9]。本研究則結合三維多孔支架和細胞移植技術為核心技術,在體內實現肝臟功能支持。與單純的細胞移植相比,三維支架能夠為大劑量細胞提供足夠的空間;同時通過對支架成分和形態的優化能夠提高細胞移植效率。
70%肝切除的大鼠肝臟會分泌大量的肝源性細胞因子,如轉化生長因子α(TGF-α)、表皮生長因子(EGF)、肝細胞生長因子(HGF)等,這些因子在肝細胞再生過程中起著重要的作用[10]。這些因子在肝內的富集同時也為BMSCs向肝細胞分化提供了優越的體內環境。一旦BMSCs來到受損的肝臟內,局部微環境就可以激活使BMSCs表型改變的基因,轉化為有功能的肝細胞,參與肝臟再生,促進損傷肝臟修復[11]。肝功能不全大鼠體內的微環境能夠誘導BMSCs在支架材料上向肝細胞分化并在體內實現肝臟功能的支持,這是BMSCs源性人工肝組織體內應用的依據。我們的實驗結果顯示,支架上的BMSCs在肝功能不全大鼠體內同樣能夠分泌白蛋白并合成糖原,初步具有肝細胞的功能;同時實驗組大鼠的生存率和肝功能改善均優于對照組。此部分結果同樣證明BMSCs在體內可以分化為肝細胞,BMSCs源性的人工組織在體內能夠改善肝功能不全大鼠的肝功能。構建適合體內應用的人工肝組織是肝組織工程的研究熱點,我們的研究為BMSCs源性人工肝組織在體內的進一步應用提供了基礎和依據。
通過對移植到體內的支架細胞復合物的免疫組化檢測,我們發現手術后4周實驗組海藻酸支架上部分細胞有白蛋白抗體的表達,糖原染色也發現部分細胞具有合成糖原的能力;而對照組海藻酸支架上雖然有部分細胞附著,但所有細胞均無白蛋白表達和糖原的合成。合成白蛋白和糖原儲存這兩項功能正是肝細胞所特有的,這說明在這2種大鼠模型內,種植在海藻酸支架上的BMSCs可以向肝細胞方向分化。我們通過對實驗組和對照組大鼠存活率和術后肝功能指標的比較發現,實驗組大鼠在存活率上高于對照組(Plt;0.05)。在肝功能指標上可以看到,在術后的第14 d,70%的肝切除實驗組大鼠血清ALT的恢復情況也優于對照組。這說明,海藻酸支架-BMSCs復合物移植于肝衰竭大鼠體內后,支架上的BMSCs不僅能夠分化為肝細胞,而且此復合物在體內還能夠改善肝功能不全大鼠的肝功能。但在術后第14 d,兩組大鼠的血清AST和ALB沒有明顯差異,這可能與幾個因素有關。第一,我們移植的細胞數或者在第14 d已經轉化為有部分肝細胞功能的BMSCs不夠,而不能對肝衰竭大鼠的肝臟功能起更大的支持作用。第二,本實驗中采用的細胞支架未進行預血管化,我們知道,要盡可能發揮移植物的作用,促進移植物與受體之間的血管聯系是非常重要的。本實驗中,海藻酸鹽支架-BMSCs復合物在肝衰竭大鼠體內還未能夠全面改善大鼠的肝臟功能,可能與移植物還未完全與受體形成豐富的血管網,直接影響其功能的發揮。這些不足同時也給我們下一階段的研究提供思路和方向。
體內研究BMSCs的分化,穩定持久的標記是最基本的要求。本研究以CM-DiI為材料標記BMSCs。CM-DiI是親脂性熒光染料,易嵌入生物質膜內并在膜內作側向運動,從而標記整個細胞。CM-DiI無細胞毒性,對標記細胞的存活、生長無影響,在標記細胞內消失慢[12]。本研究也發現在體外CM-DiI標記后的細胞熒光不容易淬滅,標記了CM-DiI的細胞仍能在海藻酸支架上良好地生長和擴增,對細胞無毒性作用;而在體內,4周后我們仍然能夠發現支架上有穩定的強烈的熒光,熒光沿著支架纖維分布,這說明CM-DiI可以作為細胞體內示蹤的穩定的染料。
我們把已標記了CM-DiI的大鼠BMSCs種植于海藻酸三維支架上,并將此復合物移植到70%肝切除的大鼠體內,證實支架上的BMSCs可以向肝細胞分化。目前,要使這一復合物在體內能更好地起到人工肝的作用還有很多問題要解決,包括如何實現此復合物管道化、如何使這些被誘導分化的細胞更具有肝細胞的功能等。這將為干細胞的體內追蹤和構建可供體內移植的肝臟組織工程提供一定的實驗基礎和依據。
[1]Fiegel HC, Kaufmann PM, Bruns H, et al. Hepatic tissue engineering: from transplantation to customized cell-based liver directed therapies from the laboratory [J]. J Cell Mol Med, 2008, 12(1):56-66.
[2]Ong SY, Dai H, Leong KW. Inducing hepatic differentiation of human mesenchymal stem cells in pellet culture[J]. Biomaterials, 2006, 27(22):4087-4097.
[3]劉 芳,陳少紅,劉青波,等.黃嘌呤核苷促進骨髓間質干細胞體外快速擴增的實驗研究[J].中國病理生理雜志,2010,26(12):2389-2393.
[4]Lin N, Lin J, Bo L, et al. Differentiation of bone marrow-derived mesenchymal stem cells into hepatocyte-like cells in an alginate scaffold[J]. Cell Prolif, 2010, 43(5):427-434.
[5]林繼宗, 湯照峰, 方和平, 等. 以海藻酸三維支架構建骨髓間充質干細胞源性生物人工肝組織的實驗研究[J]. 中華普通外科雜志, 2009, 24(3): 234-237.
[6]Kulig KM, Vacanti JP. Hepatic tissue engineering[J]. Transpl Immunol, 2004, 12(3-4):303-310.
[7]李 羽, 徐 哲, 張 巖, 等. 生物人工肝中肝細胞材料的研究及應用現狀[J]. 醫學研究生學報, 2004, 17(10): 932-935.
[8]Drury JL, Boontheekul T, Mooney DJ. Cellular cross-linking of peptide modified hydrogels[J]. J Biomech Eng, 2005, 127(2):220-228.
[9]王連友, 徐 輝, 董世武, 等. 骨髓間充質干細胞在小鼠肝臟局部分化為肝細胞的實驗研究[J]. 胃腸病學和肝病學雜志, 2008, 17(1): 27-29.
[10]Deakin JA, Blaum BS, Gallagher JT, et al. The binding properties of minimal oligosaccharides reveal a common heparan sulfate/dermatan sulfate-binding site in hepatocyte growth factor/scatter factor that can accommodate a wide variety of sulfation patterns[J]. J Biol Chem, 2009, 284(10):6311-6321.
[11]譚浩翔, 高 毅, 陳建鋒. 人骨髓間充質干細胞移植在大鼠肝再生衰竭中的作用[J]. 中華肝臟病雜志, 2007, 15(6):473-474.
[12]Weir C, Morel-Kopp MC, Gill A, et al. Mesenchymal stem cells: isolation, characterisation andinvivofluorescent dye tracking[J]. Heart Lung Circ, 2008, 17(5):395-403.
Invivouseofalginatescaffoldwithbonemarrowmesenchymalstemcellsinacutehepaticfailurerats
LIN Ji-zong, HU Kun-peng, CHEN Shu-xian, TANG Zhao-feng, LIN Nan, XU Rui-yun
(DepartmentofHepatobiliarySurgery,TheThirdAffiliatedHospital,SunYat-senUniversity,Guangzhou510630,China.E-mail:xuruiyun@yahoo.com.cn)
AIM: To evaluate the use of alginate scaffold with bone marrow mesenchymal stem cells (BMSCs) in a rat acute hepatic failure model.METHODSBMSCs were labeled with chloro- methylbenzamido dialkylcarbocyanine (CM-DiI), cultured in alginate scaffold and transplanted into the liver of acute hepatic failure rats with 70% liver resection. Four weeks later, the scaffold-cell complexes were taken out, and their abilities to secret albumin (ALB) and store glycogen were examined. The survival rate and liver functions of the rats were also examined.RESULTSCM-DiI was an effective cell tracer. The BMSCs in alginate scaffold secreted ALB and stored glycogen in acute hepatic failure rats. The survival rate and liver functions of the rats treated with scaffold-cell complexes were better than those of the rats treated with alginate alone.CONCLUSIONAlginate scaffold with BMSCs can be used as artificial hepatic tissues in acute hepatic failure rats.
Alginate scaffold; Bone marrow mesenchymal stem cells; Acute hepatic failure; Artificial liver
1000-4718(2011)12-2382-05
R318
A
10.3969/j.issn.1000-4718.2011.12.027
2011-08-14
2011-10-20
△通訊作者 Tel: 020-85253178; E-mail: xuruiyun@yahoo.com.cn

