三種氨基酸添加下酶法修飾酪蛋白水解物的ACE抑制活性*
汪敬科,趙新淮
(東北農(nóng)業(yè)大學(xué)乳品科學(xué)教育部重點(diǎn)實(shí)驗(yàn)室,黑龍江哈爾濱,150030)
三種氨基酸添加下酶法修飾酪蛋白水解物的ACE抑制活性*
汪敬科,趙新淮
(東北農(nóng)業(yè)大學(xué)乳品科學(xué)教育部重點(diǎn)實(shí)驗(yàn)室,黑龍江哈爾濱,150030)
采用堿性蛋白酶水解酪蛋白,制備水解度為12.4%、IC50為42.19 μg/mL的酪蛋白水解物。在添加外源氨基酸的情況下對(duì)水解物進(jìn)行類(lèi)蛋白反應(yīng)修飾,并響應(yīng)面法研究氨基酸添加量、酶添加量、反應(yīng)溫度及3種氨基酸的影響。結(jié)果表明:氨基酸添加量、反應(yīng)溫度、氨基酸種類(lèi)對(duì)修飾反應(yīng)影響顯著,而酶添加量的影響不大;分別添加苯丙氨酸、亮氨酸、纈氨酸制備3個(gè)酪蛋白水解物修飾產(chǎn)物,其IC50降低至21.03~25.13 μg/mL,表明添加外源氨基酸可提高修飾產(chǎn)物的體外ACE抑制活性,但添加不同氨基酸的影響不顯著。
酪蛋白水解物,類(lèi)蛋白反應(yīng),氨基酸,ACE抑制活性,響應(yīng)面
高血壓被稱(chēng)為“無(wú)聲殺手”,在早期沒(méi)有明顯的癥狀,直到發(fā)生臨床危象——心肌梗塞、腦血管破裂等疾病。血管緊張素I轉(zhuǎn)換酶(angiotensin-I-converting enzyme,ACE)在人體血壓調(diào)控中起重要作用[1]。乳源ACE抑制劑以無(wú)副作用、安全性高而具有研究?jī)r(jià)值[2-4]。為獲得高活性的 ACE抑制肽,已對(duì)各種影響因素進(jìn)行廣泛研究,其中以水解條件的優(yōu)化和ACE抑制肽的分離、純化為熱點(diǎn)[5]。
類(lèi)蛋白反應(yīng)是指在一定條件下,通過(guò)酶的催化使?jié)饪s后的蛋白水解物形成一種粘稠狀物質(zhì)。類(lèi)蛋白反應(yīng)通常需要兩步酶過(guò)程,第一步反應(yīng)是在適宜條件下,通過(guò)酶對(duì)蛋白質(zhì)進(jìn)行限制性水解,得到肽;第二步反應(yīng)是將濃縮后的水解物作為底物,或加入氨基酸衍生物,或加入其它不同來(lái)源的蛋白質(zhì)水解物,在適宜條件下,通過(guò)酶的催化生成觸變膠體或粘稠狀的液體[6]。已有研究表明,類(lèi)蛋白反應(yīng)修飾的酪蛋白水解物其ACE抑制活性得到顯著提高[7-8]。因此,本研究利用堿性蛋白酶水解酪蛋白制備酪蛋白水解物,再在添加3種外源氨基酸下利用堿性蛋白酶催化類(lèi)蛋白反應(yīng)對(duì)水解物進(jìn)行修飾,響應(yīng)面法研究反應(yīng)條件對(duì)修飾反應(yīng)的影響,并考察修飾反應(yīng)對(duì)產(chǎn)物的ACE抑制活性的影響。
1 材料與設(shè)備
1.1 主要材料
酪蛋白(蛋白質(zhì)含量86.1%),北京奧博星生物技術(shù)有限公司;堿性蛋白酶,諾維信生物技術(shù)有限公司;兔肺丙酮粉,Sigma公司;FAPGG(FA-Phe-Gly-Gly,Sigma公司;L-亮氨酸甲酯鹽酸鹽、L-苯丙氨酸甲酯鹽酸鹽、L-纈氨酸甲酯鹽酸鹽,上海晶純?cè)噭┯邢薰?其他所有試劑均為分析純,水為蒸餾水或超純水。
1.2 主要設(shè)備
UV-2401PC型紫外可見(jiàn)分光光度計(jì),日本島津公司;AL204型分析天平,梅特勒-托利多儀器中國(guó)有限公司;Kjeltec TM2300型自動(dòng)凱氏定氮儀,瑞士Foss公司;LGJ-1型真空冷凍干燥機(jī),上海醫(yī)用分析儀器廠;HZQ-F160型全溫振蕩培養(yǎng)箱,哈爾濱東聯(lián)電子技術(shù)開(kāi)發(fā)有限公司;DELTA 320型精密pH計(jì),梅特勒-托利多中國(guó)有限公司;QT-1型微型漩渦混合器,上海琦特分析儀器有限公司;YH-4BS型遠(yuǎn)紅外恒溫干燥箱,天津市中環(huán)實(shí)驗(yàn)電爐有限公司;DK-98-1型電熱恒溫水浴鍋,天津市泰斯特儀器有限公司。
2 試驗(yàn)方法
2.1 酪蛋白水解物的制備
配制質(zhì)量濃度為10%的酪蛋白溶液,用2 mol/L的NaOH調(diào)節(jié)pH至8.5,加入堿性蛋白酶并于55℃下進(jìn)行水解,酶添加量為1 kU/g蛋白質(zhì)。分別于0、1、2、3、4、5、6、7、8 h 取出 15 mL 樣品溶液,迅速置于沸水浴中滅酶15 min。樣品溶液冷卻至室溫后5 000 r/min離心20 min,分離出上清液。測(cè)定上清液中蛋白質(zhì)含量和游離氨基含量,計(jì)算其水解度,同時(shí)測(cè)定上清液的ACE抑制活性。通過(guò)以上分析,確定酪蛋白水解物的適宜制備條件后進(jìn)行放大實(shí)驗(yàn),得到的上清液在真空冷凍干燥后于-20℃保藏。
2.2 酪蛋白水解物的類(lèi)蛋白反應(yīng)修飾
采用中心組合實(shí)驗(yàn),固定底物濃度為35%(w/w),通過(guò)測(cè)定反應(yīng)體系的游離氨基含量變化(修飾產(chǎn)物的游離氨基含量減去反應(yīng)底物的游離氨基含量),考察氨基酸添加量(添加的氨基酸摩爾數(shù)/酪蛋白水解物游離氨基摩爾數(shù),mol/mol)、酶添加量(kU/g蛋白質(zhì))、反應(yīng)溫度對(duì)反應(yīng)的影響,以選擇適宜的修飾反應(yīng)條件。采用三因素五水平響應(yīng)面方法分析,其因素水平編碼見(jiàn)表1。

表1 響應(yīng)面分析的因素水平編碼表
2.3 相關(guān)分析
2.3.1 蛋白質(zhì)含量、水解度及蛋白酶活力的測(cè)定
(1)蛋白質(zhì)含量測(cè)定:凱氏定氮法[9]。
(2)游離氨基含量及酪蛋白水解度(DH)測(cè)定:鄰苯二甲醛(OPA)法[10-11]。
游離氨基含量測(cè)定:將亮氨酸配制成不同濃度的標(biāo)準(zhǔn)溶液(0、6、12、18、24、30、36 μg/mL),取 3 mL 標(biāo)準(zhǔn)溶液與同體積的OPA試劑混合并開(kāi)始計(jì)時(shí),5 min后在分光光度計(jì)上340 nm波長(zhǎng)下測(cè)定。以吸光值為橫坐標(biāo)、亮氨酸濃度為縱坐標(biāo)繪制標(biāo)準(zhǔn)曲線。按照標(biāo)準(zhǔn)曲線制作步驟,測(cè)定樣品的吸光值,并根據(jù)標(biāo)準(zhǔn)曲線回歸方程計(jì)算其游離氨基含量。
水解度計(jì)算公式[12]如下:

其中,水解物游離氨基含量單位為μmol/mL;水解物氮含量單位為mg/mL;0.59 mmol/g為測(cè)定出的酪蛋白的游離氨基含量。
(3)蛋白酶活力測(cè)定:福林酚法[13]。
2.3.2 ACE抑制活性的測(cè)定
以FAPGG為底物,采用非連續(xù)分光光度法測(cè)定樣品的 ACE 抑制活性[14-15]。
ACE酶液:稱(chēng)取50mg兔肺丙酮粉浸泡于5 mL預(yù)冷至4℃的硼酸緩沖溶液(pH8.3,100 mmol/L)中,懸液放入4℃恒溫振蕩搖床中提取12 h,20 000 r/min冷凍離心20 min,上清液于4℃低溫保存。
FAPGG底物溶液:將FAPGG溶于100 mmol/L的硼酸緩沖溶液(pH 8.3,含300 mmol/L的NaCl),配制成1.6 mmol/L的溶液。
ACE抑制活性測(cè)定:500 μL FAPGG底物溶液與100 μL超純水或抑制劑(ACE抑制肽或卡托普利)混勻,37℃預(yù)熱2 min,加300 μL ACE 酶液并在37℃反應(yīng)30 min,立即加100 μL EDTA(100 mmol/L)終止反應(yīng);加3 000 μL超純水稀釋?zhuān)叫?次。0 min樣品的測(cè)定,要先加入EDTA再加入ACE酶液,其他相同。采用分光光度計(jì),在340 nm處分別測(cè)體系在0 min和30 min時(shí)的吸光值,計(jì)算差值ΔA(ΔA=A0min-A30min)。以單位時(shí)間內(nèi)吸光值變化表示ACE酶活力,抑制劑對(duì)ACE酶的抑制程度計(jì)算:
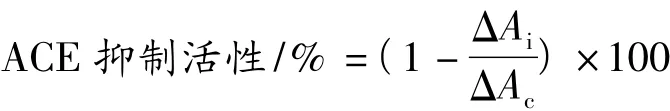
式中:ΔAc-加入超純水時(shí)吸光值在30 min內(nèi)的變化;ΔAi-加入抑制劑時(shí)吸光值在30 min內(nèi)的變化。
IC50定義為:抑制50%ACE酶活力時(shí)抑制劑的濃度。配置不同濃度的ACE抑制劑(nmol/L或mg/mL),測(cè)定其ACE抑制活性。以抑制劑濃度的對(duì)數(shù)(log)為橫坐標(biāo)、ACE抑制活性(%)為縱坐標(biāo),進(jìn)行回歸分析;利用回歸方程計(jì)算抑制劑的半抑制濃度(IC50)。
2.3.3 統(tǒng)計(jì)分析
采用SPSS 13.0軟件對(duì)結(jié)果進(jìn)行統(tǒng)計(jì)、分析,采用Excel 2003軟件繪制圖示。
3 結(jié)果與討論
3.1 酪蛋白水解物的制備
對(duì)ACE抑制肽進(jìn)行研究發(fā)現(xiàn),其活性主要取決于C端氨基酸。C端為芳香族氨基酸(包括色氨酸、酪氨酸、苯丙氨酸)和脯氨酸時(shí)抑制活性較高;N端為疏水性的纈氨酸、亮氨酸、異亮氨酸的肽,與ACE的親和能力較強(qiáng),抑制活性較高,但脯氨酸除外。一些學(xué)者已成功地從牛乳蛋白中酶解得到 ACE抑制肽[16-17],所以本研究用堿性蛋白酶水解酪蛋白。酪蛋白水解物的水解度及相應(yīng)ACE抑制活性的變化如圖1。
酪蛋白水解物的ACE抑制活性隨著水解度的提高而迅速增大,其后ACE抑制活性幾乎不變或略有降低,此結(jié)果與Robert[18]等人的研究結(jié)果相似,表明小分子肽具有更高的ACE抑制活性。水解6 h,酪蛋白水解物的水解度為12.4%,ACE抑制活性為最高,其IC50為42.19 μg/mL。所以,選擇此酪蛋白水解物為下一步類(lèi)蛋白反應(yīng)修飾的底物。
3.2 ACE抑制肽的修飾條件優(yōu)化
3.2.1 添加亮氨酸時(shí)反應(yīng)條件的影響
研究表明,類(lèi)蛋白反應(yīng)修飾時(shí)底物濃度過(guò)大時(shí)體系的黏度太大而不利于反應(yīng),濃度過(guò)低則導(dǎo)致發(fā)生水解反應(yīng)[7-8,10]。因此,確定適宜的底物濃度為 35%(w/w),確定適宜的反應(yīng)時(shí)間為6 h。
按照中心組合試驗(yàn)設(shè)計(jì)要求進(jìn)行20組試驗(yàn),研究添加亮氨酸時(shí)適宜的反應(yīng)條件,通過(guò)回歸方程所作的響應(yīng)面曲面圖如圖2~圖4所示。
亮氨酸添加量和酶添加量對(duì)反應(yīng)體系中游離氨基的影響如圖2,二者之間的交互作用對(duì)游離氨基含量變化影響較大(P<0.05)。當(dāng)酶添加量一定時(shí),所選亮氨酸添加量范圍內(nèi)反應(yīng)體系中游離氨基減少量隨亮氨酸添加量的增加而增加,酶添加量較低時(shí)這種現(xiàn)象更加明顯。不過(guò),酶添加量的影響較小。

圖1 不同水解時(shí)間下酪蛋白水解產(chǎn)物水解度和ACE抑制活性。
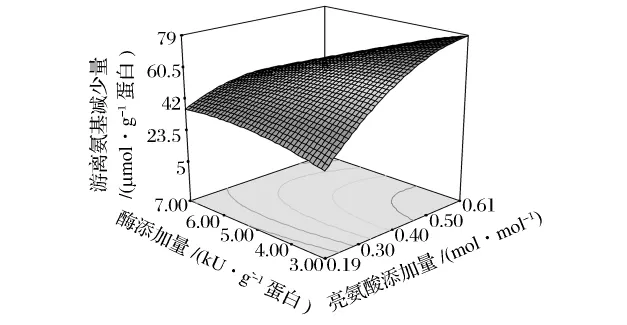
圖2 酶添加量和亮氨酸添加量對(duì)類(lèi)蛋白反應(yīng)體系中游離氨基含量變化的響應(yīng)面(X3=30)
亮氨酸添加量和反應(yīng)溫度對(duì)反應(yīng)體系游離氨基減少量的影響如圖3。二者之間的交互作用也較大(P<0.05),隨著反應(yīng)溫度的降低、亮氨酸添加量的增加,反應(yīng)體系中游離氨基減少量逐漸增加。
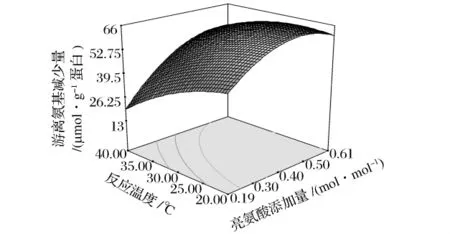
圖3 反應(yīng)溫度和亮氨酸添加量對(duì)類(lèi)蛋白反應(yīng)體系中游離氨基含量變化的響應(yīng)面(X2=5)
反應(yīng)溫度和酶添加量對(duì)反應(yīng)體系游離氨基減少量的影響如圖4。二者之間的交互作用較小(P>0.05)。在反應(yīng)溫度一定時(shí),反應(yīng)體系游離氨基含量變化隨酶添加量的降低而增加;在酶添加量一定時(shí),反應(yīng)體系游離氨基含量變化隨反應(yīng)溫度的降低而增加。
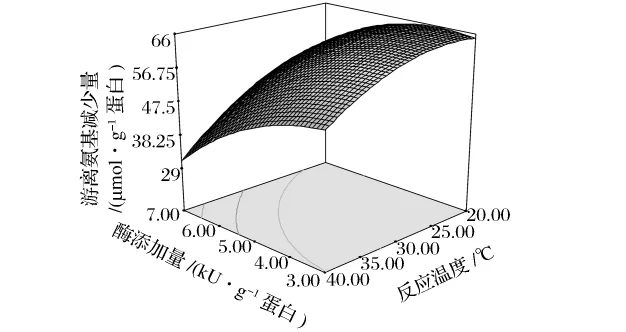
圖4 酶添加量和反應(yīng)溫度對(duì)類(lèi)蛋白反應(yīng)體系中游離氨基含量變化的響應(yīng)面(X1=0.4)
3.2.2 添加其他2種外源氨基酸時(shí)的適宜反應(yīng)條件
在分別添加苯丙氨酸、纈氨酸后,同樣研究反應(yīng)條件對(duì)酪蛋白水解物類(lèi)蛋白反應(yīng)的影響,發(fā)現(xiàn)所得到研究結(jié)果是相似的,各反應(yīng)條件均對(duì)修飾反應(yīng)有一定的影響,只是游離氨基含量的變化程度不同。這里不再給出具體數(shù)據(jù)。
綜合分析所有實(shí)驗(yàn)結(jié)果,得到在3種外源性氨基酸添加下酪蛋白水解物類(lèi)蛋白反應(yīng)的適宜條件為:氨基酸添加量為0.6 mol/mol,酶添加量為3 kU/g蛋白,反應(yīng)溫度為40℃。
3.3 修飾后酪蛋白水解物的ACE抑制活性
在底物濃度為35%(w/w)、酶添加量為3kU/g蛋白質(zhì)、反應(yīng)溫度40℃、反應(yīng)時(shí)間6 h、氨基酸添加量為0.6 mol/mol的條件下,制備分別添加了亮氨酸、苯丙氨酸和纈氨酸的修飾酪蛋白水解物,其ACE抑制活性測(cè)定結(jié)果列于表2。
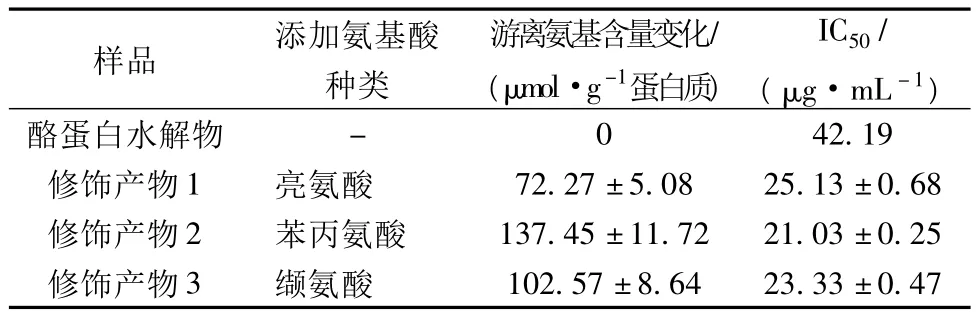
表2 酪蛋白水解物類(lèi)蛋白反應(yīng)修飾后的ACE抑制活性
結(jié)果表明,當(dāng)堿性蛋白酶催化酪蛋白水解物進(jìn)行類(lèi)蛋白反應(yīng)修飾后,所添加的氨基酸種類(lèi)不同,反應(yīng)體系中游離氨基減少量顯著不同。更為重要的是,相比原先酪蛋白水解物的IC50(42.19 μg/mL),修飾產(chǎn)物的IC50數(shù)值變得更小、ACE抑制活性顯著提高(增幅接近1倍)。不過(guò),3個(gè)修飾產(chǎn)物之間的ACE抑制活性是基本相同的。這一結(jié)果說(shuō)明,在外源性氨基酸添加下利用堿性蛋白酶催化酪蛋白水解物進(jìn)行類(lèi)蛋白反應(yīng)修飾時(shí),修飾產(chǎn)物的ACE抑制活性與氨基酸種類(lèi)的關(guān)系不大。有關(guān)外源性氨基酸對(duì)酪蛋白修飾產(chǎn)物的ACE抑制活性影響,還需進(jìn)一步研究。
4 結(jié)論
(1)利用堿性蛋白酶對(duì)酪蛋白進(jìn)行水解,水解時(shí)間為6 h時(shí)制備出水解度為12.4%的酪蛋白水解物,其ACE抑制活性最高,IC50值為42.19 μg/mL。
(2)在添加了外源性氨基酸的情況下,利用堿性蛋白酶對(duì)酪蛋白水解物進(jìn)行修飾,氨基酸添加量與反應(yīng)溫度對(duì)修飾反應(yīng)影響較大,而酶添加量的影響很小,另外,氨基酸的種類(lèi)也有影響。
(3)通過(guò)研究反應(yīng)體系中游離氨基變化量的大小,在底物濃度固定為35%(w/w)、反應(yīng)時(shí)間固定為6 h的條件下,確定出適宜的反應(yīng)條件為:氨基酸添加量為0.6(mol/mol)、酶添加量為3kU/g蛋白質(zhì)、反應(yīng)溫度為40℃。
(4)利用上述的反應(yīng)條件,分別添加苯丙氨酸、亮氨酸、纈氨酸,制備出3個(gè)酪蛋白水解物的修飾產(chǎn)物。分析結(jié)果顯示,修飾產(chǎn)物ACE抑制活性大幅度提高,IC50降低至 21.03 ~25.13 μg/mL,但 3 種修飾產(chǎn)物的ACE抑制活性之間并沒(méi)有顯著性差異。
[1] Pfeffer M A.Angiotensin-converting enzyme inhibition in congestive heart failure:Benefit and perspective[J].A-merican Heart Journal,1993,126(3):789 -793.
[2] Maria M,Yust J P,Julio G C,et al.Production of ace inhibitory peptides by digestion of chickpea legumin with alcalase[J].Food Chemistry,2003,81(3):363-369.
[3] Suh H J,Whang J H,Kim Y S,et al.Preparation of angiotensin I converting enzyme inhibitor from corn gluten[J].Process Biochemistry,2003,38(8):1239-1244.
[4] Ueno K,Mizuno S,Yamamoto N.Purification and characterization of an endopeptidase that has an important role in the carboxyl terminal processing of antihypertensive peptides in Lactobacillus helveticus CM4[J].Letters in Applied Microbiology,2004,39(4):313-318.
[5] Kuba M,Tana C,Tawata S,et al.Production of angiotensin I-converting enzyme inhibitory peptides from soybean protein with Monascus purpureus acid proteinase [J].Process Biochemistry,2005,40(6):2 191-2 196.
[6] Doucet D,Gauthier S F,Otter D E,et al.Enzyme-induced gelation of extensively hydrolyzed whey proteins by alcalase:Comparison with the plastein reaction and characterization of interactions[J].Journal of Agricultural and Food Chemistry,2003,51(20):6 036-6 042.
[7] 李亞云,趙新淮.酪蛋白水解物的酶法修飾與ACE抑制活性變化[J].食品與發(fā)酵工業(yè),2009,35(5):35-39.
[8] Zhao X H,Li Y Y.An approach to improve ACE inhibitory activity of casein hydrolysates with Plastein reaction catalyzed by Alcalase[J].European Food Research and Technology,2009,229(5):795-805.
[9] GB/T 5009.5-2003,食品中蛋白質(zhì)的測(cè)定[S].
[10] Church F C,Swaisgood H E,Porter D H,et al.Spectrophtotometric assay using ο-phthaldialdehyde for determination of proteolysis in milk and milk proteins[J].Journal of Dairy Science,1983,66(6):1 219-1 227.
[11] Spellman D,McEvoy E,O'Cuinn G,et al.Proteinase and exopeptidase hydrolysis of whey protein:Comparison of the TNBS,OPA and pH stat methods for quantification of degree of hydrolysis [J].International Dairy Journal,2003,13(6):447-453.
[12] 趙新淮,馮志彪.蛋白質(zhì)水解物水解度的測(cè)定[J].食品科學(xué),1994,15(11):65-67.
[13] SB/T 10317-1999,蛋白酶活力測(cè)定[S].
[14] Shalaby S M,Zakora M,Otte J,et al.Performance of two commonly used angiotensin-converting enzyme inhibition assays using FA-PGG and HHL as substrates[J].Journal of Dairy Research,2006,73(2):178-186.
[15] Murray B A,Walsh D J,F(xiàn)itzGerald R J.Modification of the furanacryloyl-L-phenylalanyl-glycylglycine assay for determination of angiotensin-I-converting enzyme inhibitory activity[J].Journal of Biochemical and Biophysical Methods,2004,59(2):127-137.
[16] Miguel M,Contreras M M,Recio I,et al.ACE-inhibitory and antihypertensive properties of a bovine casein hydrolysate[J].Food Chemistry,2009,112(1):211 -214.
[17] Ortiz-Chao P,Gomez-Ruiz J A,Rastall R A,et al.Production of novel ACE inhibitory peptides from β-lactoglobulin using Protease N Amano[J].International Dairy Journal,2009,19(2):69-76.
[18] Robert M C,Razaname A,Mutter M,et al.Identification of angiotensin-I-converting enzyme inhibitory peptides derived from sodium caseinate hydrolysates produced by Lactobacillus helveticus NCC 2765[J].Journal of Agricultural and Food Chemistry,2004,52(23):6 923-6 931.
The ACE-inhibitory Activity in Vitro of Casein Hydrolysates Subjected to Enzymatic Modification in the Presence of Three Extrinsic Amino Acids
Wang Jing-ke,Zhao Xin-huai
(Key Laboratory of Dairy Science,Ministry of Education,Northeast Agricultural University,Harbin 150030,China)
Casein hydrolysates that had a degree of hydrolysis of 12.4%and ACE-inhibition with an IC50value of 42.19 μg/mL were prepared from casein with a protease Alcalase,and then modified by plastein reaction with Alcalase in the presence of three extrinsic amino acids.The effects of the addition level of amino acids,the addition level of Alcalase,reaction temperature and the types of amino acids on the plastein reaction of casein hydrolysates were investigated with response surface methodology.The results indicated that the addition of amino acids,reaction temperature and the types of amino acid added had significant impact on the plastein reaction,while the addition of Alcalase gave little influence.Three modified casein hydrolysates were prepared with suitable conditions and in the presence of phenylalanine,leucine and valine,respectively.Their IC50values were in range of 21.03 to 25.13 μg/mL,indicating that the ACE-inhibitory activity in vitro of the modified casein hydrolysates was improved significantly by adding amino acids while the types of amino acids were not important to the activity.
casein hydrolysates,plastein reaction,amino acids,ACE inhibitory activity,response surface methodology
碩士研究生(趙淮新教授為通訊作者)。
*國(guó)家自然科學(xué)基金(項(xiàng)目編號(hào)30972132)和黑龍江省高等學(xué)校科技創(chuàng)新團(tuán)隊(duì)建設(shè)計(jì)劃項(xiàng)目(項(xiàng)目編號(hào)2010td11)研究工作一部分
2010-12-06

