佛手揮發油對B16細胞增殖及其酪氨酸酶活性的影響*
邵鄰相, 呂學維, 鄧 剛, 張均平,徐玲玲, 麻艷芳, 畢潔瓊
(浙江師范大學化學與生命科學學院,浙江金華 321004)
佛手 (fingered citron),學名 Citrus m edicaL.var.sarcodactylis(Noot.)Swingle,為蕓香科柑橘屬香椽 (Citrus m edicaL.)的變種,又名佛手柑、佛手香櫞、蜜羅柑等.佛手性溫味辛、苦、酸,具理氣止嘔、和胃健脾、止咳化痰等功效[1].現代研究表明佛手有增強機體免疫力[2]、抑制小鼠移植性肝腫瘤生長[3]、保護正常細胞[4]和抑菌[5]等多種藥用功能.但有關佛手對體外培養腫瘤細胞及其酪氨酸酶活性影響的研究尚鮮見報道.本實驗研究了佛手揮發油對體外培養的 B16黑色素瘤細胞增殖及其酪氨酸酶活性的影響,為進一步擴大佛手在藥品、化妝品、食品等方面的應用提供重要依據.
1 材料與方法
1.1 佛手揮發油制備與處理
將金佛手果實洗凈后切塊,機械勻漿,水蒸氣回流裝置中提取揮發油.無水硫酸鈉干燥,過濾,滅菌后稱取 100 mg揮發油,加入 10μL無菌吐溫-80,渦旋振蕩混勻后用磷酸鹽緩沖液 (PBS)稀釋至 1 mL,渦旋振蕩混勻,4℃避光保存.
1.2 試劑
RPM I1640培養基、胰蛋白酶為美國 Gibco BRL公司產品;新生牛血清購自杭州四季青生物工程材料公司;臺盼藍、吖啶橙 (AO)、溴化乙錠(EB)、吐溫 -80、左旋多巴 (L-DOPA)、曲拉通 X-100(Triton X-100)均為 Sigma公司產品.
1.3 細胞培養
B16黑色素瘤細胞購自中國科學院上海細胞生物研究所.細胞接種在含 10%新生牛血清的RPM I1640培養基 (含 100μg·mL-1青霉素,100 μg·mL-1鏈霉素)中,37℃,5%CO2及飽和濕度條件下培養,細胞貼壁生長,用 1 g/L胰酶溶液與0.2 g/LEDTA溶液 (體積比 1 ∶1)消化傳代,取對數生長期的細胞用于實驗.
2×105cell/mL B16細胞接種于放有蓋玻片的 6孔板中,常規培養 12 h后加入佛手揮發油,使其終質量濃度為 62.50,125.00,250.00和500.00μg·mL-1,并設置 0.005%吐溫-80作為助溶劑對照組,待藥物作用 6 h后取出細胞爬片,進行各項指標檢測.
1.4 臺盼藍排斥法測定細胞存活率
用 0.4%臺盼藍試液染色 1 min,計數 200個細胞,正常細胞拒染,死細胞染為藍色,根據細胞計數結果計算細胞存活率,并計算半數抑制濃度(IC50).
細胞存活率 =(存活細胞數 /細胞總數)×100%.
1.5 瑞-姬氏混染法觀察細胞形態
取出細胞爬片,用新鮮配制的甲醇 ∶冰乙酸(體積比 3 ∶1)固定液 4℃固定 1 h,滴加瑞-姬氏染色液 100μL,染色 3 min,用蒸餾水將染液沖凈后在倒置顯微鏡下觀察拍照.
1.6 AO/EB熒光染色法觀察細胞核形態
采用文獻 [6]的方法進行染色,在熒光顯微鏡下觀察拍照.
1.7 酪氨酸酶活性檢測
參照文獻 [7]的方法并略有改進:62.50,125.00,250.00和 500.00μg·mL-1佛手揮發油處理細胞 6 h后,收集各組細胞用臺盼藍排斥法計數活細胞數,用 1 mL PBS重懸細胞,調整細胞密度為 5×105cell/mL,取 0.5 mL細胞懸液于2 mL離心管中,每管加 1%Triton X-100溶液200 μL,迅速于 -80℃冷凍 30 min,隨后 37℃水浴10 min使細胞完全破裂,然后加入 10 g/LLDOPA溶液 50μL,同時用L-DOPA自動氧化作為校準,37℃反應 2 h,以不加藥液細胞作為對照,以 0.005%的吐溫-80作為助溶劑對照.將上述離心管中含有活性酪氨酸酶的細胞裂解物加入 96孔細胞培養板中,每孔 100μL,每組設 3個復孔,酶標儀 475 nm波長處測吸光度值.
1.8 統計方法
數據以 x ±s表示,采用 SPSS 13.0統計軟件進行 t檢驗和單因素方差分析.
2 結 果
2.1 佛手揮發油對 B16細胞存活率的影響
臺盼藍排斥法測定結果如表 1所示,0.005%吐溫-80組 B16細胞存活率與對照組比較無顯著性差異 (P>0.05);62.50,125.00,250.00 μg·mL-1佛手揮發油處理 B16細胞 6 h,B16細胞存活率分別為 (80.67±1.61)%,(49.33±1.76)%和 (29.17±1.26)%,與對照組比較均顯著下降 (P<0.01);500.00μg·mL-1佛手揮發油處理 B16細胞 6 h后,B16細胞的存活率為(3.17±0.76)%,細胞幾乎全部死亡.隨著佛手揮發油質量濃度的增大,B16細胞存活率降低,抑制作用增強,并呈劑量依賴性.IC50值為(148.528±0.005)μg·mL-1.
2.2 佛手揮發油對 B16細胞形態的影響
2.2.1 瑞-姬氏混染倒置顯微鏡觀察
如圖 1所示,對照組與 0.005%吐溫-80組的B16細胞結構完整,多呈梭形,分裂相較多,細胞透明度較高,生長狀態良好;62.50μg·mL-1佛手揮發油處理細胞 6 h后,B16細胞成團生長,細胞間界限不清晰;125.00μg·mL-1和 250.00 μg·mL-1佛手揮發油處理 B16細胞后,多數細胞核固縮,染色質凝集呈塊狀;500.00μg·mL-1佛手揮發油處理 B16細胞后,細胞膜完整性破壞,大部分細胞溶解成碎片,說明細胞已壞死.
2.2.2 AO/EB熒光染色觀察
熒光染色中,AO能透過胞膜完整的細胞,嵌入細胞核DNA,使之發出明亮的綠色熒光;EB僅能透過胞膜受損的細胞,嵌入核 DNA,使之發出橘紅色熒光.凋亡的細胞呈現為染色增強,熒光更為明亮,均勻一致的圓狀或固縮狀、團塊狀結構.非凋亡細胞核呈現熒光深淺不一的結構樣特征.圖 2顯示:對照組和 0.005%吐溫-80組經 AO/EB染色后,在熒光顯微鏡下可見細胞結構清晰、胞膜完整,呈均勻一致的綠色熒光 (見圖 2中 A和B);62.50μg·mL-1佛手揮發油處理后,B16細胞核呈黃綠色,核染色質濃縮聚集于核膜內側,呈早期細胞凋亡特征 (見圖 2中 C);125.00 μg·mL-1和 250.00μg·mL-1佛手揮發油處理后,B16細胞體積縮小,部分細胞核破裂,細胞核染色質為 EB所染橘紅色并呈固縮狀或圓珠狀(見圖 2中 D和 E);500.00μg·mL-1佛手揮發油處理 B16細胞后,細胞膜完整性破壞,細胞核被 EB染成深紅色,出現細胞碎片,說明細胞已壞死 (見圖 2中 F).
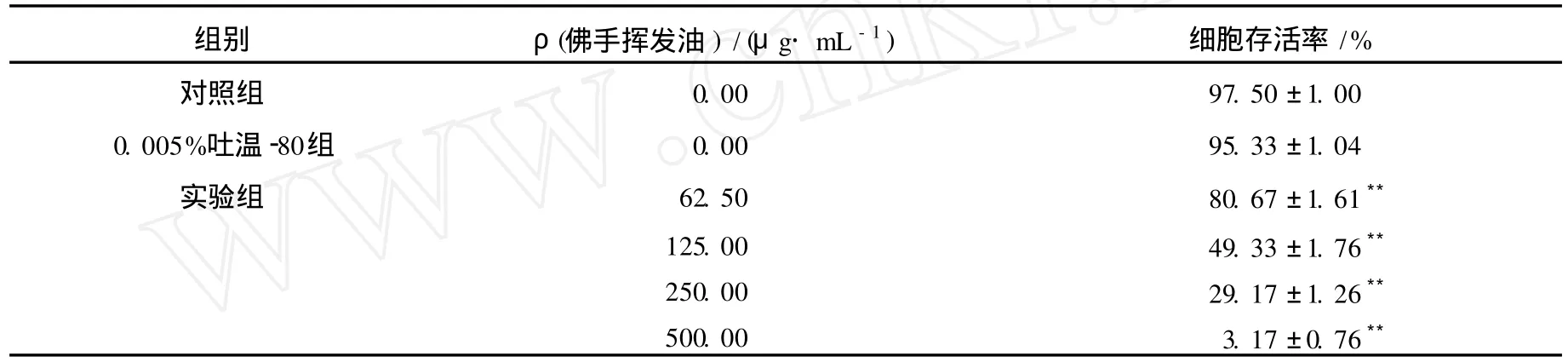
表 1 佛手揮發油對B16細胞存活率的影響 (x ±s,n=3)

圖 1 瑞-姬氏混染觀察佛手揮發油對 B16細胞形態的影響
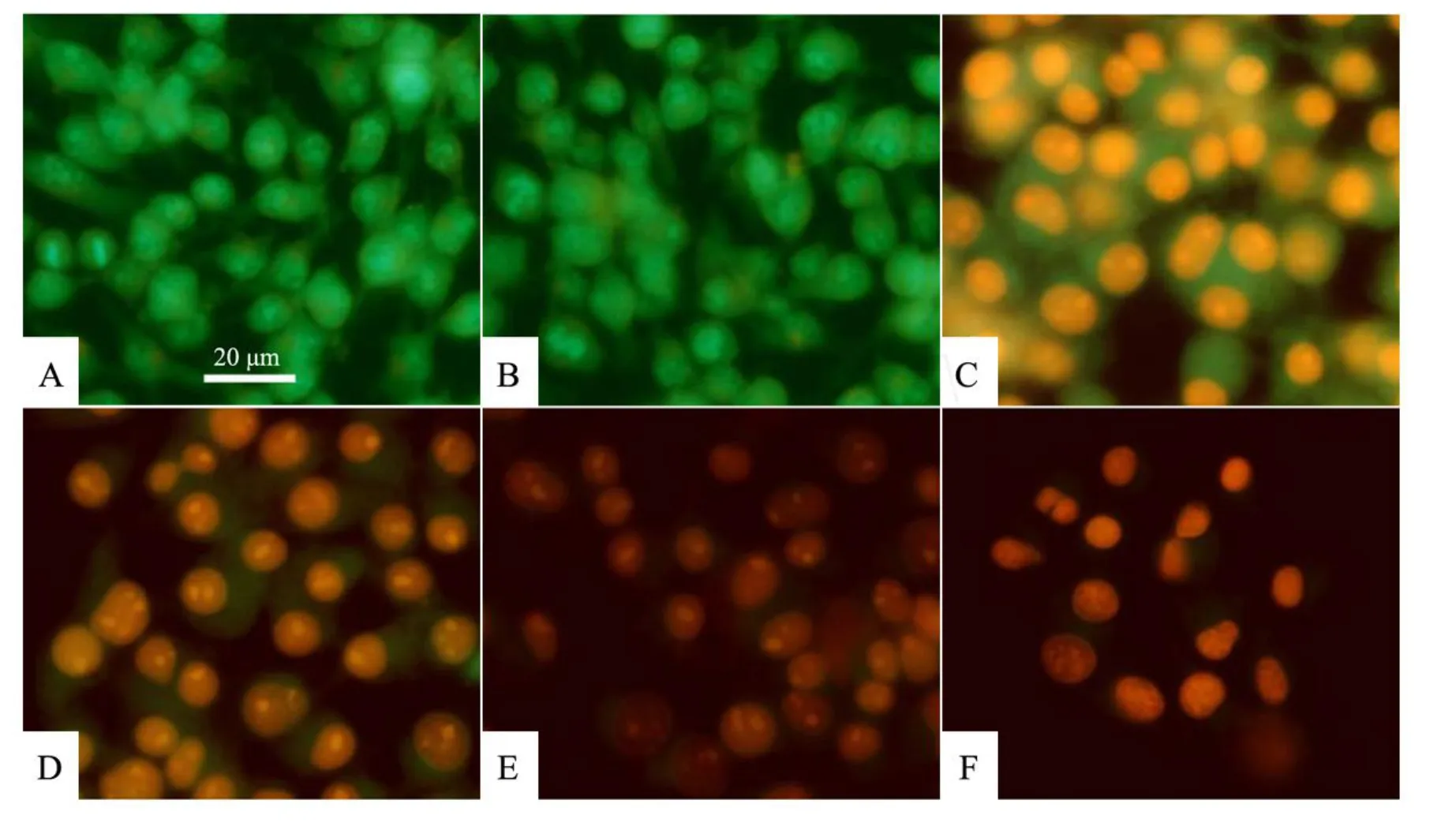
圖 2 AO/EB染色觀察佛手揮發油對B16細胞核形態的影響
2.3 佛手揮發油對 B16細胞酪氨酸酶活性的影響
從表 2可見,0.005%吐溫-80組與 62.50 μg·mL-1佛手揮發油處理組 B16細胞酪氨酸酶活性與對照組比較無顯著性差異;125.00,250.00和 500.00μg·mL-1佛手揮發油處理組 B16細胞酪氨酸酶活性與對照組比較均有顯著下降 (P<0.05),說明 125.00,250.00和 500.00μg·mL-1佛手揮發油對 B16細胞酪氨酸酶活性具有一定的抑制作用,且隨著藥物質量濃度的升高,抑制作用增強.

表 2 佛手揮發油對B16細胞酪氨酸酶活性的影響 (x±s,n=3)
3 討 論
惡性腫瘤是目前危害人類健康的主要疾病之一.天然中藥以其療效廣泛、毒性低、副作用小而受到國內外廣泛關注.中國是世界公認的天然藥物大國,有用中草藥治病的悠久歷史.
佛手作為傳統名貴中藥,具有止咳化痰和理氣和中等功效[8-9].佛手品種較多,其中以產自金華的金佛手品質最為優良.浙江金華佛手的特點是:果形奇異小巧,留香持久,揮發油含量高[10].趙磊等[11]對 12種金華佛手揮發油成分的比較研究發現,其主要成分為檸檬烯和γ-松油烯.本實驗選用金華佛手為實驗材料.
細胞凋亡是一種重要的細胞死亡方式,目前為止形態學鑒定是檢測細胞凋亡最可靠的方法.本實驗采用瑞-姬氏混染倒置顯微鏡觀察細胞形態的變化;用AO/EB染色熒光顯微鏡下觀察細胞凋亡,該方法能對正常細胞、早期凋亡細胞、晚期凋亡細胞及壞死細胞作出準確的判斷,被公認為是檢測細胞凋亡的一個定性定量指標[12-13].
本實驗結果表明,佛手揮發油對 B16黑色素瘤細胞生長具有顯著的抑制作用,揮發油濃度越高抑制率越大,呈劑量依賴性 (見表 1).低劑量(62.50μg·mL-1)佛手揮發油處理 B16細胞 6 h
后,細胞存活率在 80%以上;倒置顯微鏡觀察到B16細胞成團生長,細胞狀態較差;熒光顯微鏡下可見細胞核呈黃綠色,核染色質凝集于核膜內側,表明細胞發生早期凋亡.中劑量 (125.00,250.00 μg·mL-1)佛手揮發油處理 B16細胞 6 h后,倒置顯微鏡下可見細胞核固縮,染色質凝集;熒光顯微鏡下可見細胞體積縮小,細胞核被染成橘紅色,核染色質固縮,表明細胞已進入晚期凋亡.高劑量(500.00μg·mL-1)佛手揮發油處理 B16細胞6 h后,大部分細胞為臺盼藍染成深藍色,倒置顯微鏡下觀察到細胞膜破裂,部分細胞裂解成細胞碎片;熒光顯微鏡下可見細胞核為 EB染成紅色,部分細胞呈碎片狀,表明細胞已壞死.
另外,細胞酪氨酸酶活性檢測結果顯示佛手揮發油能夠顯著抑制細胞酪氨酸酶的活性.酪氨酸酶是黑色素合成最關鍵的限速酶,它的活性越高,生成的黑色素越多.佛手揮發油作為一種天然產物,對人體無毒,并且具有抑制酪氨酸酶活性的作用,因此在美容領域具有很大的開發潛力.
綜上所述,佛手揮發油具有抑制體外培養的B16黑色素瘤細胞增殖的作用,并能夠抑制細胞酪氨酸酶的活性,低、中劑量的佛手揮發油能夠誘導B16黑色素瘤細胞凋亡,高劑量的佛手揮發油可引起細胞壞死.
[1]浙江植物志編輯委員會.浙江植物志:總論[M].杭州:浙江科學技術出版社,1993.
[2]徐曉虹,金曉玲,章子貴.金華佛手醇提液對小鼠記憶、耐力和免疫機能的影響[J].浙江師范大學學報:自然科學版,2000,23(2):180-182.
[3]黃玲,鄺棗園.佛手多糖對小鼠移植性肝腫瘤 HAC22的抑制作用[J].江西中醫學院學報,2000,12(1):41-42.
[4]CorasanitiM T,Maiuolo J,Maida S,et al.Cell signaling pathways in the mechanisms of neuroprotection afforded by bergamot essential oil againstNMDA-induced cell death in vitro[J].Br J Phar macol,2007,151(4):518-529.
[5]SanguinettiM,Posteraro B,Romano L,et al.In vitro activity of Citrus bergamia(bergamot)oil against clinical isolates of dermatophytes[J].Journal ofAntimicrobial Chemotherapy,2007,59(2):305-308.
[6]邵鄰相,張均平,麻艷芳,等.佛手水煎劑對 RAW 264.7癌細胞增殖的影響[J].浙江師范大學學報:自然科學版,2009,32(4):448-452.
[7]姚莉,尚靖,徐建國.B16細胞中酪氨酸酶活性測定的方法學研究[J].新疆中醫藥,2007,25(4):16-18.
[8]王浴生.中藥藥理與應用[M].北京:人民衛生出版社,1981:537.
[9]黃泰康.常用中藥成分與藥理手冊[M].2版.北京:中國醫藥科學技術出版社,1994:1074.
[10]金曉玲,徐麗珊,鄭孝華.佛手揮發油的化學成分[J].分析測試學報,2000(4):237-238.
[11]趙磊,籍保平,周峰,等.十二種金華佛手揮發油成分的比較研究[J].食品科學,2006,27(6):179-184.
[12]WalterL,Ernest E,Frederick A,et al.Interleukin-6 delays neutrophil apoptosis via a mechanis m involving platelet-activating factor[J].Journal of Trauma-Injury Infection&Critical Care,1996,40(4):575-579.
[13]吳興,陳崢嶸,張光健.雙重染色法檢測人骨肉瘤細胞凋亡[J].腫瘤,2004,24(1):88-89.

