合歡皂甙Julibroside J8對人微血管內皮細胞凋亡的影響研究
花 慧,馮 磊,張小平,張蓮芬,金 堅*
1江南大學醫藥學院分子藥理研究室;2江南大學工業生物技術教育部重點實驗室,無錫214122;3無錫衛生高等職業技術學校,無錫214028
合歡皮為較常用中藥,中國藥典(一部)2000年版規定,合歡皮為合歡的干燥莖皮,具有解郁安神、活血消腫的作用、用于心神不安、憂郁失眠、肺癰瘡腫、跌撲傷痛等癥[1]。研究表明,合歡皮中化學成分較多,陳四平[2]等利用HPLC制備技術,從合歡皮乙醇提取物的正丁醇萃取部位分離得到一系列結構復雜的三萜苷類化合物。Julibroside J8是從合歡皮分離得到一種含九個糖三萜皂甙,鄭路[3]等人研究表明其體外具有抑BGC-823、Bel-7402、HeLa、PC-3MIE8、MDA-MB-435和HL-60細胞的活性,具有經caspase家族及Bcl家族共同調控誘導Hela細胞凋亡的作用,但它是否具有抑制人微血管內皮細胞的作用尚不清楚。本研究旨在探討Julibroside J8對人微血管內皮細胞的生長抑制作用及其可能的機制。
1 材料
SV40病毒轉染的人微血管內皮細胞(HMEC-1)傳代株由法國國家衛生醫學研究院U553研究所(INSERM U553)陸核教授饋贈;SRB(Sigma公司); MCDB-131細胞培養基(Gibco BRL公司);胰酶、小牛血清、L-谷氨酰胺(華美生物工程公司);DAPI染液、TUNEL試劑盒(凱基生物公司);Annexin-V/PI雙標記試劑盒(BD PharMin-gen公司)。
合歡皮購自江蘇省無錫市山禾藥業股份有限公司,由南京中醫藥大學陳建偉教授鑒定為 Albizia julibrissin Durazz.的干燥樹皮。
2 方法
2.1 細胞培養
將HMEC-1用含1 mmol/L谷氨酰胺、1 mg/L氫化可的松、10 μg/L EGF和150 mL/L小牛血清的MCDB-131培養液,于37℃,50 mL/L CO2培養箱中傳代培養。
2.2 合歡皂甙Julibroside J8的制備
將1 kg合歡皮分別用8 L、7 L 75%乙醇,100℃回流提取兩次,每次2 h,過濾,去渣。合并濾液,減壓回收乙醇,得浸膏120g,將所得浸膏經D101型大孔樹脂吸附,再用水,30%乙醇,50%乙醇70%乙醇,90%乙醇各洗脫3個柱體積,收集各相,將70%乙醇相得浸膏,用100~200目的硅膠常壓分離,用體積比氯仿∶甲醇∶水為9∶1∶0.1~6.5∶3.5∶1梯度洗脫,等體積(300 mL)收集,將第33~44瓶合并,回收溶劑得浸膏,用反相色譜(色譜柱Sunfire C18,5 μL,100A,19×150 mmID;流動相∶甲醇-水70∶30,流速:5 mL/min,紫外檢測波長:215 nm)中壓分離,按色譜單峰收集,回收溶劑,冷凍干燥得有效組分A1,經HPLC分析純度為95.5%,將組分A1的UV、MS、IR、1H NMR、13C NMR圖譜的數據與文獻[4]逐一比對。確定其為化合物合歡皂甙Julibroside J8結構見圖1。將Julibroside J8溶解于細胞培養基中過濾滅菌備用。
2.3 細胞增殖抑制實驗(SRB法)
取對數生長期細胞,按每孔7000-8000個細胞接種于96孔板中放置于37℃、50 mL/L CO2的培養箱中培養過夜,加入不同濃度的合歡皂甙Julibroside J8(0.5、1.0、1.5、2.0、4.0 μg/mL)每個濃度設藥物作用時間6、12、24、48 h。且同時設相應不加藥組為陰性對照組。在撤去藥物后繼續培養至72 h去上清液,每孔輕輕加入100 g/L三氯醋酸100 μL固定,靜置5 min后移到4℃再放置1 h倒掉固定液,用去離子水洗5遍,空氣干燥。每孔加入4 g/L SRB 100 μL室溫放置30 min,用10 mL/L醋酸液洗5遍,加入150 μL 10 mmol/L Tris堿液(pH 10.5)溶解,用MK3型酶標儀在波長A570處測定每孔A值。計算抑制率(%)同時繪制藥物濃度抑制率曲線,抑制率=[(對照組的A值–藥物組的A值)/(對照組的A值-空白組的A值)]×100%
2.4 DAPI染色觀察細胞核變化
取對數生長期的HMEC-1細胞,接種到培養皿中(預先放置蓋玻片)培養24 h,細胞在蓋玻片上生長貼壁后,加入 Julibroside J8,使其終濃度為1.5 μg/mL,空白對照不加Julibroside J8,繼續培養24 h,小心取出蓋玻片,加500 μL的DAPI染液洗一次;再滴加入500 μL的DAPI工作液,37℃染色15 min;棄去染色液,甲醇漂洗一次,滴加甘油。熒光顯微鏡以340/380 nm紫外光激發,以100×油鏡頭觀察、拍照。
2.5 TUNEL染色法
取對數生長期的HMEC-1細胞,接種到培養皿中(預先放置蓋玻片)培養24 h,細胞在蓋玻片上生長貼壁后,加入不同濃度的合歡皂甙Julibroside J8(0.5、1.5、2.5 μg/mL)作用時間48 h。且同時設相應不加藥組為陰性對照組。以下操作嚴格按照說明書進行。
2.6 采用Annexin-Ⅴ/PI雙標記行流式細胞儀測定細胞凋亡率
取對數生長期的HMEC-1細胞,接種于細胞培養瓶中,細胞濃度為5×105個/瓶,24 h后加Julibroside J8,使其終濃度為0.5~2.5 μg/mL,同時不加Julibroside J8為空白對照,繼續培養24 h后,據Annexin-V/PI雙標記試劑盒說明操作。流式細胞儀分析,每樣本收集10 000個細胞熒光信號,檢測結果采用Cellquest軟件分析。
2.7 統計分析
采用SPSS 1310軟件進行分析,組間比較采用方差分析。
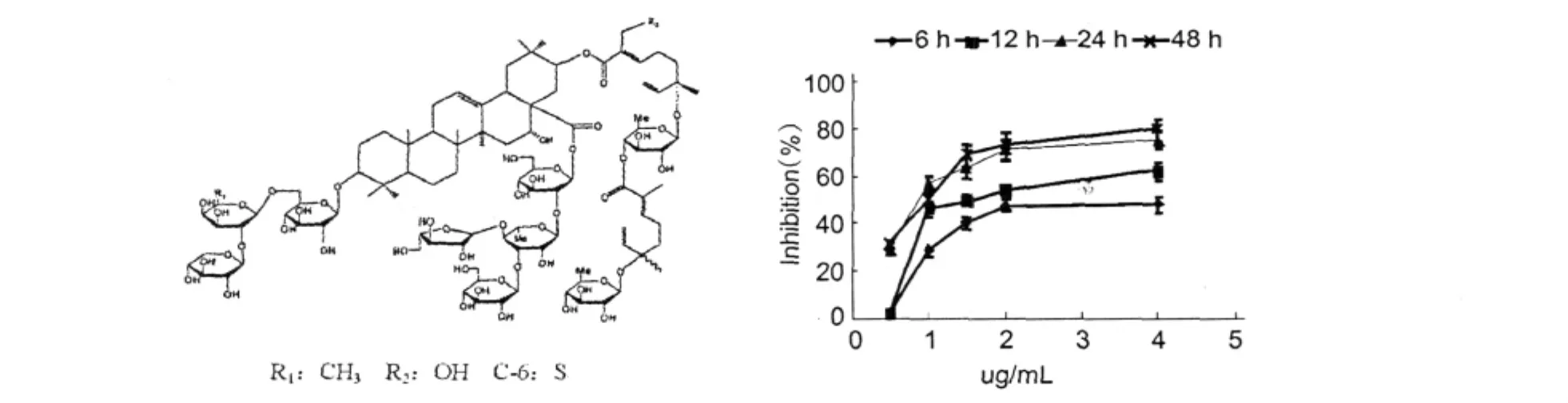
圖1 Julibroside J8的化學結構圖和對HMEC-1細胞的作用Fig.1 Chemical structure and effect of Julibroside J8on HMEC-1 cells
3 結果
3.1 Julibroside J8對HMEC-1增殖的影響
在不同濃度Julibroside J8作用下,Julibroside J8對內皮細胞HEMC-1均有不同的抑制作用。Julibroside J8呈劑量依賴性抑制HEMC-1細胞的增殖,抑制作用隨著Julibroside J8的濃度以及作用時間的增加而增強。在作用濃度1 μg/mL,作用時間6 h時,抑制率達到35%。統計學分析差異顯著(P<0.01)。
3.2 Julibroside J8對HMEC-1細胞核形態的影響
HMEC-1細胞爬片后,經DAPI染色后熒光顯微鏡拍照結果如圖2。HMEC-1空白對照細胞較弱的藍色熒光,核形態呈橢圓形,邊緣清晰,染色均勻,細胞經樣品作用后,產生很強藍光染色。并且細胞的細胞核邊緣不規則,細胞核染色體濃集,著色較重,并伴有細胞核固縮,核小體碎片增加這是細胞凋亡的明顯特征。
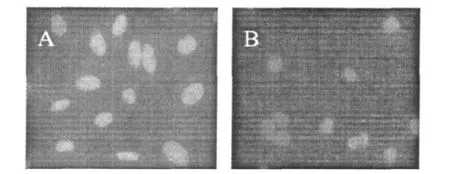
圖2 DAPI染色觀察HMEC-1細胞形態的變化Fig.2 The morphological changes of HMEC-1 cells by DAPI dying with microscopy
3.3 TUNEL檢測細胞在凋亡過程中細胞核DNA的斷裂
HMEC-1細胞爬片后,經TUNEL染色后光學顯微鏡拍照如圖3。由圖中可以看到,HMEC-1空白對照細胞核呈較弱的藍色,核形態呈橢圓形,邊緣清晰,染色均勻,細胞經樣品作用后,細胞核呈深棕色。表明細胞經藥物作用后產生了凋亡。且隨著劑量的增加細胞核呈深棕色的細胞比例也在增加,呈現出劑量依賴關系。
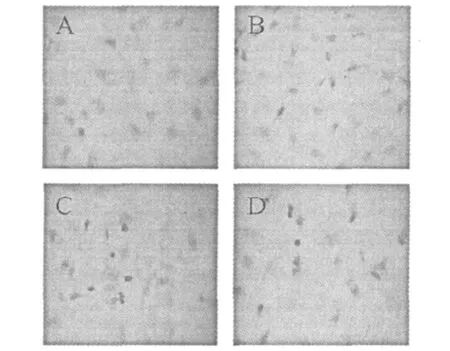
圖3 TUNEL染色觀察HMEC-1細胞核中DNA斷裂Fig.3 Effect of Julibroside J8on DNA fragmentation in HMEC-1 cells
3.4 檢測細胞壞死與凋亡:Annexin V/PI雙染色流式細胞術檢測
HMEC-1細胞經不同濃度的樣品作用24 h后,分別經胰酶消化,收集5×105~106個細胞,根據試劑盒說明書進行Annexin V/PI雙染色,立即用流式細胞儀檢測,結果如圖4。在不同的濃度Julibroside J8作用下,隨加樣濃度的增大,處于右下象限的細胞即凋亡細胞明顯增多,當Julibroside J8的濃度依次為 0.5、1.5、2.5 μg/mL時,凋亡率分別達到13.63% ±3.10%,19.55% ±4.69%,32.32% ± 6.19%,而正常對照組細胞凋亡率為 8.34% ± 2.90%。二者統計學分析差異顯著(P<0.05)。
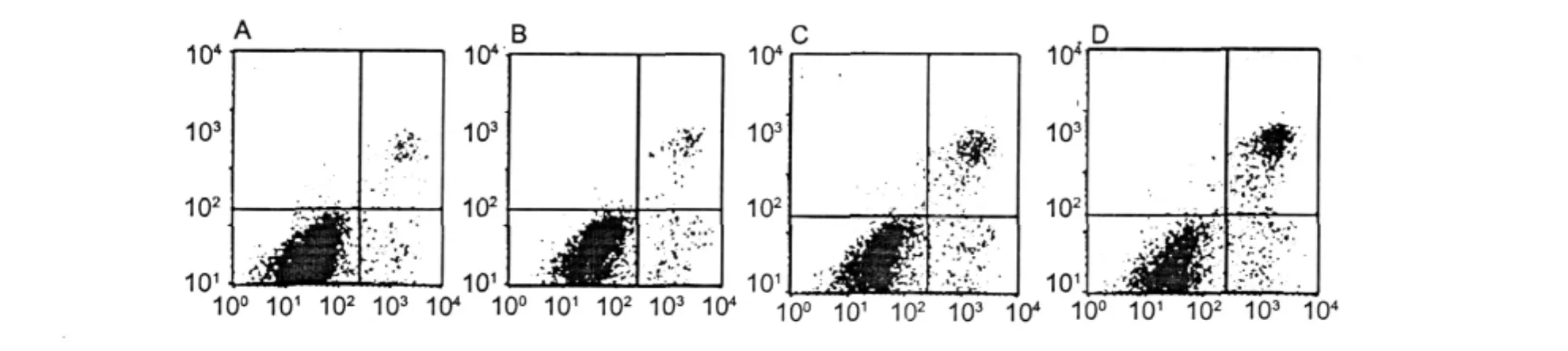
圖4 AnnexinⅤ/PI雙染色法流式細胞術檢測HMEC-1細胞的壞死與凋亡Fig.4 Representative flow cytometry analysis of cell necrosis and cell apoptosis induction in HMEC-1 cell incubated 24 h with Julibroside J8
4 討論
1971年,Folkman提出腫瘤生長是血管生成依賴性的新觀點,并提出了“抗血管生成治療”的概念[5]。血管生成(angiogenesis)是指毛細血管從已存在的血管周圍生成的過程,包括血管內皮細胞的激活、細胞外基質的降解、內皮細胞的增殖與移行、形成新的血管和血管網,因此以血管內皮細胞為藥物作用靶點從中草藥中尋找發現新的血管生成抑制劑正日益成為目前研究腫瘤轉移的熱點。
根據以上理念,我們首先通過體內,體外模型確定了中藥合歡皮的提取物的抑制血管生成的作用[6],繼而以血管內皮細胞為模型,綜合運用多種分離手段從合歡皮中篩選分析得到Julibroside J8。體外細胞抑制實驗結果顯示內皮細胞經不同濃度Julibroside J8,作用6 h后生長就受到抑制,表明Julibroside J8對內皮細胞的抑制作用不是因為改變細胞的生長環境而產生的,而是對細胞本身發生了作用。為了探明Julibroside J8抑制內皮細胞增殖的原因我們采用以下三個實驗進行了分析研究。
DAPI染色法:DAPI(4,6-Diamidino-2-phenylindole,4,6-二氨基-2-苯基吲哚)是一種DNA特異性染料,與DNA產生非嵌入式結合,發出藍色熒光。該染料對細胞膜有半通透性,可透過正常活細胞產生較弱的藍色熒光(細胞固定后熒光增強),而凋亡細胞的膜通透性增加,對其攝取能力增強,產生很強藍光染色。并且正常細胞的核形態呈圓形,邊緣清晰,染色均勻,而凋亡細胞的細胞核邊緣不規則,細胞核染色體濃集,著色較重,并伴有細胞核固縮,核小體碎片增加,因此從熒光強度及核形態均可鑒別出細胞發生凋亡的典型特征。TUNEL染色法則利用脫氧核糖核苷酸末端轉移酶(TdT)的作用標記熒光素于凋亡細胞中斷裂DNA的3’末端,從而準確地反映DNA片段的生化特點與典型的形態學特點,進行凋亡細胞的識別[7]。Annex-inV/PI雙染法應用流式細胞儀測定是檢測細胞凋亡的常用方法,具有量化凋亡變化的能力[8]。
通過上述3項指標檢測,結果證實Julibroside J8可以通過誘導內皮細胞凋亡的途徑達到抑制內皮細胞增殖的作用。這與文獻[3]報道的Julibroside J8可以誘導HeLa凋亡的報道相一致。但其誘導內皮細胞凋亡的機理尚待實驗進一步證明。
1 Pharmacopoeia Committee of China(國家藥典委員會),Chinese Pharmacopoeia(中華人民共和國藥典),Part A,Chemistry and Industry Publishing House(化學工業出版社),Beijing,2000,p.111.
2 Chen SP,Zhang RY,Ma LB,et al.Structure determination of three saponons from the stem bark of Albizzia julibrissin Durazz.Acta Pharm Sin,1997,32:110-115.
3 Zheng L,Zheng J,Wu LJ,et al.Julibroside J8-induced HeLa cell apoptosis through caspase pathway.J Asian Nat Prod Res,2006,8:457-465.
4 Zou K,Tong WY,Liang H,et al.Diastereoisomeric saponins from Albizia julibrissin.Carbohydr Res,2005,340:1329-34.
5 Folkman J,Shing Y.Angiogenesis.J Biol Chem,1992,267: 10931-10934.
6 Hua H(花慧),Feng L(馮磊),Zhang XP(張小平),et al.The experimental study on the anti-angiogenenic effect of Albizia julibrissin extracts.Nat Prod Res Dev(天然產物研究與開發),2010,22(2):215-218,260
7 Otsuki Y,Li Z,Shibata MA.Apoptotic detection methods from morphology to gene.Prog Histochem Cytochem,2003,38:275-339.
8 Mccloskey TW,Oyaizu N,Coronesi M,et al.Use of a flow cytometric assay to quantitate apoptosis in humanlymphocytes.Clin Immunol Immunopathol,1994,71:14-18.

