定性走向定量 理論付諸實(shí)踐——“酸堿中和滴定”教學(xué)設(shè)計(jì)
鄒晨光
(江蘇省石莊高級(jí)中學(xué) 江蘇 如皋 226531)
一、教材分析和設(shè)計(jì)思路
酸堿中和滴定操作簡(jiǎn)便、快捷、精確度高,具有很大的實(shí)用價(jià)值,在生產(chǎn)生活和科學(xué)研究中應(yīng)用廣泛。 是《化學(xué)反應(yīng)原理》(選修四)模塊中的重要內(nèi)容,與必修模塊中的“一定物質(zhì)的量濃度溶液的配制”和選修模塊的“中和反應(yīng)反應(yīng)熱的測(cè)定” 等實(shí)驗(yàn)一起承載著課程標(biāo)準(zhǔn)中“體會(huì)定量研究的方法對(duì)研究和學(xué)習(xí)化學(xué)的作用” 的功能。 三種現(xiàn)行的不同版本的教材對(duì)其編排有所不同:人教版將其安排在第三章中 “水的電離和溶液的酸堿性”這一節(jié),作為pH 的一個(gè)重要應(yīng)用;蘇教版則在專題3 的第二單元中單獨(dú)設(shè)立欄目介紹酸堿中和滴定,著眼于研究測(cè)定和控制溶液的酸堿性在實(shí)踐中的應(yīng)用;魯教版則將這部分內(nèi)容安排在第三章第四節(jié)“離子反應(yīng)”之中。 不同的編排次序, 顯示了教材編寫者不同的思路和意圖,但仔細(xì)研究可以發(fā)現(xiàn)一些共同之處,編寫者不約而同地將其設(shè)置在實(shí)用的背景之下, 讓學(xué)生感受到知識(shí)的價(jià)值,且都安排了“活動(dòng)與探究”環(huán)節(jié),以凸顯化學(xué)學(xué)科特點(diǎn),發(fā)揮定量實(shí)驗(yàn)的教育功能。
定性分析到定量研究是人類認(rèn)識(shí)上的一大飛躍,從模糊到清晰、從表象到本質(zhì)。 定量實(shí)驗(yàn)的核心要求是高精確度,而提高酸堿中和滴定實(shí)驗(yàn)中精確度的關(guān)鍵有兩點(diǎn):準(zhǔn)確測(cè)量所需溶液的體積,準(zhǔn)確判斷滴定的終點(diǎn),前者需要精確的儀器和規(guī)范的操作。 滴定管是一種具有精確刻度、內(nèi)徑均勻的細(xì)長(zhǎng)玻璃管,取液方便,用它代替量筒,學(xué)生容易接受,而規(guī)范操作可在實(shí)踐中慢慢培養(yǎng)。 但對(duì)于通常沒有外觀變化的中和反應(yīng), 如何判斷滴定終點(diǎn),對(duì)學(xué)生來說是個(gè)難點(diǎn)。
本節(jié)課設(shè)計(jì)了三個(gè)環(huán)節(jié)。 第一個(gè)環(huán)節(jié)是定性分析,貼近學(xué)生實(shí)際,便于自主研習(xí)。 既揭示研究課題,復(fù)習(xí)舊知,又為下一環(huán)節(jié)創(chuàng)設(shè)情景,留下伏筆;第二個(gè)環(huán)節(jié)是定量研究,引導(dǎo)學(xué)生通過觀察實(shí)驗(yàn)、記錄數(shù)據(jù)、繪制圖像等方式發(fā)現(xiàn)酸堿中和過程中pH 變化規(guī)律及表征滴定終點(diǎn)的方法,直觀與抽象結(jié)合、定性與定量對(duì)比,層層遞進(jìn),將學(xué)生的思維漸漸引入新的高度;第三個(gè)環(huán)節(jié)將理論付諸實(shí)踐,以測(cè)定未知鹽酸的濃度為任務(wù)驅(qū)動(dòng),教師提供儀器和藥品,學(xué)生分組討論交流,形成實(shí)驗(yàn)方案,最后小組協(xié)作完成實(shí)驗(yàn)。 整個(gè)過程關(guān)注學(xué)生的主動(dòng)參與,在實(shí)驗(yàn)過程中感悟和提升,培養(yǎng)合作精神和反思意識(shí)。
二、教學(xué)目標(biāo)
(1)認(rèn)識(shí)酸堿中和滴定的原理,知道酸堿中和過程中pH 突變的存在,能繪制簡(jiǎn)單的pH 變化曲線,初步學(xué)會(huì)使用滴定管。 (知識(shí)與技能)
(2)通過用已知濃度的NaOH 溶液測(cè)定未知鹽酸的濃度的實(shí)踐活動(dòng),提高實(shí)驗(yàn)設(shè)計(jì)和反思的能力。 (過程與方法)
(3) 通過分析酸堿中和過程中pH 的變化規(guī)律,感受定量研究的重要性。 (過程與方法)
(4) 能進(jìn)一步感受到定量實(shí)驗(yàn)的嚴(yán)謹(jǐn)之美和化學(xué)的實(shí)用價(jià)值,能在思考分析過程中傾聽他人意見,相互啟發(fā),體會(huì)合作交流的重要性。 (情感態(tài)度與價(jià)值觀)
三、教學(xué)過程與評(píng)析
1.定性認(rèn)識(shí)酸堿中和過程中pH 的變化
創(chuàng)設(shè)情景:室溫下,向裝有20.00mL、0.100mol·L-1稀HCl 的 錐 形 瓶 中 逐 滴 加 入0.100mol·L-1NaOH 溶 液30.00mL。
提問: 描述整個(gè)過程中溶液的pH 如何變化? 以NaOH 溶液的體積為橫坐標(biāo),pH 為縱坐標(biāo),畫出pH 變化的圖像(標(biāo)出起點(diǎn)和終點(diǎn)坐標(biāo),已知lg5=0.7)。
交流: 學(xué)生展示的圖像均能體現(xiàn)溶液的pH 由小變大的趨勢(shì),起點(diǎn)坐標(biāo)為(0,1),終點(diǎn)坐標(biāo)為(30.00,12.3)但細(xì)節(jié)上卻不盡相同,如圖1。
過渡:圖像的正確性教師暫不做評(píng)價(jià),請(qǐng)學(xué)生先看下面的問題。
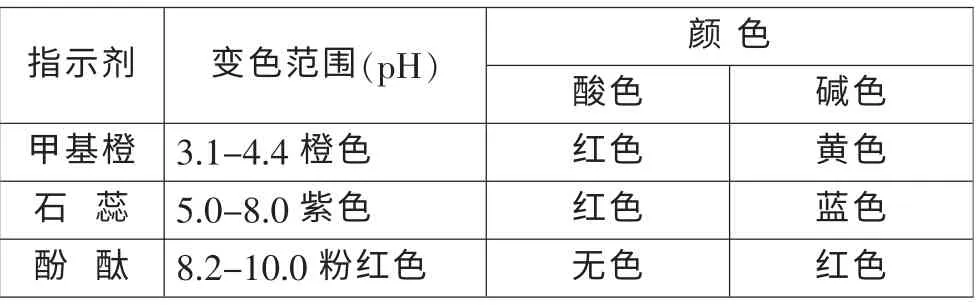
投影:常見的酸堿指示劑主要有三種,它們的顏色變化是在一定pH 范圍內(nèi)發(fā)生的,變色范圍如下表:

圖1
?
提問:在上述實(shí)驗(yàn)中,如果預(yù)先在稀鹽酸中分別加入2-3 滴以上指示劑,實(shí)驗(yàn)過程中可能會(huì)有哪些顏色變化?
交流:甲基橙 紅色——橙色——黃色
石 蕊 紅色——紫色——藍(lán)色
酚 酞 無色——粉紅色——紅色評(píng)析:本段教學(xué)立足于學(xué)生的已有經(jīng)驗(yàn),以一個(gè)非常簡(jiǎn)單的實(shí)驗(yàn)問題為先行組織者,提示學(xué)生用圖像研究變化過程。 當(dāng)學(xué)生展示的答案有爭(zhēng)議時(shí),教師并沒有急于公布正確答案,而是留下懸念,為下一步的探究預(yù)留可對(duì)比的素材;接著介紹酸堿指示劑,引導(dǎo)學(xué)生用直觀形象的方式說明溶液酸堿性的變化,使學(xué)生從不同的角度思考問題,同時(shí)為中和滴定實(shí)驗(yàn)中指示劑的選擇留下伏筆。
2.定量探究酸堿中和過程中pH 的變化
過渡:測(cè)定溶液pH 的方法很多,可以用pH 試紙測(cè)量,也可以用一種叫pH 計(jì)(也叫酸度計(jì))的儀器來測(cè)量,根據(jù)不同精確度要求可以選擇不同的測(cè)量方法。
投影:pH 計(jì)及使用說明。
演示實(shí)驗(yàn): 用pH 計(jì)定量測(cè)定酸堿中和過程中pH的變化。
用酸式滴定管準(zhǔn)確量取20.00mL0.100mol·L-1稀HCl,注入錐形瓶中,在堿式滴定管中裝入0.100mol·L-1NaOH 溶液。 每加入5-10mL 堿液,用pH 計(jì)測(cè)量和記錄一次溶液的pH,終點(diǎn)附近,測(cè)試和記錄的間隔變小,每加一滴測(cè)一次,一滴大約為0.04mL。
展示:記錄的數(shù)據(jù)如下表:

?
提問:按照上表數(shù)據(jù),請(qǐng)以NaOH 溶液的體積為橫坐標(biāo),pH 為縱坐標(biāo),重新畫出pH 值變化的圖像。 與對(duì)比第一次畫出的圖像有何區(qū)別。
交流:學(xué)生展示的圖像如圖2:
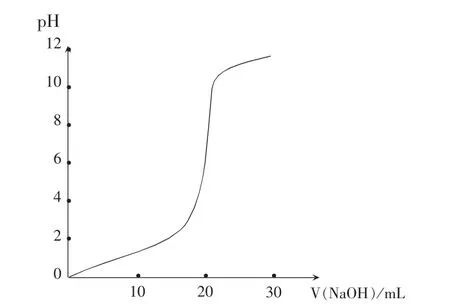
圖2
酸堿中和過程中溶液pH 的變化并不是均勻的,剛開始變化比較小,終點(diǎn)附近pH 發(fā)生了突然變化,堿過量以后,pH 增大得也較慢。 (學(xué)生)
追問:從實(shí)驗(yàn)可以看出,很少量(0.04mL,約一滴)的堿就會(huì)引起溶液pH 的突變,從4.00 變化為10.30。 請(qǐng)思考pH 突變能否用來判斷中和反應(yīng)的終點(diǎn)?
交流:可以的。
再問:能否設(shè)計(jì)一個(gè)簡(jiǎn)單的實(shí)驗(yàn)(可以觀察到明顯的現(xiàn)象)來幫助我們判斷加入的堿液正好與20.00mL 的稀鹽酸完全反應(yīng)。
提示:實(shí)驗(yàn)允許的誤差范圍一般為±0.1%,對(duì)本實(shí)驗(yàn)而言,即一滴或半滴的問題。
交流:
(1)將指示劑的變色范圍標(biāo)在pH-V(NaOH)曲線上,指示劑的變色范圍正好在pH 的突變范圍內(nèi)。
(2)指示劑的變色范圍很窄(甲基橙1.3、石蕊3、酚酞2),對(duì)溶液的酸堿性變化很靈敏,終點(diǎn)附近少量的酸或堿就會(huì)引起指示劑的突然變色。 (學(xué)生)
(3)預(yù)先在稀鹽酸中加入幾滴甲基橙,當(dāng)觀察到紅色恰好變成橙色即可。
預(yù)先在稀鹽酸中加入幾滴石蕊,當(dāng)觀察到紅色恰好變成紫色即可。
預(yù)先在稀鹽酸中加入幾滴酚酞,當(dāng)觀察到無色恰好變成粉紅色即可。 (學(xué)生)
補(bǔ)充實(shí)驗(yàn):向滴有石蕊試劑的稀鹽酸中加入氫氧化鈉溶液(讓學(xué)生親自感受到紅紫藍(lán)三色變化不明顯這一事實(shí))。
小結(jié):在強(qiáng)酸和強(qiáng)堿反應(yīng)時(shí),通常可以選用甲基橙或酚酞試液來幫助我們判斷反應(yīng)的終點(diǎn)。
引申:如果上述實(shí)驗(yàn)反過來進(jìn)行,向NaOH 溶液中逐漸加入稀鹽酸, 所得到中和滴定的曲線會(huì)有什么不同?
交流:(略)
評(píng)析: 在學(xué)生定性分析酸堿中和過程中pH 變化的問題出現(xiàn)困惑時(shí), 適時(shí)引入測(cè)定pH 的精確儀器——pH計(jì)。 通過課堂演示實(shí)驗(yàn),定量測(cè)定pH,揭示變化的規(guī)律,解決心中的疑惑。 從定性研究走向定量分析,體現(xiàn)了思維應(yīng)有的軌跡,同時(shí)讓學(xué)生領(lǐng)悟到定量分析在學(xué)科中的價(jià)值。 前后兩次作圖的對(duì)比,提供了一個(gè)很好的感性平臺(tái),教師沒有過多的講解,學(xué)生卻可真實(shí)感受到pH 突變的存在。 緊接著幾個(gè)環(huán)環(huán)相扣的問題,很自然地引導(dǎo)學(xué)生去關(guān)注指示劑的變色范圍和pH 的突變范圍, 進(jìn)而突破指示劑選擇這一難點(diǎn)問題,層次分明,水到渠成。
3.體驗(yàn)酸堿中和滴定實(shí)驗(yàn)
過渡問題:中和反應(yīng)一般沒有明顯現(xiàn)象,但我們學(xué)會(huì)了判斷中和反應(yīng)的終點(diǎn)之后,能否用已知物質(zhì)的量濃度的酸(或堿)溶液來測(cè)定未知濃度的堿(或酸)的物質(zhì)的量濃度呢?
交流:用已知濃度的酸(或堿)滴定未知濃度的堿(或酸),通過測(cè)定反應(yīng)完全時(shí)消耗已知濃度的酸(或堿)的體積,從而推算出未知堿(或酸)的濃度。
創(chuàng)設(shè)情景:同學(xué)們實(shí)驗(yàn)臺(tái)上擺放的藥品中就有一瓶0.100mol·L-1的標(biāo)準(zhǔn)NaOH 溶液, 但鹽酸是未知濃度的,現(xiàn)在就請(qǐng)你們利用提供的實(shí)驗(yàn)儀器和藥品,親手測(cè)定它的濃度。
交流:
(1)實(shí)驗(yàn)需要的數(shù)據(jù)有三個(gè):NaOH 溶液的濃度(已知),鹽酸的體積(事先預(yù)設(shè),一般取20.00mL),滴定到終點(diǎn)時(shí)所用的NaOH 溶液體積(待測(cè))。
(2)實(shí)驗(yàn)步驟可分五步:用酸式滴定管量取20.00mL的稀鹽酸注入錐形瓶?jī)?nèi);用堿式滴定管量取標(biāo)準(zhǔn)氫氧化鈉溶液,調(diào)節(jié)和記錄起始讀數(shù);向錐形瓶?jī)?nèi)滴加2 滴酚酞試液;中和滴定,記錄終點(diǎn)讀數(shù);重復(fù)以上實(shí)驗(yàn)并計(jì)算。(學(xué)生)
學(xué)生實(shí)驗(yàn),教師巡視。
交流和反思:本實(shí)驗(yàn)采用的可以提高實(shí)驗(yàn)的精確度措施。
(1)精確取液儀器——滴定管(取代量筒),盛液防濺儀器——錐形瓶(取代燒杯)。
(2)準(zhǔn)確使用滴定管(查漏、洗滌、潤(rùn)洗、注液、趕氣、調(diào)液、讀數(shù))。
(3)滴加速率先快后慢,邊加邊振蕩。
(4)準(zhǔn)確選擇指示劑,仔細(xì)觀察錐形瓶中顏色變化。
(5)多次重復(fù),取平均值。
評(píng)析:經(jīng)過上面兩個(gè)環(huán)節(jié)的教學(xué),學(xué)生已經(jīng)認(rèn)識(shí)到酸堿中和滴定的原理,產(chǎn)生付諸實(shí)踐的沖動(dòng)和激情。 加之前面已經(jīng)觀看了教師使用滴定管的規(guī)范過程,大多學(xué)生具備了設(shè)計(jì)和操作“測(cè)定未知鹽酸的濃度”這一實(shí)驗(yàn)的能力。 因此,教師沒有過多的干預(yù),只是在行間不間斷地巡視,對(duì)操作有困難的學(xué)生及時(shí)地提供幫助。 在實(shí)驗(yàn)后的反思教學(xué)中,突出定量實(shí)驗(yàn)精確度的要求,通過交流探討,讓學(xué)生對(duì)實(shí)驗(yàn)中的注意事項(xiàng)了然于胸,同時(shí)有利于培養(yǎng)細(xì)心、嚴(yán)謹(jǐn)?shù)膶W(xué)科素養(yǎng)。
四、教學(xué)體會(huì)
此節(jié)課的教學(xué)過程中, 力求體現(xiàn)新課程的基本理念:面向全體學(xué)生,注重知識(shí)的構(gòu)建過程,提高化學(xué)科學(xué)素養(yǎng)。
新課程認(rèn)為,把知識(shí)結(jié)論告訴學(xué)生,不如設(shè)計(jì)活動(dòng)讓學(xué)生在探索中獲得;把技能要點(diǎn)告訴學(xué)生,不如設(shè)計(jì)活動(dòng)讓學(xué)生在實(shí)踐中獲得;把感受體會(huì)告訴學(xué)生,不如設(shè)計(jì)活動(dòng)讓學(xué)生在體驗(yàn)中獲得。 在本堂課設(shè)計(jì)的三個(gè)活動(dòng)中有繪圖對(duì)比、討論交流、實(shí)驗(yàn)觀察、動(dòng)手操作、反思提升,要求每個(gè)學(xué)生參與,讓學(xué)生在解決問題的過程中獲得不同程度的成就感,避免了上課熱鬧、課后糊涂,提高了課堂效率。

