新型骨顯像劑99Tcm-HBIDP的制備與初步生物學性質
王立勤,邱 玲,林建國,南蓓蓓,羅世能,馬海霞,黃 潔
1.西北大學 化工學院,陜西 西安 710069;2.江蘇省原子醫學研究所,衛生部核醫學重點實驗室,江蘇省分子核醫學重點實驗室,江蘇 無錫 214063
放射性核素骨顯像已成為臨床診斷和研究骨質病變最為普遍的技術手段之一[1]。20世紀70年代中期,骨掃描代替了X射線用以研究骨質病變,它能夠比X射線提早幾個月探測到某些骨質病變的發生。Subramanian等[2]對99Tcm-MDP和其它99Tcm標記的骨顯像劑進行了詳細的對比,認為99Tcm-MDP用于骨顯像效果最佳。然而99Tcm-MDP作為骨顯像劑也存在不足之處,比如給藥后2~6 h,骨掃描效果才比較好[3]。縮短給藥后掃描等待時間可以減輕病人的負擔,這就要求放射藥物對骨質有更高的親和力。在其后30多年里,科研工作者不斷將雙膦酸結構優化后進行99Tcm標記,以發展性能優異的新型骨顯像劑[1,3-4]。
雙膦酸以含P—C—P鍵為特征,側鏈由R1和R2構成。改變兩個側鏈R1和R2的結構,極大地豐富了雙膦酸的結構,為尋求更優秀的雙膦酸提供了可能。側鏈R1和R2決定了雙膦酸的藥理特性[5-7]。R1為羥基,提高了雙膦酸對骨質的親和力。R2的性質對于提高雙膦酸抑制骨再吸收能力至關重要。R2為含氮氨烷基或含氮雜環、R1為羥基的雙膦酸的治療效果更好。帕米膦酸(pamidronate)的烷基鏈上有1個伯胺氮原子,其效能是不含氮原子的依替膦酸(etidronate)效能的10到100倍[6]。大多數的第三代雙膦酸R2為含有1個或2個氮原子的雜環。唑來膦酸(1-羥基-2-(1H-咪唑-1-基)乙烷-1,1-雙膦酸,Zoledronic acid)是目前綜合治療效果最佳的雙膦酸,它的效能至少是帕米膦酸的100倍或者是依替膦酸的1 000倍[8]。
為了尋找新型品優雙膦酸骨顯像劑,本課題組進行了大量嘗試,陸續制備了99Tcm標記的雙膦酸,包括99Tcm-ZL[9]、99Tcm-MIDP[10]、99Tcm-EIDP[11]、99Tcm-PIDP[12]和99Tcm-EMIDP[13],探索了它們作為骨顯像劑的可能性。結果表明,這些標記物有良好的生物學性質,注射藥物后1~2 h可以給出清晰的全身兔骨顯像,是潛在的骨顯像劑。為了尋找新型性能更加優異的骨顯像劑,本工作擬合成一種新型雙膦酸,即1-羥基-2-(1-丁基-1H-咪唑-2-基)亞乙基-1,1-雙膦酸(HBIDP),并用99Tcm進行標記,測定99Tcm-HBIDP的脂水分配系數和血漿蛋白結合率,比較99Tcm-HBIDP與99Tcm-ZL小鼠體內分布的差異。
1 實驗部分
1.1 試劑和儀器
1-丁基咪唑(純度為99%),上海邦成化工有限公司;其他試劑均為分析純,無需提純,可直接使用,國藥集團上海化學試劑有限公司。
Yanaco MP-500熔點儀,日本島津公司;Elementar Varil EL Ⅲ型元素分析儀,德國Elementar公司;TENSOR27型傅里葉變換紅外光譜儀,德國Bruker光譜儀器公司;Waters Platform ZMD4000型質譜儀,美國Waters公司;Bruker DRX-500型核磁共振儀,德國Bruker光譜儀器公司;Waters 600型高效液相色譜儀,美國Waters公司;HPLC柱,SinoChrom ODS-BP,PN:E2117215-080108,4.6 mm×250 mm×10 μm,大連依利特分析儀器有限公司,Cd(Te)檢測器,美國Perkin Elmer公司;PackardCobra型自動γ計數器,美國Victoreen公司。
ICR小鼠,18~20 g,上海斯萊克實驗動物有限公司。
1.2 1-羥基-2-(1-丁基-1H-咪唑-2-基)亞乙基-1,1-雙膦酸(6)(HBIDP)的合成
按圖1所示,原料1-丁基咪唑(1)經五步反應,合成了目標化合物1-羥基-2-(1-丁基-1H-咪唑-2-基)亞乙基-1,1-雙膦酸(6)。詳細合成方法參見文獻[14-15]。
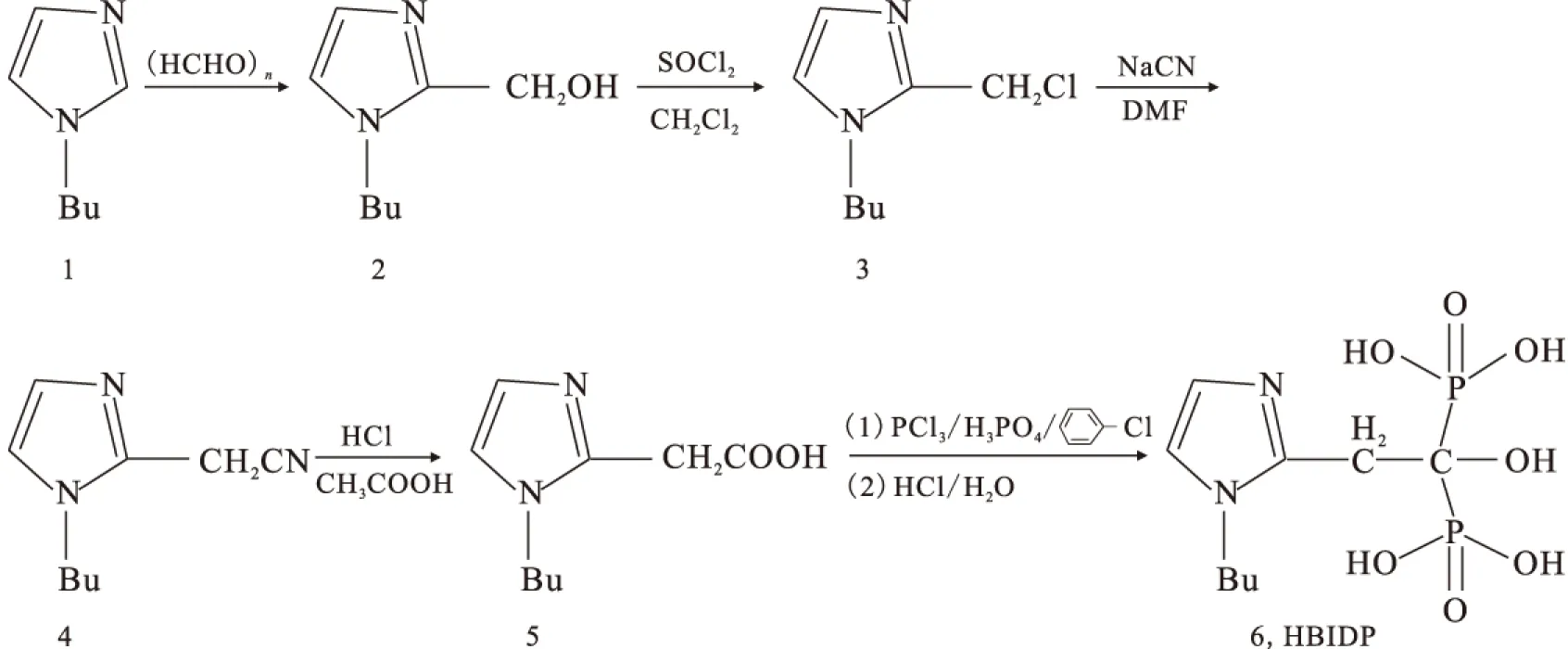
圖1 HBIDP的合成路線
1.3 99Tcm-HBIDP的制備
配體溶液的配制:將250 mg HBIDP加入到5 mL 0.02 mol/L NaOH溶液中使之溶解,其質量濃度為50 g/L,pH≈6。
SnCl2·2H2O溶液的配制:準確稱量10 mg SnCl2·2H2O置于干凈的西林瓶中,加入0.5 mol/L HCl 10 mL,將其溶解完全,其質量濃度為1 g/L。此溶液需現配現用。
向10 mL西林瓶中依次加入一定體積的50 g/L雙膦酸鈉鹽溶液、一定體積的1 g/L SnCl2·2H2O鹽酸溶液,一定量的Na99TcmO4溶液,再加入pH=6的磷酸鹽緩沖溶液(PBS),控制總體積為2 mL,渦旋振蕩器充分振蕩混勻,室溫(25±1)℃下反應一定時間即標記完畢。
1.4 標記率和放化純的測定方法
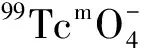
1.5 最佳標記條件的選擇
1.5.1pH值對放化純的影響 向12個西林瓶中各加入100 μL 50 g/L HBIDP的鈉鹽溶液、100 μL 1 g/L SnCl2·2H2O的鹽酸溶液、55.5 MBq新鮮淋洗的Na99TcmO4洗脫液,分別用pH為1至12的磷酸鹽緩沖液將其定容至2 mL,渦旋混合器充分混勻后開始計時,室溫(25±1)℃下反應20 min用TLC法測定各個體系的放化純。
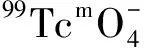
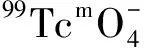
1.5.4配體用量對放化純的影響 向10個西林瓶中分別加入含有2.0、2.5、3.0、3.5、4.0、4.5、5.0、6.0、8.0、10.0 mg HBIDP的鈉鹽溶液,再逐個加入100 μL 1 g/L SnCl2·2H2O的鹽酸溶液,新鮮淋洗的Na99TcmO4洗脫液55.5 MBq,用pH=6的磷酸鹽緩沖液將其定容至2 mL,渦旋混合器充分混勻后開始計時,室溫(25±1)℃下反應20 min后用TLC法測定各個體系的放化純。
1.5.5反應時間對放化純的影響 向西林瓶中加入100 μL 50 g/L HBIDP的鈉鹽溶液,100 μL 1 g/L SnCl2·2H2O的鹽酸溶液,新鮮淋洗的Na99TcmO4溶液(55.5 MBq),用pH=6的磷酸鹽緩沖液將其定容至2 mL,渦旋混合器充分混勻后開始計時,室溫(25±1)℃下反應,在30 min之內,每5 min取樣1次測定不同時間下的放化純。
1.6 脂水分配系數
將磷酸鹽緩沖液與正辛醇超聲振蕩混合,使兩相互相飽和后分離貯存備用。
取2支放敏管,編為1號與2號,向二者均加入飽和的1.0 mL正辛醇和1.0 mL磷酸鹽緩沖溶液,其中向1號管所加磷酸鹽緩沖液pH=7.0,向2號管所加磷酸鹽緩沖液pH=7.4,然后向兩支管中均加入100 μL99Tcm-HBIDP溶液(約1.85 MBq),室溫下渦旋混合器混合振蕩2 min,然后離心5 min(4 000 r/min),以保證兩相完全分離,兩相各取100 μL測其放射性計數。計算脂水分配系數lgP=lg(有機相放射性計數/水相放射性計數)。
1.7 血漿蛋白結合率
分別配制質量濃度為100 g/L和250 g/L的三氯乙酸;取新鮮肝素抗凝血漿2 mL(江蘇省原子醫學研究所附屬江原醫院提供),于4 ℃冰箱保存備用。
取3支放敏管,各加入100 μL血漿和100 μL99Tcm-HBIDP溶液(約55.5 kBq),37 ℃水浴孵育2 h。給每管加入250 g/L三氯醋酸1 mL,以使血漿蛋白沉淀。上層清液和沉淀離心分離5 min(2 000 r/min),收集上清液。向沉淀中加入100 g/L的三氯醋酸1 mL,渦旋混合器混勻,離心5 min(2 000 r/min),收集上清液。此步驟重復操作3次。分別測定沉淀的放射性計數和上清液的放射性計數,計算血漿蛋白結合率=沉淀物放射性計數/(沉淀物放射性計數+上清液放射性計數)×100%。
1.8 99Tcm-HBIDP在小鼠體內分布實驗
ICR小鼠35只,隨機分為7組,每組5只,每只小鼠尾靜脈注射200 μL新配制的99Tcm-HBIDP(約7.4 MBq),分別于注射后5、10、15、30、60、120、240 min時斷頸處死,先用一次性定量采血管取200 μL頸動脈血液,后解剖取心、肝、脾、肺、腎、大腿骨、關節、肌肉、腦等組織,稱重,用γ計數儀測定放射性計數,同時測定標準液的放射性計數,分別計算各臟器每克組織的攝取量(%ID/g)。
2 結果與討論
2.1 HBIDP的合成
HBIDP的合成反應前半步屬于膦酰化反應,三氯化磷對于反應的順利進行十分必要,沒有三氯化磷反應不能進行[16]。該反應是一個強烈的放熱反應,同時放出大量氯化氫氣體。當三氯化磷加入速度過快時,體系內溫度快速升高,反應異常劇烈,瞬間產生大量氣體,容易造成危險,同時造成產物產率低下。通過控制三氯化磷的滴加速度和加料時油浴溫度(70~80 ℃),既可以使反應較快進行,又不致因反應劇烈放熱和放出氣體使體積迅猛膨脹而發生危險,從而保證了反應平穩順利進行。由于該反應是非均相反應,產率一般在40%~60%[7]。據文獻[17]報道,若用甲磺酸做溶劑,整個反應過程保持均相反應,收率可達到90%,但后處理不如用氯苯簡單方便,且后者更廉價。
本實驗所得目標物HBIDP,收率:50.0%;熔點:140~145 ℃;元素分析:實測值(理論值)C 32.89%(32.94%),H 5.61%(5.53%),N 8.49%(8.54%);IR(KBr,cm-1):3 155(s),2 962(s),2 875(s),2 318(br,w),1 598(m),1 520(m),1 467(w),1 164(s),985(s);ESI-MS,m/z(%):329(100)=M+1;1H NMR(400 MHz,D2O,δ):7.31(d,1H,ring-H),7.26(d,1H,ring-H),4.21(t,2H,N—CH2),3.58(t,2H,JH-P=12 Hz,CH2C—P),1.81(m,2H,N—CH2CH2),1.32(m,2H,—CH2CH3),0.91(t,3H,—CH3)。
2.2 99Tcm-HBIDP的放射化學純度
圖2 Na99TcmO4(a)和99Tcm-HBIDP(b)的HPLC譜圖分析
2.3 最佳標記條件
圖3 pH對99Tcm-HBIDP放化純的影響
2.3.1pH值對放化純的影響結果 pH對放化純的影響示于圖3。從圖3可以看出,放化純對體系pH值變化很敏感。pH≈6時,放化純最高,達到95%以上;pH大于7或小于2時,放化純急劇下降,并小于90%。氯化亞錫在中性水溶液易分解生成沉淀,與堿作用生成水和氧化物沉淀,但堿量過剩時,生成能溶解的亞錫酸鹽,均會使還原性大大降低甚至消失。但酸性太強時,放化純也會明顯下降。這可能是因為強酸性條件下,大量質子存在抑制了配位反應的發生。據此,選擇pH=6作為標記反應條件。
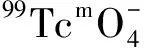
圖4 氯化亞錫用量對99Tcm-HBIDP放化純的影響
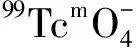
圖5 活度對99Tcm-HBIDP放化純的影響
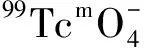
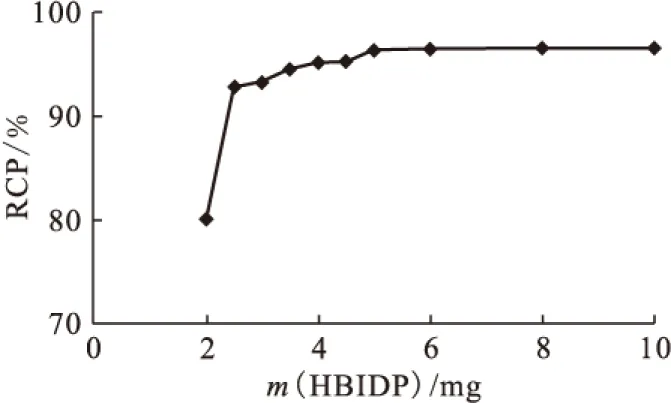
圖6 配體用量對99Tcm-HBIDP放化純的影響
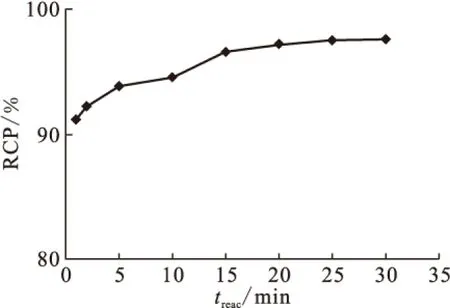
圖7 反應時間對99Tcm-HBIDP放化純的影響
2.3.5反應時間對放化純的影響 反應時間(treac)對放化純的影響示于圖7。從圖7可以看出,時間對放化純的影響較小。1 min內放化純已達90%,說明此反應十分迅速。15 min時RCP已達95%,時間再延長,標記率略有上升。為了縮短制備放射藥物的時間,15 min已經可以滿足使用要求。

2.4 99Tcm-HBIDP的體外穩定性
標記物良好的體外穩定性是放射性藥物能被應用的前提。將99Tcm-HBIDP置于室溫(25±1)℃下,分別于標記后1、2、3、4、5、6 h時取樣測定放化純。其結果示于圖8。由圖8可知,6 h時放化純大于90%,這說明99Tcm-HBIDP的體外穩定性較好,滿足使用要求。
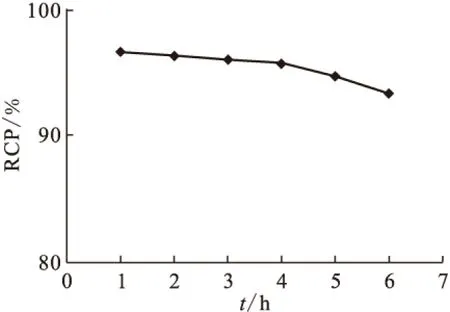
圖8 99Tcm-HBIDP的體外穩定性
2.5 99Tcm-HBIDP的脂水分配系數
99Tcm-HBIDP在pH為7.0和7.4時,脂水分配系數lgP分別為-2.17和-2.28,表現出很強的親水性。對骨顯像藥物而言,親水性越好,單位質量的藥物在軟組織中的吸收將會相對下降,靶向組織(骨骼)中的攝取相對增加,有利于發揮藥物的顯像作用。
2.6 99Tcm-HBIDP的血漿蛋白結合率
99Tcm-HBIDP的血漿蛋白結合率為(31.41±1.25)%。99Tcm-ZL血漿蛋白結合率為17.40%[9]。前者血漿蛋白結合率高于后者,可能是分子中含有親脂性丁基,增加了其與蛋白的結合能力,從而使其血漿蛋白結合率增大。
2.7 99Tcm-HBIDP在小鼠體內分布實驗
99Tcm-HBIDP小鼠體內分布實驗結果列于表1。從表1可以看出,99Tcm-HBIDP主要集中在骨、關節和腎中,并且在骨中有高度選擇性的攝取。99Tcm-HBIDP在注射5 min后,在骨和關節中的攝取分別達到了(4.76±0.37)%ID/g和(11.55±0.85)%ID/g,并且逐漸增加,在30 min時達到最高,分別為(9.07±0.97)%ID/g和(30.12±2.36)%ID/g。隨著時間的延長,其在骨和關節中的吸收有所下降,但是在240 min時仍分別高達(6.83±0.14)%ID/g和(18.96±1.87)%ID/g,而藥物在心、肝、脾、肺等器官組織中已經基本清除完畢。99Tcm-HBIDP在腎臟和血液中的攝取隨時間延長而快速下降,表明此藥物主要經過腎臟代謝,經由泌尿系統排出體外。隨著時間的延長,骨攝取與心、肝、脾、肺、血液中攝取的比值快速升高,有利于降低顯像本底,提高骨顯像質量。圖9給出了99Tcm-HBIDP和99Tcm-ZL(其小鼠分布數據可參考文獻[9])不同時刻骨、心、肝和脾器官組織中的攝取值的對比。前者在骨中攝取60 min內高于后者。在240 min內99Tcm-HBIDP在心、肝和脾器官組織中的攝取遠低于99Tcm-ZL,表明99Tcm-HBIDP對這些重要臟器的傷害較小。總之,99Tcm-HBIDP有望成為新型骨顯像劑。
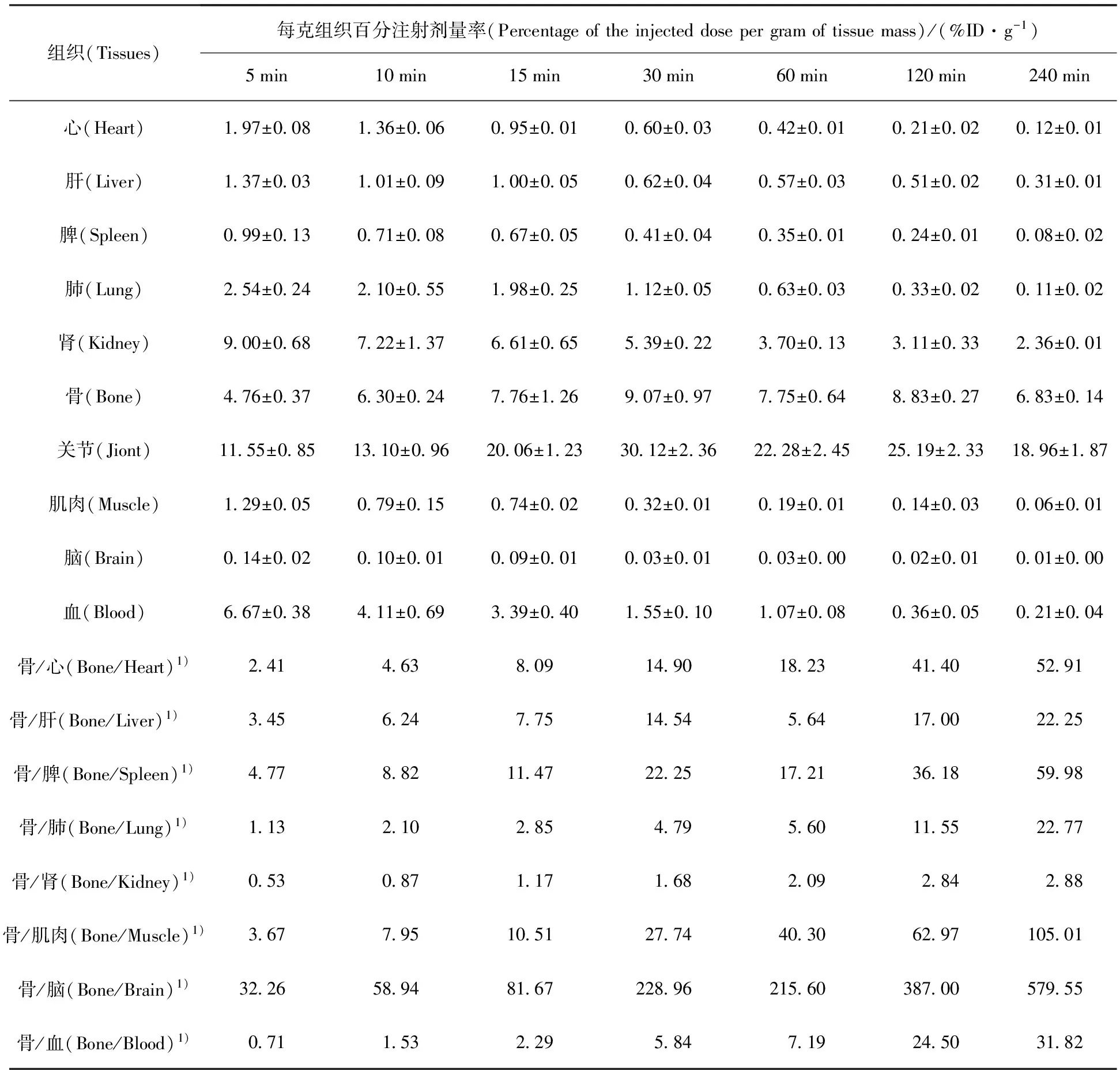
表1 99Tcm-HBIDP小鼠體內分布
注(Note):1)量綱為1(Unit is 1)
2)n=5
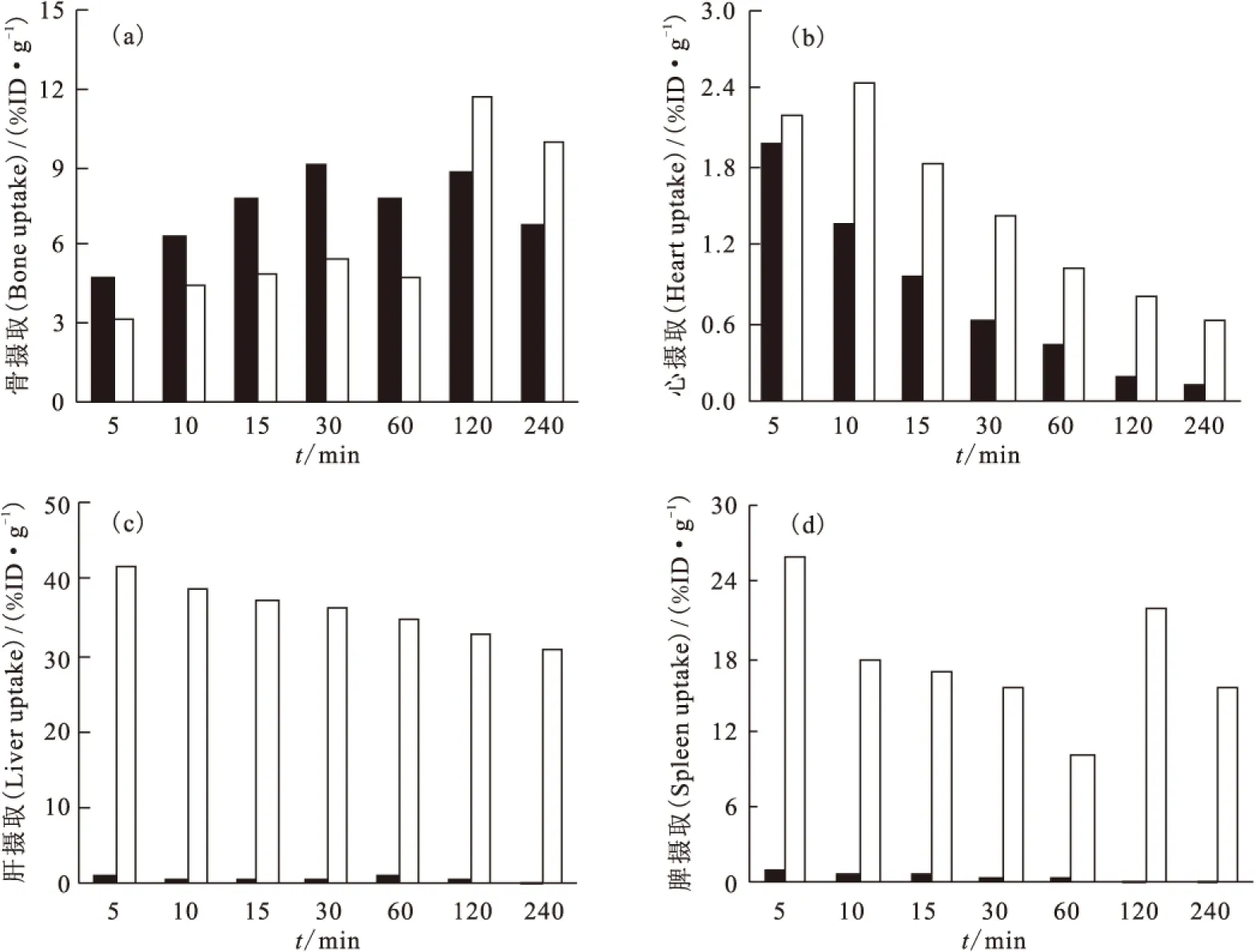
圖9 99Tcm-HBIDP和99Tcm-ZL不同時刻的小鼠體內分布
3 結 論
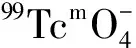
[1]Vbrbeke K,Rozenski J,Cleynhens B,et al.Deve-lopment of a Conjugate of99Tcm-EC With Aminomethylenediphosphosphonate in the Search for a Bone Tracer With Fast Clearance From Soft Tissue[J].Bioconjugate Chem,2002,13 (1): 6-22.
[2]Subramanian G,Mcafee J G,Blair R J,et al.Technetium-99m-Methylene Diphosphonate-A Superior Agent for Skeletal Imaging: Comparison With Other Technetium Complexes[J].J Nucl Med,1975,16 (8): 744-755.
[3]Ogawa K,Mukai T,Inoue Y,et al.Development of a Novel99Tcm-Chelate-Conjugated Bisphosphonate With High Affinity for Bone as a Bone Scintigraphic Agent[J].J Nucl Med,2006,47 (12): 2 042-2 047.
[4]Fogelman I,Pearson D W,Bessent R G,et al.A Comparison of Skeletal Uptakes of Three Diphosphonates by Whole-Body[J].J Nucl Med,1981,22: 880-883.
[5]Russell R G G,Croucher P I,Rogers M J.Bisphosphonates: Pharmacology,Mechanisms of Action and Clinical Uses[J].Osteoporosis Int Suppl,1999,2: S66-80.
[6]Russell R G G,Rogers M J.Bisphosphonates: From the Laboratory to the Clinic and Back Again[J].Bone,1999,25 (1): 97-106.
[7]Widler L,Jaeggi K A,Glatt M.Highly Potent Geminal Bisphosphonates.From Pamidronate Disodium (Aredia)to Zoledronic Acid (Zometa)[J].J Med Chem,2002,45 (17): 3 721-3 738.
[8]Smith M R.Osteoclast Targeted Therapy for Prostate Cancer: Bisphosphonates and Beyond[J].Urol Oncol-Semin Ori,2008,26: 420-425.
[9]Lin Jiangguo,Qiu Ling,Cheng Wen,et al.Preparation andinVivoBiological Investigations on a Novel Radioligand for Bone Scanning: Technetium-99m-Labeled Zoledronic Acid Derivative[J].Nucl Med Biol,2011,38(5): 619-629.
[10]羅世能,王洪勇,謝敏浩,等.99Tcm- MIDP 的制備及其生物學分布[J].中華核醫學雜志,2005,25(6):341-343.
[11]牛國塞,羅世能,嚴孝紅,等.99Tcm-EIDP的制備及生物學分布[J].核技術,2008,31(9):698-701.
[12]Chen Chuanqing,Luo Shineng,Lin Jianguo,et al.Preparation and Biodistribution of99Tcm-PIDP as Bone Imaging Agent[J].Nucl Sci Technol,2009,20 (5): 302-306.
[13]Lin Jianguo,Luo Shineng,Chen Chuanqing,et al.Preparation and Preclinical Pharmacological Study on a Novel Bone Imaging Agent99Tcm-EMIDP[J].Appl Radiat Isot,2010,68: 1 616-1 622.
[14]南蓓蓓,邱玲,林建國,等.兩種新型1-烷基咪唑類雙膦酸的合成和表征[J].化學試劑,33(11):971-974.
[15]Guo Xuehua,Luo Shineng,Wang Hongyong,et al.Study on the Preparation and Biodistribution of99Tcm-HMIBP[J].Nucl Sci Tech,2006,17 (5): 285-288.
[16]Prentice J B,Quimby O T,Grabenstetter R J,et al.Interaction of Acylating Agents and Phosphorus (Ⅲ)Sources.I.Intermediacy of Condensed Species in the Formation of Ethane-1-Hydroxy-1,1-Diphosphonic Acid[J].J Am Chem Soc,94 (17): 6 119-6 124.
[17]Kieczykowski G R,Jobson R B,Melillo D G.Preparation of (4-Amino-1-Hydroxybutylidene)Bisphosphonic Acid Sodium Salt,MK-217(Alendronate Sodium).An Improved Procedure for the Preparation of 1-Hydroxy-1,1-Bisphosphonic Acids[J].J Org Chem,1995,60 (25): 8 310-8 312.

