慢性神經病理性疼痛對大鼠脊髓背角miRNA表達的影響
李敏娜,申 樂,黃宇光
(中國醫學科學院北京協和醫學院北京協和醫院麻醉科,北京100730)
慢性神經病理性疼痛對大鼠脊髓背角miRNA表達的影響
李敏娜,申 樂,黃宇光*
(中國醫學科學院北京協和醫學院北京協和醫院麻醉科,北京100730)
目的 篩選慢性神經病理性疼痛大鼠脊髓背角差異表達的miRNA,并預測其調控的靶基因。方法 建立大鼠坐骨神經慢性壓迫損傷CCI模型,在術后疼痛高峰期取腰膨大脊髓背角,用miRNA芯片篩選CCI大鼠差異表達的miRNAs,再用熒光實時定量RT-PCR驗證差異表達的miRNAs,并利用MIRANDA、TARGETSCAN、PICTAR 3個數據庫找出這些miRNA可能調控的靶基因。結果 CCI大鼠表達上調的有miR-99b,表達下調的有miR-674-3p、miR-879與miR-325-5p。RT-qPCR驗證結果與芯片基本相符。預測這些miRNA可能的靶基因約26個,這些基因功能廣泛。結論 慢性神經病理性疼痛可導致miRNA的表達發生變化,這些miRNA及其調控的靶基因為進一步研究奠定了基礎。
慢性疼痛;微小RNA;芯片;熒光實時定量PCR;脊髓背角
微小RNA(microRNA,miRNA)是一種內源性非編碼單鏈小分子RNA,約18~25個核苷酸,可通過堿基配對與mRNA分子相結合來直接降解mRNA或抑制其翻譯,從而在轉錄后水平使基因沉默[1-2]。miRNA參與早期發育、細胞增殖、細胞死亡和細胞分化等重要生命進程[3]。miRNA在神經系統的分化、發育、決定細胞命運方面有重要作用。miRNA可在突觸部位選擇性聚集或缺失,調節突觸局部的基因表達和蛋白合成,影響神經細胞的突觸可塑性[4]。有研究者發現炎性反應疼痛小鼠神經系統miRNA表達水平發生變化,推測在疼痛的發生機制中miRNA可能發揮了重要作用[5-6]。本研究旨在通過miRNA芯片和實時定量PCR篩選發現慢性神經病理性疼痛大鼠脊髓背角組織中差異表達的miRNA,分析其對慢性疼痛相關信號傳導可能產生的影響,以初步探索miRNA在慢性疼痛的分子生物學機制中所發揮的作用。
1 材料與方法
1.1 CCI大鼠模型的建立
24只SPF級SD雄性大鼠[北京維通利華實驗動物技術有限公司,經營許可證編號:SCXK(京)20022003],體質量 180~200 g,隨機均分為對照(control)組、假手術(sham)組和慢性神經病理性疼痛(CCI)組。按文獻[7]的方法制作坐骨神經慢性壓迫損傷(chronic constrictive injury,CCI)模型,在坐骨神經分成三支前的主干部位距神經起始處上方2 mm用4-0羊腸線結扎坐骨神經4道,每道間隔約1 mm,結扎的松緊度以打結時可見肌肉輕微抽動為準。以電子Von Frey刺激針(NC 12775-99 Touch Test Evaluator Set 20,North Coast公司)刺激大鼠足底,大鼠會出現抬足、縮足、快速甩足以及甩足后舔足等反應,每只大鼠刺激3次,間隔大于10 s,將3次平均值作為機械縮足反射閾值(mechanical withdrawal threshold,MWT)。將RCY-2熱板測痛儀(上海市益聯科技設備有限公司)水浴箱預熱至52±0.3℃,測量大鼠從后足接觸熱板起到發生縮足反射潛伏期(paw withdrawal thermal latency,PWTL)。測量3次取平均值,作為熱刺激傷害感受閾。于術前及術后第3、5和7天測量機械縮足反射閾值及熱刺激傷害感受閾值。術后7 d取大鼠腰膨大手術側脊髓背角,立即放入液氮冷卻5~10 min后放入-80℃冰箱保存。
1.2 RNA提取
根據Invitrogen公司說明書,用Trizol法提取組織RNA,紫外分光光度儀定量后,用2%瓊脂糖電泳鑒定RNA質量。
1.3 miRNA芯片篩選
CCI組、sham組和control組中各隨機選取3個樣本進行芯片實驗(n=3)。選用Exiqon microRNA芯片V11.0版本(上海康成生物技術有限公司),包含所有物種 miRNA 6396個探針。先用 miRCURYTM Array Labelling kit(Exiqon公司,cat 208032)標記miRNA,用 RNeasy Mini Kit(Qiagen公司,cat 74104)濃縮標記樣本,再將miRNA芯片雜交。應用Genepix 4000B進行圖像掃描,用635 nm激發,用Genepix Pro 6.0分析數據。
1.4 熒光實時定量PCR驗證芯片結果
根據文獻[8]的Stem-loop法進行miRNA的反轉錄-熒光實時定量PCR。相應的引物見表1。按照PrimeScriptTM RTreagentkit(Takara公司DRR037A),42 ℃ 15 min反轉錄,85 ℃ 15 s終止反應,冰上冷卻,合成cDNA第一鏈。根據Takara公司說明書配制20 μL/體系,各樣品對應miRNA和U6內參兩組,每個反應設3個平行孔,PCR反應在ABI 7500儀器進行。
1.5 生物信息學分析
應用 miRNA靶基因預測軟件 Pictar、Targetscan、MiRbase、MiRanda 在線服務站點,輸出差異表達miRNA的預測靶基因,取至少3個軟件預測到的基因作為靶基因。
1.6 統計學分析
用SPSS 11.5軟件進行統計學分析,計量資料經以均數±標準差(±s)表示,兩組樣本均數間的比較用t檢驗,多組樣本間均數的比較用方差齊性檢驗和方差分析。
2 結果
2.1 CCI成功建模
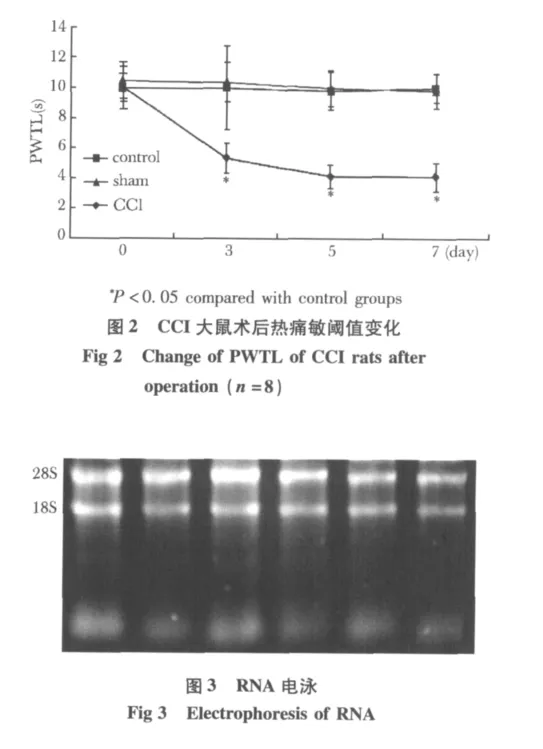
CCI大鼠術后3~5d,手術側足趾并攏輕度外翻,行走無力,步態跛行,經常左后足懸空或不敢著地;站立時以右后肢持重,左后肢抬起并緊貼于腹部,CCI大鼠無發生自噬肢體現象。CCI組大鼠術后第3天手術側機械性痛閾明顯低于非手術側,也明顯低于sham組和control組,第7天達到最低值(圖1)。CCI組大鼠自術后第3天患足熱痛敏閾值顯著下降,與術前基礎值和sham組及control組相比有顯著性差異(圖2)。

表1 Real-time PCR引物序列Table 1 Primer sequence for real time PCR
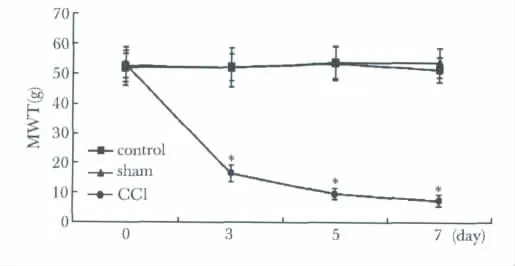
圖1 CCI大鼠術后機械性痛閾值變化Fig 1 Change of the MWT of CCI rats after operation(n=8)
2.2 總RNA質量鑒定
提取各組大鼠脊髓背角總RNA,測A260/A280,均為1.8~2.1,行瓊脂糖凝膠電泳顯示28S和18S條帶清晰,28S的亮度大約是18S亮度的兩倍(圖3),說明提取的總RNA完整,質量較好,可用于芯片實驗以及熒光實時定量RT-PCR。
2.3 miRNA芯片篩選
分別將CCI、sham和control組(n=3)大鼠脊髓背角提取的RNA經過標記,雜交,再掃描將圖像信號轉化為數字信號,用配套軟件對原始數據進行分析運算。
根據芯片結果比較分析CCI與sham、control組差異表達的miRNA,共同上調的有miR-99b,共同下調的有 miR-325-5p、miR-674-3p、miR-879(變化倍數>1.5或 <0.6,均P<0.05)(表2)。

表2 CCI大鼠差異表達的miRNAsTable 2 Differently expressed miRNAs of CCI rats(n=3)
2.4 熒光實時定量PCR驗證芯片結果
miRNA的real-time RT-PCR產物約65 bp,U6的產物約90 bp(圖4)。熒光實時定量PCR擴增結果與芯片結果基本一致,其中miR-99b、miR-674-3p、miR-879 CCI組與sham組和control組有顯著性差異,表明本實驗的miRNA芯片結果基本可靠(圖5)。
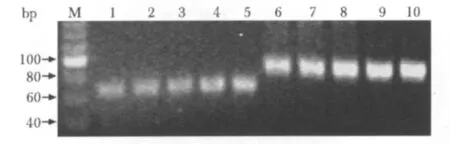
圖4 熒光實時定量RT-PCR產物電泳Fig 4 Electrophoresis of real time RT-PCR products
2.5 靶基因預測
4個miRNA共找到潛在的靶基因26個(表3),這些基因功能廣泛,涉及信號傳導、轉錄調控、細胞周期、細胞生長和凋亡、細胞骨架、細胞黏附、細胞運動以及能量代謝等各個方面。
3 討論
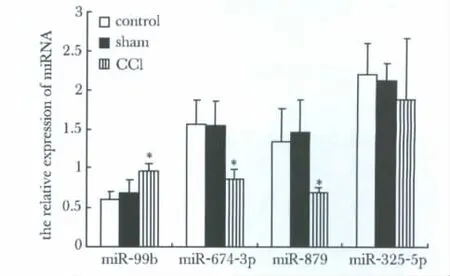
圖5 Real-time PCR驗證CCI大鼠差異表達的miRNAsFig 5 Real-time PCR test and verify the differently expressed miRNAs of CCI rats(n=8)
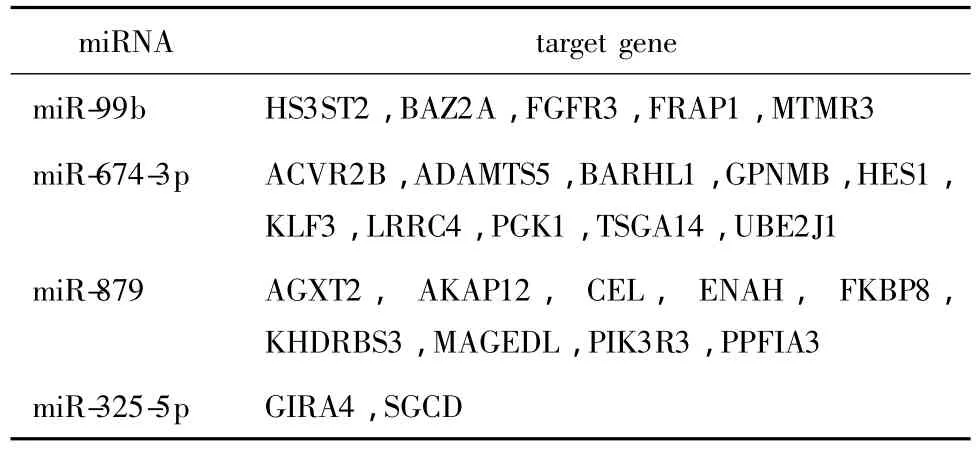
表3 預測差異表達miRNA的靶基因Table 3 Predict the target genes of the differently expressed miRNAs
神經病理性疼痛的發病機制至今未明,目前仍缺乏有效的治療措施,因此進一步探求發病機制尤為重要。許多研究發現miRNAs與調節生物生長、發育,疾病發生過程密切相關[3]。miRNA可以調節突觸局部的基因表達和蛋白合成,影響神經細胞突觸可塑性[4],炎性疼痛模型小鼠前額葉皮質miRNA表達水平發生顯著變化[5],背根神經節miR-143表達水平顯著下降[9],提示miRNA可能成為研究疼痛機制的新領域。但目前神經病理性疼痛相關miRNA的研究相對很少。本研究利用miRNA芯片和real-time PCR的方法對慢性壓迫性損傷CCI大鼠脊髓背角組織miRNA的表達水平進行分析,發現表達上調的有miR-99b,表達下調的有miR-325-5p、miR-674-3p、miR-879。其中miR-99b曾在大鼠和小鼠的大腦皮質神經元克隆和測序中被發現[10],并且在人胚胎干細胞向血管內皮細胞分化過程中可能起重要作用[11],子宮內膜異位癥組織的miR-99b也表達上調[12]。miRNA的功能主要是抑制靶基因的表達,因此本研究預測了這些差異表達的4個miRNA對應的26個靶基因,這些基因功能廣泛,涉及信號傳導、轉錄調控、細胞周期、細胞生長、凋亡、細胞黏附、細胞運動以及能量代謝等各個方面。這些靶基因中,LRRC4是富亮氨酸重復(leucine rich repeats,LRR)超家族的新成員,是神經系統發育與軸突生長的功能基因,能夠下調一系列神經生長因子或受體的表達,可以調控多種信號傳導通路,調節突觸發育的各個方面,包括軸突-樹突聯系的建立、早期突觸形成和突觸成熟[13]。
綜上所述,本研究首次以miRNA芯片技術對慢性神經病理性疼痛的表達譜進行研究,發現CCI大鼠脊髓背角miRNA表達發生變化,預測這些差異表達miNA的靶基因,這些miRNA及其調控的靶基因可能為今后的神經病理性疼痛研究提供新的思路。
[1]Rácz Z,Kaucsár T,Hamar P,et al.The huge world of small RNAs:regulating networks of microRNAs[J].Acta Physiol Hung,2011,98:243-251.
[2]Eulalio A,Huntzinger E,Izaurralde E,et al.Getting to the root of miRNA-mediated gene silencing[J].Cell,2008,132:9-14.
[3]Hobert O.Gene regulation by transcription factors and microRNAs[J].Science,2008,319:1785-1786.
[4]Zeng Y.Regulation of the mammalian nervous system by microRNAs[J].Mol Pharmacol,2009,75:259-264.
[5]Poh KW,Yeo JF,Ong WY.MicroRNA changes in the mouse prefrontal cortex after inflammatory pain[J].Eur J Pain,2011,15:11-12.
[6]Niederberger E,Kynast K,L?tsch J,et al.MicroRNAs as new players in the pain game[J].Pain,2011,152:1455-1458.
[7]Bennett GJ,Xie YK.A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man[J].Pain,1988,33:87-107.
[8]Caifu C,Dana AR,Adam JB.Real-time quantification of microRNAs by stem-loop RT-PCR[J].Nucl Acid Res,2005,33:e179.
[9]Tam S,Bastian I,Zhou XF,et al.MicroRNA-143 expression in dorsal root ganglion neurons[J].Cell Tissue Res,2011,346:163-173.
[10]Eric AM,Ezequiel AS.Microarray analysis of microRNA expression in the developing mammalian brain[J].Genome Biology,2004,5:68-69.
[11]Kane NM,Howard L,Descamps B,et al.Role of microRNAs 99b,181a,and 181b in the differentiation of human embryonic stem cells to vascular endothelial cells[J].Stem Cells,2012,30:643-654.
[12]Ohlsson TEM,Van der HKH.MicroRNA-regulated pathways associated with endometriosis[J].Mol Endocrinol,2009,23:265-275.
[13]Woo J,Kwon SK,Choi S,et al.Trans-synaptic adhesion between NGL-3 and LAR regulates the formation of excitatory synapses[J].Nat Neurosci,2009,12:428-437.
Effect of chronic neuropathic pain on the expression of microRNA in the spinal dorsal horn of rats
LI Min-na,SHEN Le,HUANG Yu-guang*
(Dept.of Anesthesiology,PUMC Hospital,CAMS& PUMC,Beijing 100730,China)
ObjectiveTo investigate the differentially expressed miRNAs in the spinal dorsal horns of rats with chronic neuropathic pain,and predict the target genes of the miRNAs.MethodsChronic constrictive injury(CCI)rat model was established,and spinal dorsal horns were harvested when a peak pain was achieved on the 7th day post-op.Microarray analysis was applied to investigate the differentially expressed miRNAs in CCI rats,and the screened miRNAs were confirmed by real time RT-PCR.Furthermore,the possible target genes were predicted by three databases.ResultsmiRNA microarray analysis showed the expression of miR-99b as significantly up-regulated,while the expressions of miR-674-3p,miR-879 and miR-325-5p as significantly down-regulated in the spinal dorsal horns of CCI rats compared with those in the sham and control rats.The different expression profiles of the 4 miRNAs were confirmed by quantitative RT-PCR.About 26 target genes were predicted through the 3 databases based on the previous screened miRNAs.ConclusionsChronic neuropathic pain affects the expression of miRNAs.These miRNAs and target genes provide new clues for further research.
chronic pain;miRNA;microarray;real time PCR;spinal dorsal horn
R 338.3
A
1001-6325(2012)09-1044-05
2012-06-19
2012-07-02
國家自然科學基金(30872436)
*通信作者(corresponding author):pumchhyg@yahoo.com.cn

