蝦夷扇貝養殖群體及其子代的遺傳多樣性分析
韓斐斐, 張繼彪, 李 莉, 張國范, 閆喜武
(1. 中國科學院 海洋研究所, 山東 青島266071; 2. 大連海洋大學, 遼寧 大連116023)
蝦夷扇貝養殖群體及其子代的遺傳多樣性分析
韓斐斐1,2, 張繼彪1, 李 莉1, 張國范1, 閆喜武2
(1. 中國科學院 海洋研究所, 山東 青島266071; 2. 大連海洋大學, 遼寧 大連116023)
蝦夷扇貝(Patinopecten(Mizuhopecten)yessoensis)于1982年從日本引進, 在中國已經成為一個很重要的產業。本研究利用微衛星標記, 對獐子島海域2個養殖群體蝦夷扇貝(大耗島、褡褳島), 1個日本野生群體遺傳多樣性進行了評估, 并對 2個養殖群體的群體內繁育和群體間雜交后代進行了遺傳和生長檢測。結果表明:養殖群體與日本野生群體相比, 其遺傳多樣性沒有顯著降低, 養殖群體遺傳多樣性較高, 養殖狀況暫時良好。TL群體和DH群體遺傳距離很近, DH、TL群體和RB群體的遺傳距離遠大于TL群體和DH群體間的遺傳距離。說明2個養殖蝦夷扇貝群體遺傳分化較小。分別對4個子代群體的殼長、殼高在幼苗培育第1、5、10、15、20、100、190天進行測量, 結果表明生長性狀差異不顯著。4個子代群體的遺傳多樣性差異也不顯著, 說明養殖群體的遺傳背景不清楚, 種質資源混交較嚴重。本研究結果反映了我國蝦夷扇貝種質資源評估狀況, 并為蝦夷扇貝的健康養殖提供基礎數據。
蝦夷扇貝(Patinopecten(Mizuhopecten)yessoensis); 微衛星; 遺傳多樣性; 雜交; 生長檢測
蝦夷扇貝(Patinopecten(Mizuhopecten)yessoensis)原產于日本海周邊海域如日本、朝鮮、俄羅斯的海參崴等, 為寒溫帶貝類。1982年從日本引進, 并人工育苗獲得成功。我國適宜養殖的海區僅限于黃海北部冷水團能夠覆蓋到的海域, 如遼寧的長山群島,大連沿岸海域, 山東廟島列島的北部諸島及榮成桑溝灣等。其中以大連長海縣養殖規模最大。據漁業年鑒中扇貝產量和蝦夷扇貝所占比例估算, 目前蝦夷扇貝年產量已達30萬t, 年產值達數十億元, 成為中國淺海養殖的支柱性產業, 也是國際上貝類引種養殖最成功的例證之一。
蝦夷扇貝主要有筏式養殖和底播增殖, 所用苗種幾乎全部依賴育苗室的人工培育。自引進后, 蝦夷扇貝以其獨有的性狀優勢為市場所歡迎, 使其養殖規模不斷擴大, 現已成為北方海域海水貝類的主要養殖對象之一[1]。自 1990年以來, 蝦夷扇貝筏式養殖生產規模不斷擴大, 2001~2003年, 蝦夷扇貝增養殖規模進入了鼎盛時期[2]。但近幾年養殖蝦夷扇貝死亡率急劇增加, 在有些海區, 據估算其死亡率已達70%~80%, 與此同時, 育苗穩定性和成功率急劇下降。
自蝦夷扇貝引進中國后, 主要采取人工培育方式進行蝦夷扇貝苗種生產, 近年來在黃海北部到渤海海峽雖然也發現一些天然苗種, 但數量有限且產量不穩定, 養殖生產所用苗種還是主要依靠人工苗種[3]。隨著養殖持續時間的延展, 養殖業規模的不斷擴大, 養殖所面臨的問題也不斷增加, 如育苗難度越來越大, 成功率越來越低, 這不但增加了生產成本, 也影響到產業的健康發展。目前中國蝦夷扇貝人工苗種生產所用親本的來源主要是從自然海區挑選,挑選的標準主要是由有經驗的技術人員檢查待選親本的規格、殼型、肥滿度、性腺等表型情況[4]。另外,為了增加育苗的成功率, 往往有目的隨機挑選兩個不同地點的親貝, 通過群體間雜交的方式進行苗種生產[5]。但是由于對被挑選群體的遺傳背景知之甚少,故這種隨機挑選有很大的盲目性。
目前, 對于群體的遺傳多樣性檢測主要利用微衛星標記。微衛星的開發和利用在蝦夷扇貝中的應用日趨增多。常亞青等[6]用 8對微衛星標記對不同區域的 5個蝦夷扇貝群體進行群體遺傳學分析, 從5個群體的雜合子狀態表明遺傳變異主要存在群體內個體之間。趙瑩瑩等[7]利用磁珠富集法篩選蝦夷扇貝微衛星分子標記, 并在俄羅斯和大連 2個蝦夷扇貝群體中進行遺傳多樣性分析。李春艷等[8]采用新型生物素-磁珠吸附微衛星與同位素雜交相結合的方法篩選微衛星引物, 并對大連地區 3個蝦夷扇貝養殖群體的遺傳結構進行分析。楊璞等[9]用微衛星引物的通用性對櫛孔扇貝(♀)×蝦夷扇貝(♂)進行雜種鑒定。
本研究利用微衛星分子標記, 對某育苗企業用于苗種生產的 2個養殖群體進行雜交和自繁, 以一個日本群體作為參照, 研究了 2個親本群體和子代的遺傳多樣性。并且跟蹤檢測了雜交和自繁后代的生長情況, 以期從遺傳管理的角度, 對蝦夷扇貝的苗種生產給予相應的指導和借鑒。
1 材料與方法
1.1 材料
本實驗用于進行遺傳分析的7個蝦夷扇貝群體,分別是在大連獐子島的特定區域養殖的蝦夷扇貝,大耗島貝(簡稱DH)、褡褳島貝(簡稱TL)、從日本引種的日本貝(簡稱 RB)和大耗島貝與褡褳島貝雙列雜交子代:DH自繁 (WDH), TL♀×DH♂(WDT),DH♀×TL♂(WTD), TL 自繁(WTL)。其中, WDH、WDT、WTD、WTL四個子代用于遺傳分析的是稚貝(生長到190天測量生長指標后取樣)。
其中, 大耗島貝和褡褳島貝分別進行群體內自繁和群體間雜交繁育。從每個群體中選擇雌雄比例為3 :2的性腺發育完全成熟的個體。陰干1 h后將每一個扇貝單獨放入一個 100L的塑料桶中, 加滿14℃的新鮮海水充氣催產。配子期開始計時, 2 h后開始逐一鏡檢排放的配子防止雌雄同體貝影響實驗結果。當每桶卵排放密度達到50個/mL時將親貝取出(保證實驗用量), 分別等量混合每個群體的精和卵, 再把兩個群體的精和卵分別等份分開, 每一群體的卵分別與群體內或群體間雄貝的精液授精, 得到四個交配組合:WDH、WDT、WTD、WTL。群體隨機各取48個樣本。
1.2 基因組DNA的提取
取蝦夷扇貝肌肉, 參照Sambrook等[10]采用常規的酚/氯仿抽提的方法提取DNA。
1.3 微衛星引物來源
使用的10對蝦夷扇貝微衛星引物的序列來源于已發表的引物序列[8,11-14], 詳細信息見表1。引物序列由上海生工生物工程有限公司合成。

表1 蝦夷扇貝微衛星基因座引物序列Tab. 1 Microsatellite primer sequence of Yesso scallop
1.4 生長數據測量
取蝦夷扇貝兩個養殖群體(大耗島 、褡褳島)的雙列雜交子代WDH、WTL、WDT、WTD個體各48個, 在蝦夷扇貝幼蟲培育期的第 1、5、10、15、20天和稚貝期第100、190天, 分別使用顯微鏡和游標卡尺測定其殼長、殼高。其中, 殼長指貝殼前后緣的最大距離, 殼高指殼頂到腹緣的最大距離[15]。獲得的數據, 用Excel和SPSS13.0軟件分析和處理, 差異性顯著分析采用最小顯著差法(Least-Significant difference, LSD)。
1.5 PCR反應和數據分析
PCR 反應體系(15μL):20 ng的基因組 DNA、10×buffer緩沖液(20 mmol/L Mg2+)、0.15 μL Tag 酶、dNTP各0.2 mmol/L、引物各0.3 μmol/L。PCR反應條件:95℃變性5 min; 94℃30 s, 退火30 s, 72℃30 s,30個循環; 72℃延伸10 min, 4℃保存。各對引物的退火溫度見表1。用12%的非變性聚丙烯酰胺(丙烯酰胺和甲叉雙丙烯酰胺體積比為29 :1)凝膠電泳分離PCR反應產物, 電泳液為1×TBE緩沖液, 電壓300 V,電泳 1~2 h(北京六一儀器廠 DYY-Ⅱ型電泳儀,DYCZ-30型電泳槽), Gel-red染色, 利用UVP凝膠成像儀成像。
統計條帶以UVP公司Doc-It Ls Image Analysisi Software軟件為主, 以手工矯正統計輔助。利用POPGENEGENE (VERSION 1.31) 軟件統計微衛星基因座的等位基因數 (Observed number of alleles,Na)、有效等位基因數 (Effective number of alleles,Nea)、觀測雜合度 (Observed heterozygosity,Ho)、期望雜合度 (Expected heterozygosity,He)、遺傳相似系數 (Genetic similarity index,I)、群體間遺傳距離(Genetic Distance,Ds), 并進行多態性信息含量(Polymorphism Information Content, PIC) 分析。
參照 Botstein等[16]的方法計算多態性信息含量(Polymorphism Information Content, PIC):
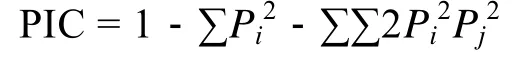
式中,Pi、Pj分別為群體中第i和第j個等位基因頻率,n為等位基因數。
親本數目是影響蝦夷扇貝養殖群體遺傳多樣性的重要指標。根據雜合度的下降來估計有效群體大小 (effective population size,Ne)[17], 公式為:

公式中,Ne是估計有效群體個數;t是世代數;Ht是t代的平均期望雜合度;Ho是親代的平均期望雜合度。在本實驗中,t= 1,Ht是F1群體的雜合度,Ho是親本群體的平均雜合度。
近交系數(inbreeding coefficient,F)是指根據近親交配的世代數, 基因的純化程度。近交率 (ΔF) 公式為:
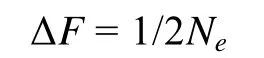
第t代的近交系數 (Ft)[18]公式為:
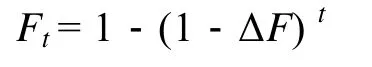
式中,Ne是估計有效群體個數;t是世代數。
2 結果
2.1 生長數據分析
蝦夷扇貝兩個養殖群體(大耗島、褡褳島)的雙列雜交子代WDH、WTL、WDT、WTD的殼長、殼高的幼蟲期第 1、5、10、15、20天和稚貝期第 100、190天測量結果見表2, 結果表明:4個實驗組中, 在幼蟲期1、5日齡時雜交組WDT的殼長、殼高生長快于自繁組WDH和WTL, 但差異不顯著(P>0.05),雜交組WTD殼長、殼高生長慢于兩自繁組; 在幼蟲期10日齡時, 自繁組 WTL的殼長生長快于其他 3個實驗組, 但差異不顯著(P>0.05), WTD殼高生長最快, 與自繁組 WTL差異不顯著(P>0.05), 與其他兩個實驗組差異顯著(P<0.05), 但不明顯。幼蟲期 15和 20日齡時, 雜交組 WDT的殼長、殼高生長快于其他3個實驗組, 15日齡時WDT的生長與其他 3組差異顯著(P<0.05), 20日齡時 WDT與WDH差異不顯著(P>0.05)與其他兩個實驗組差異顯著(P<0.05), 并不十分明顯。在稚貝期100日齡時, 雜交組 WTD生長組快于自繁組差異不顯著(P>0.05), WDT生長最慢與自繁組WTL差異不顯著(P>0.05)與其他兩個實驗組差異顯著(P<0.05); 190日齡時與 100日齡的生長趨勢相近, 即雜交組 WTD生長組快于自繁組差異顯著(P<0.05), WDT生長最慢與自繁組 WTL差異不顯著(P>0.05)與其他兩個實驗組差異顯著(P<0.05); 稚貝期估算的兩群體并無顯著差異。
2.2 PCR擴增反應結果
實驗合成了10對引物, 用每個群體中的8個樣本篩選引物, 引物均能顯示多態性。利用微衛星引物在蝦夷扇貝群體 DH、TL、RB和子代群體 WDH、WTL、WTD、WDT進行 PCR擴增, 都能擴增出特異性條帶(圖1)。其中, 除XY28的多態性稍低外, 其他位點均表現出較高的多態性。
2.3 群體遺傳多樣性分析
應用 POPGENE(VERSION 1.31)軟件對蝦夷扇貝群體進行群體遺傳學分析。10個微衛星位點在蝦夷扇貝群體大耗島貝(DH)、褡褳島貝(TL)和日本貝(RB)中擴增出的等位基因數、有效等位基因數、觀測雜合度、期望雜合度、雜交系數、多態性信息含量(表3)。在群體遺傳學中,Na、He和Ho等都是反映群體遺傳多樣性的度量, 其數值越大, 說明基因豐富度越高[19]。本研究中蝦夷扇貝養殖群體都表現出較高的遺傳多樣性水平。
在蝦夷扇貝2個養殖群體DH、TL和野生群體RB中, TL群體的平均等位基因數最多, 為4.2613個, DH群體最少, 為 3.8535個, 與觀測到的等位基因數相比,每個位點的有效等位基因數較少。多態信息含量是衡量位點多樣性的較好指標。在 10個多態位點中, 除XY28、XY35在DH、TL、RB群體表現為中度多態, RB在 XY59中表現為中度多態外, 大部分位點多態信息含量較高。觀測雜合度為0.4467~0.6047, 期望雜合度為0.6436~0.6983, 多態性信息含量為0.5599~0.6457,這些位點在蝦夷扇貝中都具有較高的多態信息含量,可以應用于蝦夷扇貝群體遺傳的研究。
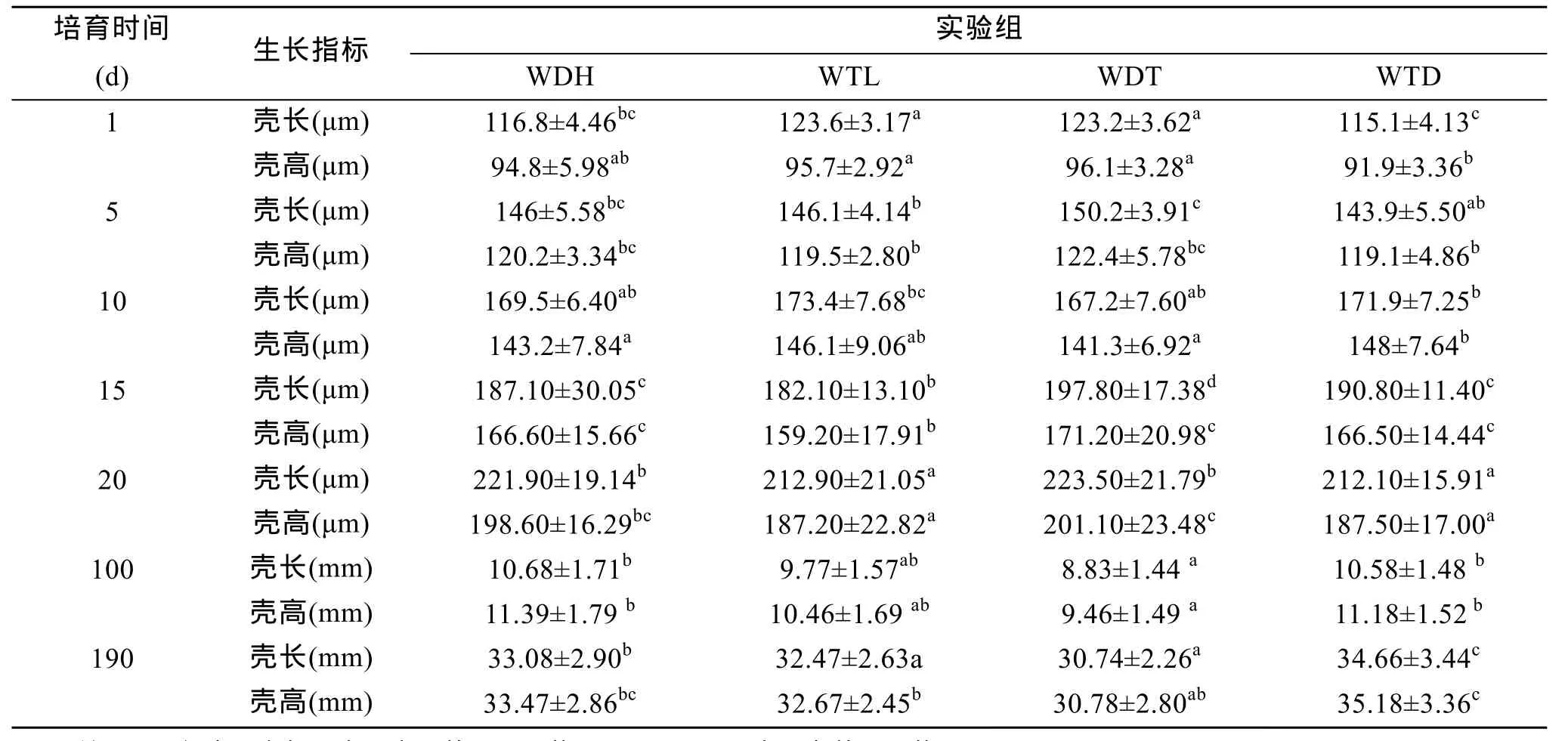
表2 蝦夷扇貝殼長、殼高的平均值和標準差及中親雜種優勢Tab. 2 The mean value of shell length, height, standard devitation and heterosis in Yesso scallop

圖1 XY4引物在蝦夷扇貝TL群體1-24號個體中的擴增情況Fig. 1 The polymorphism at locus XY4 in Yesso scallop (TL population 1-24 individuals)
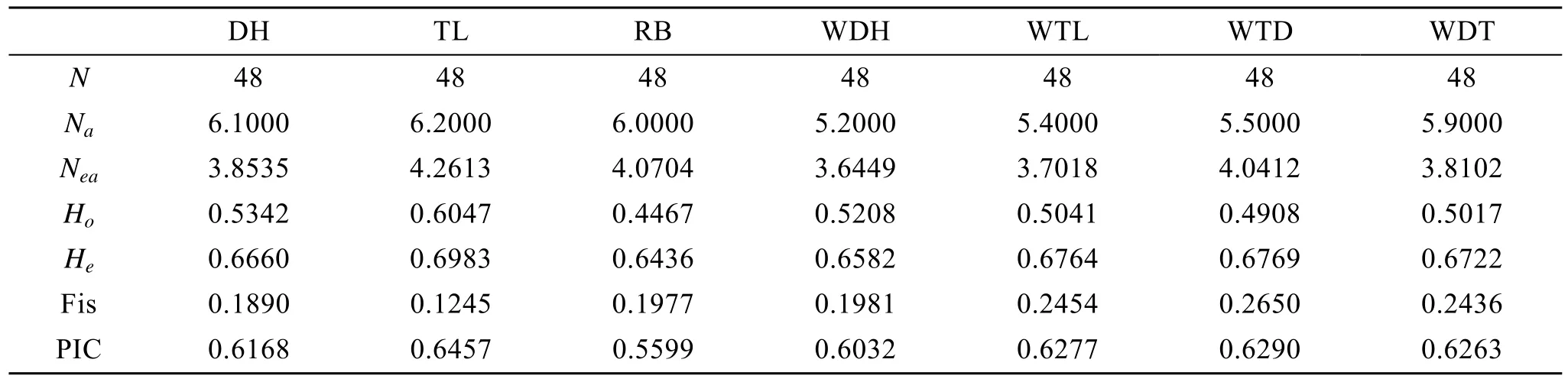
表3 2個蝦夷扇貝養殖群體及其子代、1個野生群體和4個F1子代群體的遺傳多態性(均值)Tab. 3 The polymorphism information between two cultured populations, one natural population and four F1 populations of Yesso scallop (mean value)
群體 DH 和 TL的等位基因數分別是 6.1~6.2個, 略大于群體WDH 、WTL、WTD、WDT等位基因數, 群體 DH 和 TL 與 WDH 、WTL、WTD、WDT的有效等位基因數相差不大。群體DH 和TL的觀測雜合度和期望雜合度略大于子代群體WDH 、WTL、WTD、WDT, 說明群體內交配出現輕微的雜合度缺失。4個子代群體在 10對微衛星引物中, 除有一對引物的多態性信息含量(PIC)值在0.19~0.31之間外,其余引物在各群體中的PIC值為0.36~0.85, 說明蝦夷扇貝目前的養殖狀況良好。
2.4 遺傳分化的計算
通過比較兩兩群體Fst值(表4)可以看出, DH群體和TL群體間的遺傳分化指數低于0.05, 說明兩個群體間的遺傳分化程度較低, 而TL群體和RB群體、DH群體和RB群體間的遺傳分化程度較高。
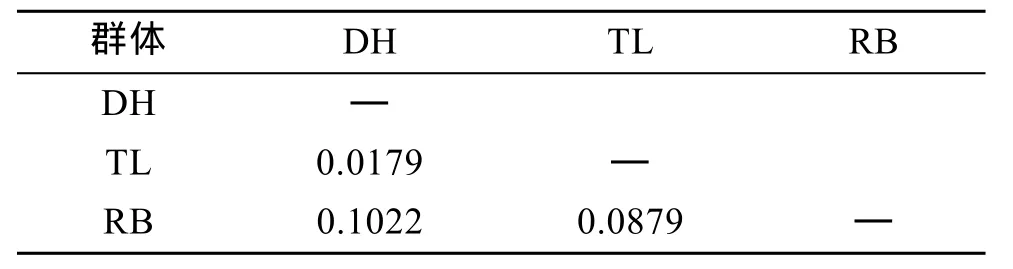
表4 蝦夷扇貝DH、TL、RB群體的遺傳分化系數FstTab. 4 Pairwise estimates of Fst within three populations of Yesso scallop
通過比較兩兩群體Fst值(表5)可以看出, 4個群體間的遺傳分化指數均低于0.05, 說明4個群體間的遺傳分化程度較低。
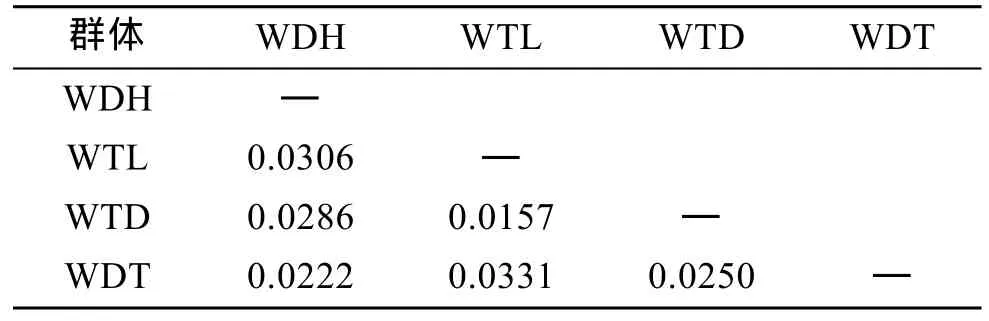
表5 蝦夷扇貝F1代4個群體的Fst比較遺傳分化系數FstTab. 5 Pairwise estimates of Fst within four F1 populations of Yesso scallop
2.5 Hardy-Weinberg平衡檢驗
在理想群體中, 群體的基因頻率和基因型頻率是穩定的。應用POPGENE(VERSION 1.31)數據分析軟件, 基于馬可夫鏈模型(Markov chain method)對各群體每個位點的Hardy-Weinberg P值進行無偏估計,4個 F1子代群體的檢驗結果表現出不同程度的平衡偏離, 其中9個位點沒有偏離平衡, 31(77.5%)位點偏離了平衡, 說明這些位點在各群體中基因頻率和基因型頻率穩定性較差。
2.6 群體間遺傳距離
根據Nei[20]分別計算了DH、TL、RB 3個群體和子代4個群體的遺傳距離和遺傳相似性指數。TL群體和 DH群體遺傳距離最近, 遺傳相似性指數最高; 和RB群體的遺傳距離次之, DH群體和RB群體的遺傳距離最遠, 相似性指數最低(表6)。這說明從日本當年引種的日本貝(RB)與大耗島貝(DH)、褡褳島貝(TL)間的親緣關系較遠。WTL群體和 WTD群體遺傳距離較近, 遺傳相似性指數較高; WDH群體和 WDT群體遺傳距離較近, 遺傳相似性指數較高(表7)。
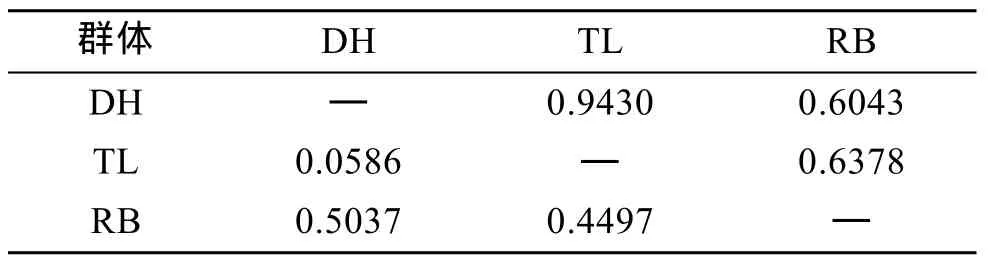
表6 蝦夷扇貝 3個群體的 Nei遺傳距離(表左下角)及相似性指數(表右上角)Tab. 6 Pairwise estimates of Nei’s unbiased genetic distance (below diagonal) and similarity index(above diagonal) within three populations of Yesso scallop
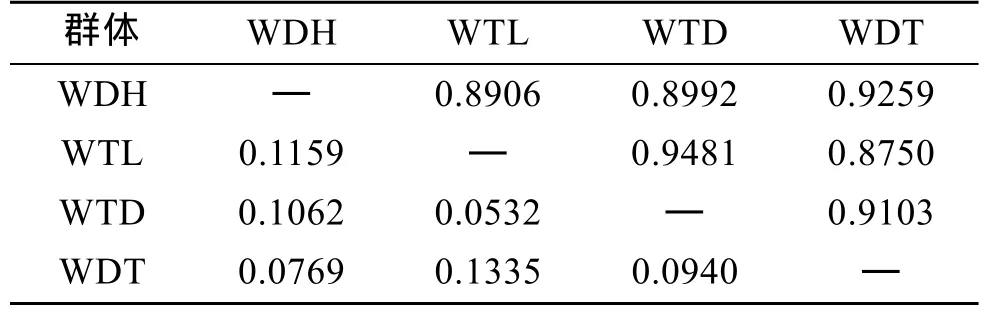
表7 蝦夷扇貝4個F1代群體的Nei遺傳距離(表左下角)及相似性指數(表右上角)Tab. 7 Pairwise estimates of Nei’s unbiased genetic distance (below diagonal) and similarity index(above diagonal) within four F1 populations of Yesso scallop
2.7 有效群體大小和近交系數
WDH、WTL、WTD、WDT實際使用的親本總數大于最大有效群體數和估計有效群體數(表8)。相對較低的Ne能導致近交率的增加, 這是近交衰退的原因之一。WDH、WTL、WTD、WDT的近交系數(Ft)分別為 0.0313、0.0263、0.0152、0.0217。
3 討論
微衛星分子標記不受生物發育時期和環境的影響, 為中性標記。利用微衛星分子標記分析蝦夷扇貝親代與子代遺傳多樣性, 能夠更加客觀地反映生物之間的本質差異, 從而能夠更加客觀地反映生物的種群結構和進化歷史。在群體遺傳學中,Na、He和Ho等都是反映群體遺傳多樣性的度量, 其數值越大,說明基因豐富度越高[19]。群體的遺傳多樣性越高, 其適應環境變化的能力越強。與野生群體相比, 遺傳多樣性在很多情況下都會降低, 其中在一些海洋生物中都有報道[21-22]。本研究中養殖蝦夷扇貝群體的遺傳多樣性比野生群體沒有顯著降低, 可能是由于養殖群體的養殖環境適宜, 使自然條件下應該被淘汰的個體保存下來, 保持了養殖群體的遺傳多樣性。本實驗中所檢測的大部分位點偏離了 Hardy-Weinberg平衡, 說明蝦夷扇貝的種質情況不容樂觀,混雜現象較為嚴重。這與常亞青[6]研究結果相一致。
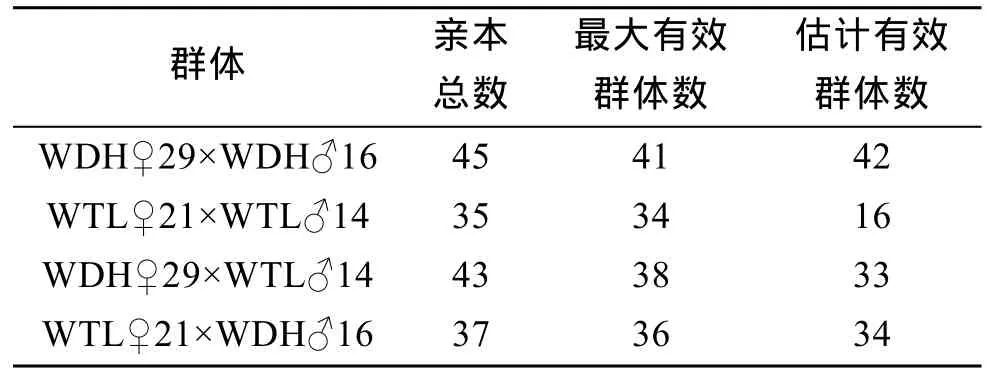
表8 4個子代群體的有效群體數(Ne)Tab. 8 The effective population size (Ne) within four F1 populations of Yesso scallop
本研究中國內養殖群體和日本群體的群體間遺傳距離大于 0.4, 這很可能是由于蝦夷扇貝作為一個引進種, 有效群體較小, 加之在苗種生產過程中生產單位往往用較少的親貝尤其是較少的父本, 奠基者效應使得養殖群體和日本野生群體發生較大的遺傳分化。常亞青等[6]研究了5個蝦夷扇貝的遺傳多樣性, 蝦夷扇貝群體內遺傳距離大于0.5。
在本研究中, 4個實驗組子代在各日齡, 殼長、殼高生長雖然有一定程度的差異, 但兩養殖群體的雜交子代并未表現出明顯的差異。分析產生這種現象的原因是由于兩群體蝦夷扇貝生長性狀遺傳差異不顯著而引起的, 生產用親貝種質混雜現象比較嚴重。張立冬等[23]研究了大長山群體、日本陸奧灣群體和獐子島群體 3個群體的遺傳多樣性, 發現陸奧灣群體和獐子島群體遺傳距離最近, 遺傳相似性指數最高; 陸奧灣群體和大長山群體的遺傳距離最遠,相似性指數最低, 并指出造成這種現象原因是由于獐子島在全人工育苗過程中多采用日本扇貝或利用日本扇貝與當地優良種貝進行雜交, 故在遺傳多樣性水平上與日本蝦夷扇貝群體相差不大; 而大長山全人工苗種多采自當地, 累代繁殖及近交等因素影響了其遺傳多樣性水平, 造成了當地群體與其他兩個地區群體的差異。本研究所選用的兩養殖群體的親本可能是由于生產用親貝種質混雜現象比較嚴重,從而在生長性狀并未獲得顯著的雜種優勢。
目前中國蝦夷扇貝人工苗種生產所用親本的來源主要是從自然海區挑選, 挑選的標準主要是由有經驗的技術人員檢查待選親本的規格、殼型、肥滿度、性腺等表型情況, 另外也要對既往用其作為親本的繁育成敗情況等做社會調查。但這些檢查和調查主要還是憑經驗, 也有運氣成分。通過本研究可以發現, 蝦夷扇貝隨機雜交配易造成遺傳分化的降低,因此, 生產上這種隨機采用用兩個地理位置不同的群體雜交是盲目的, 造成蝦夷扇貝種質衰退, 對蝦夷扇貝養殖產業造成沖擊。因此, 從分子水平來研究兩群體的自繁子代和雜交子代的遺傳多樣性, 從根本上解釋自繁群體和雜交群體的遺傳結構, 采用分子育種方法指導蝦夷扇貝的種質改良是非常有意義的。
鑒于蝦夷扇貝在養殖過程中很容易出現不同群體混雜的現象, 我們建議實行“種貝”和“菜貝”分區養殖的模式。所謂的“菜貝”去向是作為商品貝流向市場被消費者購買和食用, 所謂的“種貝”是用于進行苗種生產的貝類。用于“種貝”的親貝必須有系統的譜系分析和良好的保種措施。保種的過程中不但要確保各個種群之間具有嚴格的隔離, 而且在世代之間能夠確保遺傳結構得到最大程度的保留。
[1]李文姬, 薛真福. 持續發展蝦夷扇貝的健康養殖[J].水產科學, 2005, 24(9):49-51.
[2]張明明, 趙文. 我國蝦夷扇貝死亡原因的探討和控制對策[J]. 魚病診治, 2008, 2:65-74.
[3]常亞青, 王慶志, 宋堅, 等. 黃海北部大連沿岸蝦夷扇貝天然苗采集技術研究[J]. 海洋水產研究, 2007,28(6):39-44.
[4]王海濤, 王世黨, 姜啟平, 等. 蝦夷扇貝育苗綜合技術[J]. 中國水產, 2008, 4:55-56.
[5]楊愛國, 王清印, 劉志鴻, 等. 櫛孔扇貝與蝦夷扇貝雜交及子一代的遺傳性狀[J]. 海洋水產研究, 2004,25(5):1-5.
[6]常亞青, 陳曉霞, 丁君, 等. 蝦夷扇貝(Patinopecten yessoensis)5 個群體的遺傳多樣性[J]. 生態學報,2007, 27(3):1145-1152.
[7]趙瑩瑩, 朱曉琛, 孫效文, 等. 蝦夷扇貝的多態性微衛星座位[J]. 動物學報, 2006, 52(1):229-233.
[8]李春艷, 丁君, 常亞青, 等. 蝦夷扇貝微衛星標記的分離及其養殖群體的遺傳結構分析[J]. 中國水產科學, 2009, 16(1):39-46.
[9]楊璞, 楊愛國, 劉志鴻, 等. 櫛孔扇貝和蝦夷扇貝通用微衛星引物的篩選及其在雜種鑒定中的應用[J].安徽農業科學, 2008, 36(19):8287-8289.
[10]Sambrook J, Fritsch E F, Maniatis T. Molecular Cloning:a Laboratory Manual, 2nd edn[M]. New York:Cold Spring Harbor Laboratory Press, 1989.
[11]慧敏. 扇貝微衛星標記的篩選及其在物種鑒定中的應用[D]. 青島:中國海洋大學, 2008:28-29.
[12]高祥剛, 曹潔, 劉瑩, 等. SSR 不對稱 PCR 法分析蝦夷扇貝遺傳多樣性[J]. 生物技術通報, 2009, 2:118-123.
[13]李云峰, 劉衛東, 高祥剛, 等. 蝦夷扇貝外套膜和腎臟組織cDNA文庫構建以及 EST的初步分析[J]. 中國水產科學, 2010, 17(3):578-585.
[14]趙海波. 蝦夷扇貝遺傳連鎖圖譜的構建[D]. 青島:中國海洋大學, 2009:34.
[15]張存善, 常亞青, 曹學彬, 等. 蝦夷扇貝體形性狀對軟體重和閉殼肌重的影響效果分析[J]. 水產學報,2009, 33(1):87-94.
[16]Botstein D, White R L, Skolnick M, et al. Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J]. Am J Hum Genet, 1980,32(3):314-331.
[17]Saavedra C, Guerra A. Allozyme heterozygosity, founder effect and fitness traits in a cultivated population of the European oyster, Ostrea edulis[J]. Aquaculture,1996, 139(3-4):203-224.
[18]張國范, 鄭懷平. 海灣扇貝養殖遺傳學[M]. 北京:科學出版社, 2009:36-50.
[19]陳蒙, 常亞青, 孫謙, 等. 蝦夷扇貝群體的遺傳結構及微衛星標記與體尺、體重的相關性分析[J]. 大連水產學院學報, 2009, 24(4):311-316.
[20]Nei M. Estimation of average heterozygosity and genetic distance from a small number of individuals[J].Genetics, 1978, 89(3):583.
[21]Hedgecock D, Sly F. Genetic drift and effective population sizes of hatchery-propagated stocks of the Pacific oysterCrassostrea gigas[J]. Aquaculture. 1990, 88:21-38.
[22]Porta J, Porta J M, Martinez-Rodriguez G, et al. Genetic structure and genetic relatedness of a hatchery stock of Senegal sole (Solea senegalensis) inferred by microsatellites[J]. Aquaculture, 2006, 251:46-55.
[23]張立冬, 王蕾, 高悅勉. 蝦夷扇貝遺傳結構及微衛星標記與經濟性狀相關分析[J]. 生物技術通報, 2010,11:115-112.
Genetic diversity in two-generation of cultured Japanese scallop (Patinopecten(Mizuhopecten)yessoensis) populations
HAN Fei-fei1,2, ZHANG Ji-biao1, LI Li1, ZHANG Guo-fan1, YAN Xi-wu2
(1. Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Dalian Ocean University,Dalian 116023, China)
Dec.,12,2011
Patinopecten(Mizuhopecten)yessoensis; microsatellites; genetic diversity; hybridization; growth detection
The Japanese scallop (Patinopecten(Mizuhopecten)yessoensis) was introduced into China in 1982. Since then, the culture of Japanese scallop has become an important industry in China. In this study microsatellite was used to investigate the genetic variations of two cultured populations [one from Dahao island (DH) and another from Talian island (TL)]and one wild Japanese scallop population (RB). The four F1progeny populations were the one hatchery population which from Dahao island (WDH), one population from Talian island (WTL), one outcrossed population (WTD population) from Dahao island (♀) and Talian island (♂), one outcrossed population(WDT population) from Dahao island (♂) and Talian island (♀). Forty-eight individuals from each population were analyzed. Amplification was performed in a PCR reaction and its products were separated by 12% non-denaturing polyacrylamide gel. The difference in genetic diversity among two cultural populations (DH and TL population) and one natural population (RB population) was not significant. The two cultural populations were in good condition temporarily. According to their genetic similarity (I) and genetic distance (D), we found that the genetic distance between DH and TL was the least. The phenotype characters (shell length and shell height) of four F1progeny populations scallop were measured at 1, 5, 10, 15, 20, 100, 190 days old. Non-significant differences were found between different characters in four F1progeny populations at different growth stages. The difference in genetic diversity among the four F1progeny populations was not significant, either. The results showed the genetic background of cultured populations was not clear and cultured populations were mixed with each other seriously. The results of this study reflect resources evaluation situation for Japanese scallop in our country and provide the basis of data for health breeding of Japanese scallop.
Q751 文獻標識碼:A 文章編號:1000-3096(2012)09-0001-08
2011-12-12;
2012-04-22
中國科學院海洋研究所獐子島漁業海洋生態養殖聯合實驗室開放研究基金; 中國科學院重要方向項目群(KZCX2-EW-Q21)
韓斐斐(1984-), 女, 碩士研究生, 從事水產養殖分子生物學研究, E-mail:hanfeifei0325310406@126.com; 張國范, 通信作者, 研究員, E-mail:guofanzhang2005@163.com
致謝:感謝中國科學院海洋研究所李娟、王家豐、王威和大連海洋大學霍忠明、楊霏、王琳楠對實驗的幫助。
梁德海)

