牙鲆RAG2基因的質粒構建和體外原核表達
王先磊, 譚訓剛 張培軍 徐永立
(1. 中國科學院 海洋研究所, 實驗海洋生物學重點實驗室 山東 青島 266071; 2. 青島國家海洋科學研究中心, 山東 青島 266071)
牙鲆RAG2基因的質粒構建和體外原核表達
王先磊1,2, 譚訓剛1, 張培軍1, 徐永立1
(1. 中國科學院 海洋研究所, 實驗海洋生物學重點實驗室 山東 青島 266071; 2. 青島國家海洋科學研究中心, 山東 青島 266071)
將牙鲆(Paralichthys olivaceus)RAG2 cDNA序列插入到體外表達質粒pProEXTM HT, 在大腸桿菌(Escherichiacoli) BL-21中進行體外表達, 分析了誘導時間和 IPTG濃度對重組蛋白產生量的影響,確定了最佳誘導條件為:誘導時間為3 h, IPTG誘導濃度0.2 mmol/L。本研究同時對RAG2重組蛋白的可溶性進行確認, 并利用BD TALONTM 金屬親和柱純化了RAG2蛋白。本研究結果為進一步深入研究RAG2蛋白的生物學功能奠定了良好的基礎。
牙鲆(Paralichthys olivaceus); RAG2; 重組; 純化
重組活化基因2(Recombination activating gene 2,RAG2)在基因序列上與 RAG1基因緊密相連, 對于淋巴細胞的V(D)J重排是必需的。如果缺失了RAG1或者 RAG2基因產物, 淋巴細胞無法發育成熟, 從而在小鼠(Mus musculus)和人體內導致嚴重的免疫缺陷[1]。
最初關于 RAG2蛋白的功能研究主要集中在哺乳動物、兩棲類和鳥類[2-4], 隨著魚類疾病的頻繁發生和水產養殖業的發展, 各國學者將目光開始轉移到魚類的 RAG2基因功能研究, 目前虹鱒(Oncorhynchus mykiss)[5-6]、斑馬魚(Denio rerio)[7-8]、紅鰭東方豚(Fugu rubripes)[9]、鯽魚(Carassius auratus)[10]、草魚(Ctenopharyngodon idellus)[11]等硬骨魚類的 RAG2基因已得到克隆, 而軟骨魚的代表物種鯊魚(Rhizoprionodon lalandii)RAG2基因也得到克隆[12], 其在硬骨魚類體內 mRNA水平的時空表達情況也進行了分析[13]。研究發現, 目前已知的所有生物的RAG2的基因序列內沒有內含子。
牙鲆(Paralichthys olivaceus)是中國北方重要的經濟養殖品種, 目前, 病害的頻繁發生嚴重阻礙了牙鲆養殖業的發展。為了保證牙鲆產業穩定、健康、持續發展, 通過研究牙鲆免疫系統的基本結構和功能而提高牙鲆抵抗病原菌侵害的能力是一條重要的途徑[14]。RAG2基因產物對于魚類免疫系統的發育具有重要意義。
在機體內真正起作用的是蛋白質, 只有蛋白質時空表達的確定才能更真實有效地反映免疫細胞和器官發揮作用的時間和空間分布。目前關于硬骨魚類 RAG2生物學功能研究基本上是在 mRNA水平,為進一步研究在蛋白水平 RAG2的生物學功能, 本研究在本實驗室的研究[15-16]及克隆了的牙鲆 RAG2基因的基礎上, 構建了RAG2體外原核表達質粒, 并進行了原核表達和純化, 為 RAG2蛋白抗體制備奠定了基礎。
1 材料和方法
1.1 材料
限制性內切酶(TaKaRa, 大連), T4Ligase (Ta-KaRa, 大連),Pfupolymerase(Shanghai Promega,上海), 蛋白 Marker(上海生物所), BD TALONTMMetal Affinity Resins(Clontech, USA)。
大腸桿菌(Escherichiacoli)BL-21及質粒pBluescriptⅡSK, pProEXTMHT由本試驗室保存。
1.2 引物序列
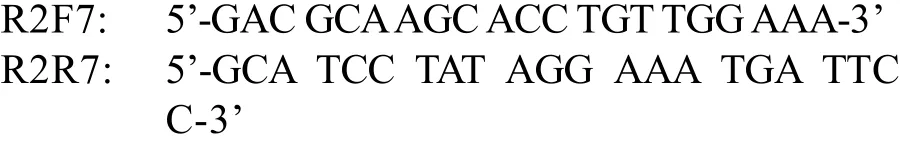
1.3 重組表達菌獲得
依據GST Gene Fusion System手冊(Amersham Pharmacia Biotech, USA。GST Gene Fusion System,Third Edition, Revision2,1997)[17], 將重組表達質粒轉入到大腸桿菌BL-21, 獲得重組表達菌株。
1.4 IPTG誘導濃度對重組蛋白表達量的影響
按照 Qiagen公司(Qiagen, UAS。The QIAexpressionist? fifth edition- A handbook for high-level expression and purification of 6xHis-tagged proteins,2003)蛋白表達及純化手冊進行蛋白的誘導表達。IPTG的誘導濃度為 0.2、0.4、0.6、1.0、1.5、2.0、3.0和4.0 mmol/L。
1.5 誘導時間對重組蛋白表達量的影響
實驗方法同 1.4, 只是 IPTG誘導濃度為 0.6 mmol/L, 第一次取樣時間為誘導后1 h, 此后每隔1 h取樣, 共取至第6小時, 探討其誘導時間對重組蛋白表達量的影響。
1.6 蛋白可溶性確定
將誘導表達的菌液5 mL 12 000g離心1 min, 收集菌體, PBS洗滌后加入1 mL PBS重懸菌體。超聲破碎菌體后, 12 000g離心1 min。取上清, 加等體積2×蛋白處理液, 然后沸水浴5 min, 取20 μL電泳。沉淀加 500 μL PBS重懸, 加等體積 2×樣品處理液,沸水浴5 min, 取10 μL電泳。
1.7 RAG2蛋白純化
按照 Qiagen公司蛋白表達及純化手冊(Qiagen,UAS。The QIAexpressionist? fifth edition-A handbook for high-level expression and purification of 6xHis-tagged proteins, 2003)進行蛋白的純化。
1.8 SDS-PAGE檢測
蛋白電泳用SDS-PAGE電泳, 濃縮膠濃度為5%,分離膠濃度為8%。電泳采用恒流, 電流強度10 mA。考馬斯亮藍R250進行染色, 7%的醋酸進行脫色。
2 結果
2.1 重組表達質粒構建及重組蛋白分子量確定
根據本實驗室獲得的牙鲆 RAG2的基因序列,設計特異性引物(R2F7, R2R7, 引物序列見 1.2), 利用Pfu聚合酶擴增牙鲆RAG2 cDNA的全序列; 將得到的基因片段插入到pBluescriptⅡSK的SmaⅠ位點;通過酶切將RAG2基因片段轉移到帶6組氨酸標簽的pProEXTM HT表達質粒, 構建重組表達質粒。測序確認 RAG2基因插入方向及閱讀框架的正確性。成功構建的重組表達質粒圖譜見下圖:
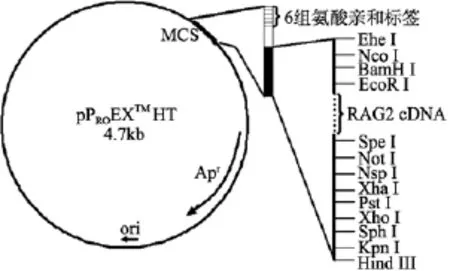
重組質粒插入的RAG2基因的全長為1602 bp,可以編碼533個氨基酸, 加上pPROEXTMHT表達質粒的氨基酸片段, 表達的融合蛋白 RAG2的分子量理論值為60 kDa。
2.2 誘導時間對重組蛋白表達量的影響
當培養溫度為 37℃, IPTG誘導濃度為 0.6 mmoL/L時, 加入誘導劑IPTG后1 h, SDS-PAGE電泳的結果顯示, 在接近預測重組蛋白分子量的位置附近出現了一條新的蛋白條帶, 與預測的 RAG2重組蛋白的分子量60 kDa接近, 可以確認為該蛋白條帶為帶6組氨酸標簽的RAG2重組蛋白(圖1)。
隨著培養時間的延長, RAG2蛋白的表達量也不斷增加。到3 h, RAG2蛋白的表達量達到最大, 在此后的研究時間段內 RAG2蛋白的表達量變化不大。因此, 在以后誘導RAG2蛋白表達時, 誘導時間定為3 h。
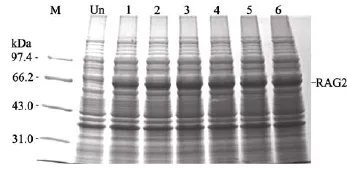
圖1 誘導時間對RAG2蛋白表達量的影響Fig. 1 The effect of induction time on the expression of recombinant RAG2 protein
2.3 IPTG濃度對重組蛋白產生量的影響
當培養溫度為 37℃, 誘導時間為 2 h時, 盡管IPTG濃度(0.2 ~4.0 mmoL/L)變化比較大, 但是其對RAG2蛋白的重組表達量的影響卻變化不大(圖2),因此在大量表達RAG2蛋白時, IPTG濃度用最小濃度0.2 mmoL/L對重組表達質粒進行誘導即可。
2.4 蛋白可溶性確定
菌體經超聲破碎后電泳結果顯示, 上清中幾乎沒有目的蛋白帶, 而沉淀中主要以目的蛋白為主,這說明 RAG2蛋白是主要以包涵體的形式存在于宿主細胞中(圖3)。
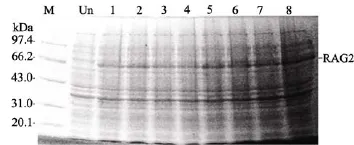
圖2 IPTG濃度對RAG2蛋白表達量的影響Fig. 2 The effect of IPTG concentration on the expression of recombinant RAG2 protein
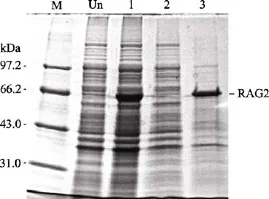
圖3 RAG2蛋白可溶性的確定Fig. 3 Determination of the solubility of the recombinant RAG2 protein
2.5 RAG2蛋白親和柱純化
將菌體離心后, 用變性裂解緩沖液裂解后, 加入到BD TALONTM金屬親和柱, 通過緩沖液pH逐漸降低的梯度變化, 進行純化。實驗結果顯示, 當緩沖液pH為8.0和6.3時, 洗滌液中沒有目的蛋白, 當pH降到4.5時, 在對應的RAG2蛋白的位置出現了單一的蛋白電泳條帶(圖4, 帶6-9), 說明攜帶組氨酸序列標簽表達的 RAG2蛋白可以結合到 BD TALONTM Metal Affinity Resins親和柱, 通過pH的改變, RAG2蛋白可被洗脫下來, 并且蛋白純化效果比較好。
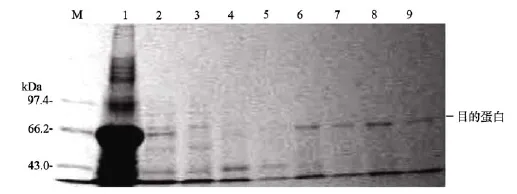
圖4 體外重組表達蛋白的純化Fig. 4 Purification of recombinant RAG2 protein
3 討論
對原核表達載體作者使用了帶 6組氨酸標簽的pPROEXTMHT表達質粒, 6組氨酸標簽可與 BD TALONTM 金屬親和柱結合, 從而將目的蛋白吸附在親和柱上, 通過改變pH值梯度變化進行洗脫, 從而獲取高純度的目的蛋白。得到的 RAG2蛋白電泳后分子量比理論分子量偏大, 這可能是由于在重組蛋白前面加上一段帶6組氨酸的載體序列造成的。
重組蛋白的表達量受到宿主菌、誘導時間和誘導物濃度的影響。作者最終使用的宿主菌株是大腸桿菌 BL-21, 作者實驗初期使用的菌株是大腸桿菌DH 5α, 但是沒有誘導出 RAG2蛋白的表達(實驗結果沒有列出), 可能大腸桿菌DH 5α不適合RAG2蛋白的表達, 說明選擇合適的宿主菌對于重組蛋白在原核表達是一個重要的因素。重組蛋白表達量的多少與誘導物的濃度和誘導時間有密切關系, 本實驗所用的誘導物為IPTG, 由于IPTG本身有毒性, 而且價格較貴, 經過條件優化, 最終IPTG誘導濃度為0.2 m moL/L。誘導時間實驗顯示, 經過IPTG的誘導, 菌體很快產生目的蛋白, 隨著誘導時間的增加, 重組蛋白的量不斷增加, 到3 h時, 重組蛋白表達量達到最大值, 此后進入平臺期, 因此作者使用的誘導時間為3 h。
外源基因在大腸桿菌中的表達產物, 通常可以以可溶性和不可溶(即包涵體)的形式存在。RAG2蛋白主要以包涵體的形式存在于宿主菌中, 由于包涵體的不溶性、致密性和相對穩定性, 通過超聲波破碎、離心可以很容易地進行初級分離。純化后, 通過在包涵體中加入含尿素的變性裂解緩沖液, 打開蛋白中的次級鍵, 使組蛋白標簽暴露出來, 與樹脂上的Co2+離子結合。另外, 在沉淀中發現了大量的目的蛋白存在(圖3), 可能是由于在將重懸浮液放到搖床上振蕩得不夠充分, 大多數包涵體都沒有溶解, 可以將沉淀用變性裂解液重新懸浮, 通過 BD TALONTM 金屬親和柱進一步進行純化, 提高目的蛋白的回收率。
[1]Shinkai Y, Rathbun G, Lam K P, et al. RAG-2-deficient mice lack mature lymphocytes owing to inability to initiate V(D)J rearrangement[J]. Cell, 1992, 68(5):855-867.
[2]Oettinger M A, Schatz D G, Gorka C, et al. RAG-1 and RAG-2, adjacent genes that synergistically activate V(D)J recombination[J]. Science, 1990, 248(4962):1517-1523.
[3]Carlson L M, Oettinger M A, Schatz D G, et al. Selective expression of RAG-2 in chicken B cells undergoing immunoglobulin gene conversion[J]. Cell, 1991,64(1):201-208.
[4]Greenhalgh P, Olesen C E, Steiner L A. Characterization and expression of recombination activating genes(RAG-1 and RAG-2) inXenopus laevis[J]. J Immunol,1993, 151(6):3100-3110.
[5]Hansen J D. Inspection of the 3' UTR genomic region for RAG1 and RAG2 in rainbow trout (Oncorhynchus mykiss) reveals potential regulatory motifs[J]. Dev Immunol, 1997, 5(2):129-131.
[6]Hansen J D, Kaattari S L. The recombination activating gene 2 (RAG2) of the rainbow troutOncorhynchus mykiss[J]. Immunogenetics, 1996, 44(3):203-211.
[7]Willett C E, Cherry J J, Steiner L A. Characterization and expression of the recombination activating genes(rag1 and rag2) of zebrafish[J]. Immunogenetics, 1997,45(6):394-404.
[8]Zhong H, Li Z, Lin S, et al. Initiation of V(D)J recombination in zebrafish (Danio rerio) ovaries[J]. Mol Immunol, 2007, 44(7):1784-1792.
[9]Peixoto B R, Mikawa Y, Brenner S. Characterization of the recombinase activating gene-1 and 2 locus in the Japanese pufferfish,Fugu rubripes[J]. Gene, 2000,246(1-2):275-283.
[10]范嗣剛, 張瓊宇, 羅琛. 鯽魚Rag基因的克隆及表達分析[J]. 水生生物學報, 2009, 33(4):603-612.
[11]張瓊宇, 范嗣剛, 羅琛. 草魚 RAGs的克隆及不同發育階段的表達分析[J]. 水生生物學報,2009, 2009,33(5):795-803.
[12]Bernstein R M, Schluter S F, Bernstein H, et al. Primordial emergence of the recombination activating gene 1 (RAG1):sequence of the complete shark gene indicates homology to microbial integrases[J]. Proc Natl Acad Sci USA, 1996, 93(18):9454-9459.
[13]Zapata A, Diez B, Cejalvo T, et al. Ontogeny of the immune system of fish[J]. Fish Shellfish Immunol,2006, 20(2):126-136.
[14]Liu Y, Zhang S, Jiang G, et al. The development of the lymphoid organs of flounder,Paralichthys olivaceus,from hatching to 13 months[J]. Fish Shellfish Immunol,2004, 16(5):621-632.
[15]徐芃, 譚訓剛, 張培軍, 等. 牙鲆Myogenin蛋白在大腸桿菌中重組表達的研究[J]. 中國海洋大學學報,2007, 35(5):754-758.
[16]文愛韻. 性別相關基因在牙鲆性腺分化和性別表型形成中的遺傳學分析[D]. 北京:中國科學院研究生院, 2010.
[17]Sambrook J, Russell D. Molecular cloning:a laboratory manual (3rd ed) [M]. New York:Cold Spring Harbor Press, 2001:636-644.
Construction and expression of a prokaryotic vector of recombinant olive flounder RAG2
WANG Xian-lei1,2, TAN Xun-gang1, ZHANG Pei-jun1, XU Yong-li1
(1. Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences,Qingdao 266071, China; 2. National Oceanographic Center, Qingdao 266071, China)
Nov.,4,2011
Olive flounder (Paralichthys olivaceus); RAG2; recombination; purification
The full length of olive flounder RAG2 cDNA was ligated to plasmid pPROEXTM HT, and was transferred intoEscherichia coli(BL-21) for recombinant protein expression. It showed that the protein expression was induced by IPTG. The optimal concentration of IPTG and optimal induction time were 0.2 mmoL/L and 3 h, respectively. The recombinant RAG2 protein was purified by BD TALONTM Metal Affinity Resins. This study will be useful for further research on the function of flounder RAG2.
Q78 文獻標識碼:A 文章編號:1000-3096(2012)09-0059-05
2011-11-04;
2012-02-17
國家863計劃資助項目(2012AA092203); 國家自然科學基金項目(30800838); 山東省自然科學基金項目(Y2008E12)
王先磊(1976-), 女, 山東膠南人, 助理研究員, 博士, 主要從事海洋生物學研究, 電話:0532-80970745, E-mail:wxl@nocq.org;譚訓剛, 通信作者, 電話:0532-82898559, E-mail:tanx@qdio.ac.cn
譚雪靜)

