環境脅迫下大頭芥花青素積累及其相關結構基因的表達
(西南大學園藝園林學院,重慶市蔬菜學重點實驗室,南方山地園藝學教育部重點實驗室,重慶400715)
大頭芥〔Brassica juncea(L.)Czern.et Coss.var.megarrhizaTsen et Lee〕為根芥的一個變種,其中紅葉大頭芥(以下簡稱紅葉芥)在三峽庫區長江流域栽培面積大、經濟產量高。其肉質根主要做腌漬用,營養豐富、味道鮮美;其葉片可作為天然紅色素提取的優質原料,具有重要的經濟價值。通過對紅葉芥色素的LC-MS 分析表明,紅葉芥葉片中的紅色素主要由矢車菊素構成(張欣,2008),矢車菊素是常見的6 種花青素之一。花青素代謝途徑是類黃酮代謝的一個重要分支。花青素的生物代謝起始于苯丙氨酸,通過苯丙氨酸解氨酶PAL,查爾酮合成酶CHS,查爾酮異構酶CHI,黃烷酮-3′-羥化酶F3′H,二氫黃酮醇還原酶DFR 以及花青素合成酶ANS等關鍵酶參與的一系列酶促反應合成,隨后經過不同的羥基化、甲基化和酰基化的修飾后轉運到液泡中匯集。這些直接調控花青素形成的關鍵酶類主要是通過花青素生物合成途徑中結構基因轉錄而來,所以花青素代謝途徑的調控主要發生在結構基因的轉錄水平上,受多種轉錄因子在不同時間、空間上的調控,還有一些受到轉錄后調控(包滿珠,1997;張寧 等,2008)。
花青素類色素廣泛存在于葡萄、血橙、紫甘藍、藍莓、紫甘薯、矮牽牛等高等植物組織中,其生物合成途徑現在也已經有相當深入的研究(Fabienne & Christiane,1999;Cotroneo et al.,2006;Hironori et al.,2007;Lu et al.,2009)。植物花青素生物合成主要是受到外界環境因素的影響,這些環境因素主要包括光照(光照強度、光質和光照時長等)、溫度、逆境脅迫、元素缺失等,環境因素的影響使花青素合成的結構基因和調控基因表達上調或表達下調,促進或抑制花青素的合成與積累,最終使植物表現出不同的葉色或花色(Koes et al.,2005;Lepiniec et al.,2006)。目前對紅葉芥花青素的研究主要集中在對其葉片花青素色素理化性質和結構的分析上,而對于紅葉芥花青素合成的分子機制并沒有進行系統的研究,因此,對環境脅迫下紅葉芥花青素生物合成的研究具有重要的理論意義。本試驗選取了花青素生物合成途徑中上游和下游對花青素種類和積累量具有較大影響的CHI、DFR和ANS基因進行了研究。首次克隆得到紅葉芥花青素生物合成途徑中編碼CHI、DFR和ANS的關鍵基因,并根據獲得的cDNA 序列重新設計熒光實時定量RT-PCR 引物,檢測模擬干旱、低溫和強光等環境脅迫對CHI、DFR和ANS表達的影響,并初步分析了環境脅迫下紅葉芥花青素累積與CHI、DFR和ANS表達的關系,有利于紅葉芥葉片呈色機理的深入研究,對芥菜色澤育種也具有重要意義,在花青素的食品應用方面具有一定的應用潛力和研究價值。
1 材料與方法
1.1 試驗材料
供試材料為紅葉大頭芥,由重慶市蔬菜學重點實驗室提供。
蘋果為異花授粉植物,要栽植授粉樹才能正常結實。授粉樹要求與主栽品種的花期一致,只有花期相遇才能保證授粉;開花多,花粉量大,與主栽品種親和性好。
1.2 環境脅迫處理
2009年11 月播種,待子葉展開后移至RXZ-300D 型人工氣候箱培養。光周期為12 h 光照(光照強度200 μmol·m-2·s-1,溫度22 ℃,相對濕度70%),12 h 暗培養(溫度18 ℃,相對濕度65%)。在保證材料正常生長的情況下,6 片真葉時開始進行如下處理(每處理64 株,種植于64 孔穴盤,栽培基質為Klasmann-Deilmann TS1 泥炭,處理前使用Scotts General Purpose水溶性復合肥灌根)。
低溫脅迫下紅葉芥的花青素含量在處理24 h 時出現明顯的增長,至96 h 達到最大值(圖4)。
取樣部位為處理后植株的第4、5 片真葉,取0.1 g 樣品用于目標基因的表達分析(3 次樣品重復,3 次技術重復),余下部分進行花青素含量測定(3 次試驗重復)。處理前取樣1 次作為對照,記為0 h。
1.3 總RNA提取及第一鏈cDNA 合成
花青素含量的測定參照Haskins 和Gorz 的方法(1986)進行。
1.4 CHI、DFR 和ANS 基因克隆
杭州畫院作為全額撥款的公益性事業單位,徹底解決了畫院發展的后顧之憂,可以全力投入到藝術創作和畫院發展中去;在浙江省文化建設的標志性建筑——西湖文化廣場中有了畫院的展覽、創作、辦公和休閑活動的場所,可以安居樂業了;畫師們揮灑著對國畫技藝的追求,肩負著傳承文藝的社會責任。近年來,圍繞杭州西湖和運河申遺大事,做足“五水共導”文章,將“江河湖海溪”作為杭州美術創作重要題材,分別舉辦了“西溪視覺藝術展”、“三評西湖十景”美術展覽、“運河春秋—全國中國畫名家邀請展”、“相聚大運河 彩墨新杭州—美術作品展”、“新杭州—‘三江兩岸’油畫名家作品展”、“錢塘自古繁華—全國著名畫家畫杭州”等重大展覽活動。

表1 基因克隆所用引物
1.5 實時熒光定量RT-PCR 表達分析
實時熒光定量RT-PCR 試驗方法采用Livak Method(2ΔΔCt)在C1000 Thermal Cycler(Bio-Rad)上進行。以β-Actin為內參基因,樣品第一鏈cDNA 為模板,使用TransStartGreen qPCR SuperMix(北京全式金生物技術有限公司)配制反應體系,擴增條件為:95 ℃,3 min(1 個循環);95 ℃,20 s;57.5 ℃,20 s;72 ℃,20 s(35 個循環)。
1.6 花青素含量測定
取樣品0.1 g,使用RNAisoTMPlus(Takara)和RNAiso-mate for Plant Tissue(Takara)試劑盒提取總RNA,然后用DNase I(Takara)去除gDNA,最后使用TransScriptFirst-Strand cDNA Synthesis Super Mix(北京全式金生物技術有限公司)合成第一鏈cDNA。
2 結果與分析
2.1 紅葉芥花青素合成途徑相關結構基因的克隆與分析
根據 Genbank 上已發布的蕓薹屬植物花青素合成途徑相關結構基因的保守區域設計引物(表2),以紅葉芥葉片cDNA 為模板通過PCR 方法得到CHI、DFR和ANS3 個結構基因的保守序列,序列的基本特征如表3所示。

表2 實時熒光定量RT-PCR 分析所用特異引物

表3 紅葉芥CHI、DFR 和ANS 基因基本特征
(3)形態觀察:采用透射電子顯微鏡(TEM)觀察膠束粒子的形態。將TPGS-CS載藥膠束溶液用水稀釋后,滴至表面有支持膜的銅網上,自然晾干后,用1%磷鎢酸染色,自然晾干后,送檢。從圖5可見,載藥膠束呈球形,有清晰的核-殼結構,呈橢圓形,粒徑約為160 nm。
將獲得的基因片段提交NCBI、EMBL 和ExPASy 進行核苷酸和推導氨基酸同源性比對,結果顯示,紅葉芥中CHI、DFR和ANS基因與蕓薹屬植物來源的3 個結構基因具有極高的同源性。紅葉芥CHI基因推導編碼的氨基酸序列含有查爾酮異構酶超家族基因的保守結構域,該酶在植物體內的類黃酮合成途徑中將查爾酮異構化為4,5,7-三羥黃烷酮;DFR基因推導氨基酸殘基序列含有1 個Rossmann 折疊NAD(P)H/NAD(P)(+)結合位點(NADB)保守結構域,其主要功能為結合底物并進行特異的催化反應;ANS基因推導氨基酸殘基序列屬于Fe(Ⅱ)2-酮戊二酸雙加氧酶超家族基因,其包含C 端的脯氨酰-4-羥化酶α亞基,推導得到的氨基酸殘基第210~219 位為ArgE/dapE/ACY1/CPG2/yscS,家族活性位點為LGVEAHtDVS。
2.2 紅葉芥花青素合成結構基因在環境脅迫下的表達及花青素含量變化
2.2.1 模擬干旱脅迫 模擬干旱脅迫處理后,DFR基因和ANS基因在72 h 時表達量劇烈上漲,在處理96 h 后DFR基因仍持續小幅增長,而ANS基因表達量減少至最大值的一半左右;CHI基因在干旱脅迫下雖有增長趨勢,但變化幅度不大(圖1)。
模擬干旱脅迫下紅葉芥的花青素含量隨著處理時間的延長也隨之增加,在處理48 h 時增幅較大,此后增加緩慢(圖2)。
2.2.3 強光脅迫 強光脅迫下,DFR基因與ANS基因的表達隨時間延長而增加,處理后24 h 開始出現明顯上漲趨勢,72 h 時表達量陡增,隨后增幅減小,至96 h 達到最大;CHI基因的表達極低(圖5)。
設計引物(表1),以紅葉芥第一鏈cDNA 為模板,使用ExTaqDNA Polymerase(Takara)分別擴增CHI、DFR和ANS,E.Z.N.ATMGel Extraction Kit(OMEGA)回收目的片段,將回收的片段克隆至pMD19-T Simple Vector(Takara),將菌液PCR 為陽性的重組子送至Invitrogen 測序。CHI通過引物CHI90-f 和CHI90-r 得到部分目的片段后,使用3′-Full RACE Core Set Ver.2.0(Takara)得到3′端cDNA 序列。
2.2.2 低溫脅迫 在8 ℃低溫脅迫下,DFR基因和ANS基因的表達隨著處理時間的推移持續增長,在處理48 h 時達到最大,以后小幅下降;CHI基因在整個處理過程中相對于其他兩個基因表達量極低,僅在處理24 h 時表達量有所上升,隨后又降至最低(圖3)。
模擬干旱脅迫:光溫條件不變,用10% PEG6000灌根模擬干旱脅迫。處理后12、24、48、72、96 h 各取葉片1 次。低溫脅迫:光照強度、光照時長和相對濕度保持不變,光照培養與暗培養溫度調整為8 ℃進行處理。處理后1、6、12、24、48、96 h 各取葉片1 次。強光脅迫:溫度、光照時長、相對濕度保持不變,將光照強度提高至405 μmol·m-2·s-1進行處理。處理后3、12、24、48、72、96 h 各取葉片1 次。
桐廬縣氣象臺7月26日9時、12時發布的短期天氣預報指出:“明天晴到多云,午后局部有陣雨或雷雨,偏南風3級,氣溫26~38 ℃”。15時、18時發布的短期天氣預報指出:“明天晴到多云,午后局部有陣雨或雷雨,雷雨時短時風雨較大,偏南風3級,氣溫27~38 ℃”。

圖1 CHI、DFR 和ANS 基因在模擬干旱脅迫下的表達
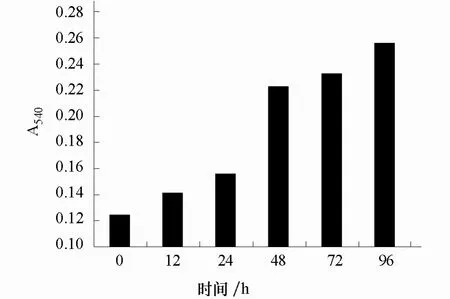
圖2 模擬干旱脅迫下花青素含量的變化

表4 模擬干旱、低溫、強光脅迫下CHI、DFR、ANS 基因表達量和花青素含量的Pearson 相關性分析
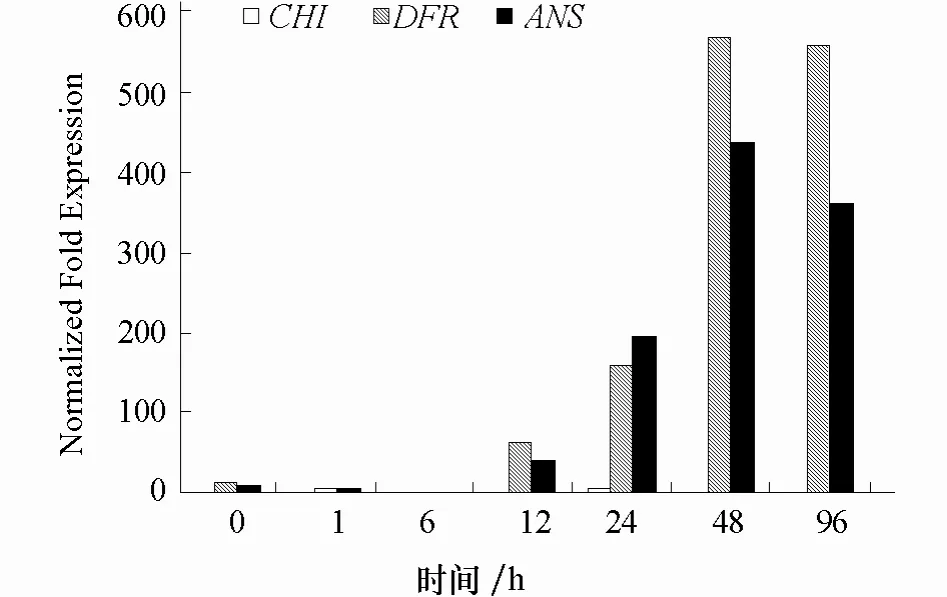
圖3 CHI、DFR 和ANS 基因在低溫脅迫下的表達

圖4 低溫脅迫下花青素含量的變化
如表4所示,低溫脅迫下,CHI、DFR和ANS基因表達量與花青素含量呈現極顯著相關,且DFR基因和ANS基因相關性更高,基因間ANS與DFR也達到了極顯著相關,而CHI基因與ANS、DFR基因的相關性較低。
如表4所示,模擬干旱脅迫下,CHI、DFR和ANS基因表達量與花青素含量的變化極顯著相關,其中CHI基因與花青素含量的相關性最高。CHI、DFR和ANS基因間也呈現極顯著相關,ANS基因與DFR基因相關性較其他更高。
教育教學是情感的互動交流過程;是有溫度教育的具體體現;是實現全人教育的關鍵所在;是學生自我價值體現的關鍵。教育是充滿人性光輝的事業,是實現人的全面發展的教育,尊重學生情惑展現的是教師專業水平,也是教育的核心要素,沒有情感的教育是畸形的,也是無意義的教育,只有將情感融入教育教學全過程,在教學中傳遞情感是教師的職責所在,尊重學生的情感也是教育成敗的關鍵,學生情感得不到尊重,學生就不愿意融入教學,更不可能接受知識,只有“親其師,信其道”,教育才會高效進行。
強光脅迫下紅葉芥的花青素含量從處理12 h 后開始緩慢增長,48 h 后增長變緩(圖6)。
(一)上馬石和銀庭寺。古道通過的里灣村口有一上馬峧(gǎo),峧中有兩方大石,高約1.2~1.6米,當地村民稱這兩方大石為王羲之的上馬石;里、外灣村的村民們叫庵基崗的地方,龍皇堂村民稱為銀庭寺,當地村民說:“先有銀庭寺,后有金庭觀,古代是這樣傳下來的。”
如表4所示,CHI、DFR和ANS基因的表達量與花青素含量呈現極顯著相關,且DFR和CHI基因與花青素含量的相關性高于ANS基因與花青素含量的相關性。DFR基因與CHI基因的表達量無顯著相關。

圖5 CHI、DFR 和ANS 基因在強光脅迫下的表達
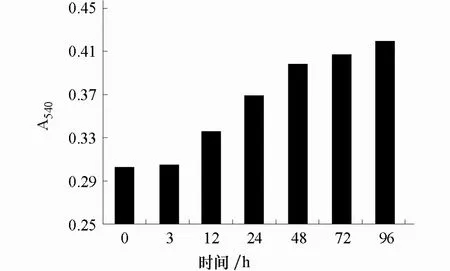
圖6 強光脅迫下花青素含量的變化
3 結論與討論
存在于葉片表皮細胞中的花青素等植物次生代謝產物,在植物遇到低溫、強光或干旱等逆境時大量合成,從而起到保護植物減輕損傷的作用(Holton & Cornish,1995;胡可 等,2010;Huang et al.,2010)。花青素的合成從苯丙氨酸開始,通過兩類基因的調節:一類是植物共有的結構基因,他們直接編碼花青素生物合成途徑中的生物合成酶類,比如苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL)、查爾酮合成酶(chalcone synthase,CHS)、查爾酮異構酶(chalcone isomerase,CHI)、二氫黃酮醇還原酶(dihydroflavonol 4-reductase,DFR)、花青素合成酶(anthocyanindin synthase,ANS)等,而且還通過與WD40、R2R3-MYB 和bHLH 等轉錄因子與結構基因啟動子中相應的順式作用元件的結合(de Vetten et al.,1997;Quattrocchio et al.,1999;Spelt et al.,2000),從而激活或者抑制花青素生物合成途徑中一個或多個結構基因的表達(Ramsay & Glover,2005),最終控制花青素在時空上的變化。在結構基因中,DFR在不同品種間表達的變化存在空間轉移性基因調節,其表達與CHI相協調。對DFR基因的調控通常都導致了花青素成分的改變,最終能產生新奇的葉色或花色(張劍亮,2008)。
本試驗用熒光實時定量RT-PCR 分析了CHI、DFR 和ANS基因在紅葉芥葉片中受環境脅迫(模擬干旱脅迫、低溫和強光)誘導后的表達情況及其與花青素積累的關系。結果表明,這些基因在脅迫處理前表達量都很低甚至不表達,其中DFR和ANS基因在低溫、強光脅迫處理后隨著處理時間的延長表達量顯著增加,而CHI基因處理后表達量極低。CHI基因雖然表達量極低,但在不同脅迫的每個處理過程中都有微量表達(可在模擬干旱脅迫的結果中觀察到,CHI基因隨著處理時間的延長有微量增長,其變化與干旱脅迫下花青素積累量的變化呈極顯著正相關),由此推斷CHI基因在紅葉芥葉片花青素的合成過程中的表達不同于在強光和低溫誘導條件下的調控類型,其表達可能受到其他調控機制的影響。因此,紅葉芥中CHI基因在本試驗設定的環境脅迫條件下與花青素的合成不顯著相關,這一結果可能有以下原因:①紅葉芥中CHI基因受到轉錄后或翻譯后修飾;②查爾酮異構酶超家族基因中的其他家族基因影響了紅葉芥中的花青素合成,本試驗中克隆得到的CHI基因并非控制紅葉芥花青素合成的查爾酮異構酶家族基因;③在沒有相應調控機制的情況下,CHI基因表達量低。
在干旱脅迫下,DFR和ANS基因在脅迫初期表達量較高,處理12 h 后開始下降至很低的水平,至48 h 達到最低,此后表達量升高。可能在脅迫初期存在于花青素途徑共享上游部分途徑的其他次生代謝產物合成途徑,比如類黃酮和原花青素的合成途徑,在整個干旱脅迫的過程中,花青素途徑代謝活躍,參與合成大量的花青素,這兩個基因的表達很可能參與了調控紅葉芥葉片花青素的生物合成(Nakatsuka et al.,2005)。
光照能夠影響花青素的積累及其結構基因的表達,低溫也被認為是另一個重要的因素(Boss et al.,1996;Lewis et al.,1999;Mori et al.,2005)。在本試驗中,經過低溫處理的紅葉芥葉片花青素含量(本試驗中花青素含量包括無色花青素)隨著時間的延長持續增長,在經過一定時間的處理后,增長更為明顯,這與DFR和ANS基因在此期間表達量的上升是一致的。經過模擬干旱脅迫和強光脅迫處理后這兩個基因的表達量也具有相同的變化趨勢,這說明了紅葉芥中花青素的大量積累和結構基因的表達需要一定處理時間的誘導。由此可以推斷,在強光或低溫脅迫下DFR和ANS基因表達上調,對紅葉芥葉片花青素的合成起到了重要的調控作用,這與DFR基因在埃塞俄比亞芥的葉片、洋蔥鱗莖和水稻中的呈色作用相似(Marles et al.,2003;Kim et al.,2004,2005;Furukawa et al.,2007;Park et al.,2007)。DFR和ANS基因表達量的顯著增長與花青素的產生有著明顯的關系,這在后來的Pearson 相關性分析中也得到證實,相關性分析結果表明DFR和ANS基因表達量與花青素含量呈完全正相關,由此推斷本試驗中檢測的DFR和ANS基因屬于紅葉芥花青素生物代謝途徑,在強光和低溫脅迫下對花青素的合成具有重要影響。另外,在強光脅迫下花青素含量與低溫脅迫下花青素含量相差不大,但強光脅迫下DFR基因與ANS基因的表達量是低溫脅迫下表達量的2 倍左右,在強光處理96 h 后DFR與ANS基因的表達量仍是最大值,而低溫脅迫處理48 h 后DFR與ANS基因的表達量開始下降,由此推斷強光和低溫可能誘導了不同的調控機制。
所有面包的基本制作工藝流程是一致的,只是不同的面包品種在面團攪拌、面團發酵環節有差異,也僅僅是增加攪拌、松弛、發酵的次數。
本試驗目前僅對紅葉芥花青素合成途徑的主要結構基因表達特性進行了初步的探討,還沒有較為全面地解釋,而紅葉芥葉片的呈色還受到調控基因和其他因素(輔色素、pH 值等)的影響,還有待于對調控基因以及類黃酮代謝途徑中的其他基因進行進一步的分析和研究。
包滿珠.1997.植物花青素基因的克隆及應用.園藝學報,24(3):279-284.
胡可,韓科廳,戴思蘭.2010.環境因子調控植物花青素苷合成及呈色的機理.植物學報,45(3):307-313.
張劍亮.2008.觀賞向日葵花色形成的機理研究〔博士論文〕.福州:福建農林大學.
張寧,胡宗利,陳緒清,侯曉姝,李勇,陳國平.2008.植物花青素代謝途徑分析及調控模型建立.中國生物工程雜志,28(1):97-105.
張欣.2008.紅葉芥(Brassica junceaCoss.)種質資源紅色素性質及LC/MS 成分研究〔碩士論文〕.重慶:西南大學.
Boss K P,Davies C,Robinson P S.1996.Expression of anthocyanin biosynthesis pathway genes in red and white grapes.Plant Molecular Biology,32:565-569.
Cotroneo P S,Russo M P,Ciuni M,Recupero G R.2006.Quantitative real-time reverse transcriptase-PCR profiling of anthocyanin biosynthetic genes during orange fruit ripening.J Amer Soc Hort Sci,131(4):537-543.
de Vetten N,Quattrocchio F,Mol J,Koes R.1997.The an 11 locus controlling flower pigmentation in petunia encodes a novel WD-repeat protein conserved in yeast,plants,and animals.Genes Dev,11:1422-1434.
Fabienne D,Christiane U.1999.Induction of anthocyanin synthesis in nonpigmented grape cell suspensions by acting onDFRsubstrate availability or precursors level.Enzyme and Microbial Technology,25:316-321.
Furukawa T,Maekawa M,Oki T,Suda I,Iida S,Shimada H,Takamure I,Kadowaki K.2007.TheRcandRdgenes are involved in proanthocyanidin synthesis in rice pericarp.Plant J,49:91-102.
Haskins F A,Gorz H J.1986.Inheritance of leucoanthocyanidin content in sorghum leaves.Crop Science,26:287.
Hironori M,Fumiaki O,Kazuhito S,Hiromi H,Yuzo M.2007.Plant physiology.Rockville,143(3):1252.
Holton T A,Cornish E C.1995.Genetics and biochemistry of anthocyanins biosynthesis.Plant Cell,7:1071-1083.
Huang J L,Gu M,Lai Z B,Fan B F.2010.Functional analysis of the arabidopsisPALgene family in plant growth,development,and response to environmental stress.Plant Physiology,153(4):1526.
Kim S,Binzel M L,Park S,Yoo K S,Pike L M.2004.Inactivation ofDFR(Dihydroflavonol 4-reductase)gene transcription results in blockage of anthocyanin production in yellow onions(Alliumcepa).Mol Breed,14:253-263.
Kim S,Yoo K S,Pike L M.2005.Development of a PCR-based marker utilizing a deletion mutation in the dihydroflavonol 4-reductase(DFR)gene responsible for the lack of anthocyaninproduction in yellow onions(Alliumcepa).Theor Appl Genet,110:588-595.
Koes R,Verweij W,Quattrocchio F.2005.Flavonoids:a colorful model for the regulation and evolution of biochemical pathways.Trends in Plant Science,10:236-242.
Lepiniec L,Debeaujon I,Routaboul J M.2006.Genetics and biochemistry of seed flavonoids.Annual Review of Plant Biology,57:405-430.
Lewis C E,Walker J R L,Lancaster J E.1999.Changes in anthocyanin,flavonoid and phenolic acid concentrations during development and storage of coloured potato(Solanum tuberosumL.)tubers.Sci Food Agric,79:311-316.
Lu X,Zhou W,Gao F.2009.Cloning,characterization and localization ofCHSgene from blood orange,Citrus sinensis(L.)Osbeck cv.Ruby.Mol Bio Rep,36:1983-1990.
Marles M A S,Gruber Y M,Scoles G J,Muir A D.2003.Pigmentation in the developing seed coat and seedling leaves ofBrassica carinatais controlled at the dihydroflavonol reductase locus.Phytochemistry,62:663-672.
Mori K,Sugaya S,Gemma H.2005.Decreased anthocyanin biosynthesis in grape berries grown under elevated night temperature condition.Scientia Horticulture,105:319-330.
Nakatsuka T,Nishihara M,Mishiba K,Yamamura S.2005.Temporal expression of flavonoid biosynthesis-related genes regulates flower pigmentation in gentian plants.Plant Sci,168(5):1309-1318.
Park K I,Ishikawa N,Morita Y,Choi J D,Hoshino A,Iida S.2007.AbHLHregulatory gene in the common morning glory,Ipomoea purpurea,controls anthocyanin biosynthesis in flowers,proanthocyanidin and phytomelanin pigmentation in seeds,and seed trichome formation.Plant J,49:641-654.
Quattrocchio F,Wing J F,van de Woude K,Souer E,de Vetten N,Mol J N,Koes R.1999.Molecular analysis of theanthocyanin 2gene of petunia and its role in the evolution of flower color.Plant Cell,11:1433-1444.
Ramsay N A,Glover B J.2005.MYB-bHLH-WD40 protein complex and the evolution of cellular diversity.Trends in Plant Science,10:63-70.
Spelt C,Quattrocchio F,Mol J N M,Koes R.2000.Anthocyanin of petunia encodes a basic helix-loop-helix protein that directly activates transcription of structural anthocyanin genes.Plant Cell,12:1619-1631.

