TGF-β1作用后老齡大鼠心肌成纖維細胞p38 MAPK通路和JNK通路的變化
林運靈, 李維維, 陳良龍
(福建醫科大學附屬協和醫院心內科,福建福州350001)
老齡是心肌梗死后不良事件發生的獨立預測因素[1-2]。在成功接受經皮冠狀動脈介入治療后,70歲以上心肌梗死患者發生心室重塑、心力衰竭的比例較70歲以下人群增高[3]。老齡使得心肌損傷后修復機制受損,從而導致加劇心梗后心室重塑、心功能惡化,但其具體機制仍未明確。與成年大鼠相比,老齡大鼠心梗后肉芽組織生長緩慢,瘢痕組織中膠原含量明顯下降[4]。在心梗面積可比的情況下,與青年小鼠相比,老齡小鼠心肌梗死區域中肌成纖維細胞密度顯著降低,膠原含量減少,導致瘢痕組織強度減弱,梗死區域擴展,心功能受損更為嚴重[4]。在老齡動物中,損傷修復過程中成纖維細胞向肌成纖維細胞分化發生障礙,但其具體機制仍未闡明。轉化生長因子β1(transforming growth factor β1,TGF-β1)通過Smad及非Smad信號通路參與器官損傷后的修復過程。TGF-β1在心肌梗死后大量表達,是激活成纖維細胞最關鍵的分子[5];研究顯示,老齡小鼠心肌成纖維細胞TGF-β1/Smad信號通路受損;但老齡對心肌成纖維細胞TGF-β1的非Smad信號通路是否有影響,目前尚不清楚。本研究觀察老齡大鼠成纖維細胞對TGF-β1作用后p38絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和c-Jun氨基端激酶(c-Jun N-terminal kinase,JNK)磷酸化水平的變化,探討老齡對大鼠心肌成纖維細胞TGF-β1的非Smad信號通路的影響。
材料和方法
1 動物與主要試劑
健康雄性Sprague-Dawley(SD)乳鼠(3 d)及老齡(24月齡)大鼠,清潔級,購自上海斯萊克實驗動物有限公司。DMEM培養基、膠原蛋白酶和MTT購自Sigma。胎牛血清購自HyClone。抗波形蛋白抗體、α-平滑肌肌動蛋白(α-smooth muscle actin,α-SMA)購自Abcam。Phospho-p38、phospho-JNK購自CST。
2 方法
2.1 大鼠心臟成纖維細胞培養 SD大鼠斷頸處死后,常規消毒胸腹部皮膚,暴露出心臟,沿心臟根部剪下心臟,放入含肝素的PBS中洗凈血液,去除心房和殘留的主動脈。將心臟移至消化管中,剪碎,加入II型膠原酶消化液10 mL,37℃水浴中消化20 min,自然沉淀后棄去上清。再加入上述酶消化液10 mL,在37℃水浴中消化后,小心吸取上清,用含5%FBS的DMEM中和膠原酶,200×g離心7 min,沉淀用DMEM懸浮后4℃保存。重復上述消化過程直至組織塊完全被消化。DMEM懸浮的細胞經200×g離心7 min后以含15% 胎牛血清(fetal bovine serum,FBS)的DMEM懸浮,經細胞篩過濾后,放入CO2培養箱中靜置2 h使心臟成纖維細胞貼壁。生長近融合時以1∶3傳代,實驗采用第3代細胞,經無血清培養24 h后進行干預[6]。
2.2 實驗分組及干預 實驗分為4組,分別為乳鼠PBS對照組(N1組),加入等體積的PBS;乳鼠TGF-β1干預組(N2組),加入TGF-β1(5 μg/L);老齡鼠PBS對照組(A1組),加入等體積的PBS;老齡鼠TGF-β1干預組(A2組),加入TGF-β1(5 μg/L)。
2.3 免疫細胞化學 心肌成纖維細胞終止培養,漂洗后4%多聚甲醛固定,室溫下30 min,PBS沖洗3次,每次5 min;滴加0.3%Triton-X 100,室溫下8 min,PBS沖洗3次,每次5 min;滴加3%H2O2溶液,室溫下10 min,以滅活內源性過氧化物酶的活性,PBS沖洗3次,每次5 min;滴加Ⅰ抗抗波形蛋白肌動蛋白、肌動蛋白,4℃冰箱過夜,PBS沖洗3次,每次5 min;滴加羊抗鼠IgG抗體-HRP多聚體,37℃孵育30 min,PBS洗3次,每次5 min;DAB顯色10~15 min,自來水沖洗,蘇木素復染,中性樹膠封片。每組染色均設有陰性對照,以0.01 mol/L PBS代替Ⅰ抗。2.4 MTT法測定細胞增殖活力 取對數生長期心肌成纖維細胞5×103cells/well的密度接種于96孔板中,37℃、5%CO2及飽和濕度下培養24 h后換無血清DMEM培養基,繼續培養24 h后,吸棄各孔培養基,隨后分組再培養24 h。各組于藥物刺激結束前4 h,吸棄上清,加入MTT 20 μL,37℃、5%CO2培養4 h后,吸棄孔內培養上清液,加入二甲基亞砜150 μL,振蕩10 min,在酶聯免疫檢測儀上490 nm處測定吸光度。
2.5 Western blotting檢測心肌成纖維細胞p38和JNK蛋白磷酸化水平 每孔中均加入200 μL裂解緩沖液(50 mmol/L Tris-HCl,pH 8.0,150 mmol/L NaCl,1%NP-40,0.5%sodium deoxycholate,0.1% SDS,100 mg/L PMSF,2 mg/L aprotinin),置于冰上充分裂解,用刮棒將細胞刮下,然后將細胞碎片和裂解液移至0.6 mL離心管中。加入等體積的2×SDS (臨用前加入5×DTT液),超聲振蕩5 min,立即放入水浴鍋中100℃煮10 min,4℃12 000 r/min離心10 min,取上清分裝,-20℃保存備用。上清液中蛋白濃度以BCA法測定。取等量蛋白(50 μg/well),經SDS-PAGE分離,電轉移至硝酸纖維素濾膜上,脫脂奶粉封閉,加入1∶500稀釋的Ⅰ抗,4℃過夜,用辣根過氧化物酶標記的Ⅱ抗檢測目標蛋白。ECL化學發光試劑顯色,X線膠片壓片、顯影、定影,圖像分析系統測定目的條帶灰度值,以目的蛋白與GAPDH條帶的吸光面積積分比值來評定其蛋白表達水平。
3 統計學處理
用SPSS 11.5統計軟件分析處理,數據以均數±標準差(±s)表示。兩組結果比較采用t檢驗,多組結果比較采用單因素方差分析及Turkey檢驗進行兩兩比較,以P<0.05為差異有統計學意義。
結果
1 心肌成纖維細胞的培養觀察及鑒定
在倒置顯微鏡下觀察,心肌成纖維細胞呈梭形、多角形,細胞質透明,細胞核明顯大,呈橢圓形,常含有2~3個核(圖1A)。細胞抗波形蛋白染色陽性,平滑肌肌動蛋白陰性,符合心肌成纖維細胞染色特征(圖1B、C)。
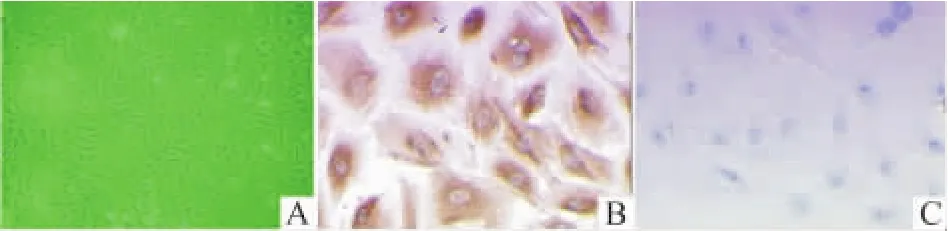
Figure 1.Morphological observation and identification of cardiac fibroblasts(×200).A:morphology of cardiac fibroblasts under phase-contrast microscope;B:immunocytochemical staining for vimentin in cardiac fibroblasts;C:immunocytochemical staining for actin in cardiac fibroblasts.圖1 心肌成纖維細胞形態學觀察及鑒定
2 各組細胞增殖對比
在無TGF-β1刺激時,N1組與A1組平均吸光度無顯著差異(0.36±0.04 vs 0.32±0.03,n=6,P>0.05);在加入TGF-β1后,A2組平均吸光度較N2組顯著減低(0.54±0.06 vs 0.44±0.05,n=6,P<0.05),提示在TGF-β1作用下,老齡組心肌成纖維細胞增殖能力下降。
3 各組總p38及磷酸化p38的表達水平
Western blotting顯示,各組總p38蛋白表達水平沒有顯著差異;加入TGF-β1后,N2組的磷酸化p38較N1組明顯升高(0.80±0.12 vs 0.18±0.03,n= 6,P<0.05);A2組的磷酸化p38較A1組明顯升高(0.42±0.14 vs 0.16±0.05,n=6,P<0.05);與N2組相比,A2組磷酸化 p38表達水平顯著下降(P<0.05),見圖2。
4 各組總JNK及磷酸化JNK的表達水平
Western blotting顯示,各組總JNK蛋白表達水平沒有顯著差異;加入TGF-β1后,N2組的磷酸化JNK較N1組明顯升高(0.93±0.21 vs 0.06±0.02,n=6,P<0.05);A2組的磷酸化JNK較A1組明顯升高(0.54±0.16 vs 0.05±0.01,n=6,P<0.05);與N2組相比,A2組磷酸化JNK表達水平顯著下降(P<0.05),見圖3。
討論
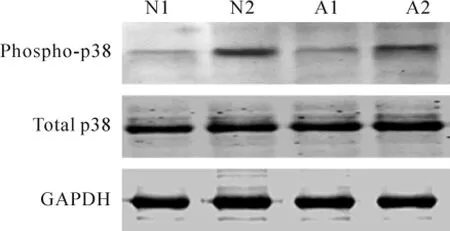
Figure 2.Expression of total p38 and phospho-p38 in cardiac fibroblasts treated with TGF-β1.N1:neonatal cardiac fibroblasts;N2:neonatal cardiac fibroblasts treated with TGF-β1;A1:aged cardiac fibroblasts;A2: aged cardiac fibroblasts treated with TGF-β1.圖2 各組總p38及磷酸化p38的表達水平
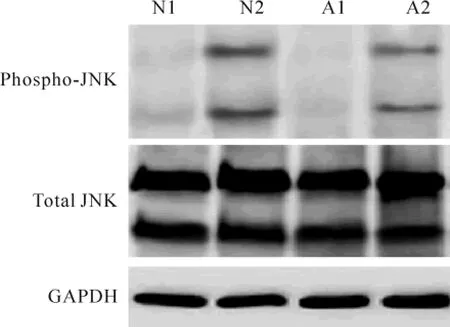
Figure 3.Expression of total JNK and phospho-JNK in cardiac fibroblasts treated with TGF-β1.N1:neonatal cardiac fibroblasts;N2:neonatal cardiac fibroblasts treated with TGF-β1;A1:aged cardiac fibroblasts;A2:aged cardiac fibroblasts treated with TGF-β1.圖3 各組總JNK及磷酸化JNK的表達水平
心肌成纖維細胞是心臟中數量最多的間質細胞,占心臟非心肌細胞的90%~95%,也是心臟細胞外基質(extracellular matrix,ECM)蛋白的主要分泌細胞,在維持正常心臟的ECM中具有非常重要的作用,還是病理性心肌纖維化和心室重塑的關鍵性調節因子[7-8]。成纖維細胞是組織損傷修復的主要效應細胞。研究表明,在正常情況下心肌成纖維細胞處于靜止狀態,急性心肌梗死后,靜止狀態的成纖維細胞在機械應力及細胞因子如TGF-β1、血管緊張素II(angiotensin II,Ang II)、內皮素(endothelin,ET)、白細胞介素-1β(interleukin-1β,IL-1β)等病理因素的作用下發生活化,激活后的成纖維細胞(即肌成纖維細胞)遷移到心梗區域,表達α-平滑肌肌動蛋白,分泌炎癥因子、趨化因子、生長因子等,啟動損傷后心肌修復過程[5,9]。老齡導致組織損傷后愈合能力下降。與青年人相比,老齡患者傷口愈合速度緩慢[10-11];老齡動物在創傷愈合過程中對外源性生長因子反應低下[12]。TGF-β1是最重要的促纖維化生長因子,可誘導心肌成纖維細胞分化為肌成纖維細胞,為諸多因素所致心肌纖維化的共同通路。
TGF-β1信號轉導通路包括Smad及非Smad信號通路兩類[13-14]。TGF-β1通過 Smad與非 Smad信號通路(包括p38和JNK),參與心肌成纖維細胞向肌成纖維細胞的活化過程,活化的肌成纖維細胞分泌膠原,參與心肌纖維化過程[15]。MAPK信號通路是TGF-β1非Smad信號通路中最重要的。既往研究顯示,老齡導致心肌成纖維細胞增殖能力[16]及遷移能力減弱[17]。與青年大鼠相比,老齡大鼠心梗后TGF-β1的含量并沒有顯著變化,然而,老齡大鼠成纖維細胞對TGF-β1反應低下,可能與Smad蛋白磷酸化水平減弱導致 TGF-β1/Smad通路受損有關[4]。本研究結果顯示,在接受TGF-β1刺激后,老齡大鼠心肌成纖維細胞增殖能力下降;無論是新生大鼠心肌成纖維細胞還是老齡大鼠心肌成纖維細胞的p38及JNK磷酸化水平均明顯升高,提示TGF-β1可能同時激活心肌成纖維細胞中的p38及JNK信號通路;本研究同時觀察到,老齡組心肌成纖維細胞的p38及JNK磷酸化水平均較幼鼠組下降,提示老齡不僅使TGF-β1/Smad通路受損,同樣使得心肌成纖維細胞的TGF-β1/MAPK信號通路相關蛋白功能受損。
[1] St John Sutton M,Pfeffer MA,Moye L,et al.Cardiovascular death and left ventricular remodeling two years after myocardial infarction:baseline predictors and impact of long-term use of captopril:information from the Survival and Ventricular Enlargement(SAVE)trial[J].Circulation,1997,96(10):3294-3299.
[2] Maggioni AP,Maseri A,Fresco C,et al.Age-related increase in mortality among patients with first myocardial infarctions treated with thrombolysis[J].N Engl J Med,1993,329(20):1442-1448.
[3] Carrabba N,Parodi G,Valenti R,et al.Comparison of effects of primary coronary angioplasty on left ventricular remodeling and heart failure in patients<70 versus≥70 years with acute myocardial infarction[J].Am J Cardiol,2009,104(7):926-931.
[4] Bujak M,Kweon HJ,Chatila K,et al.Aging-related defects are associated with adverse cardiac remodeling in a mouse model of reperfused myocardial infarction[J].J Am Coll Cardiol,2008,51(14):1384-1392.
[5] van den Borne SW,Diez J,Blankesteijn WM,et al.Myocardial remodeling after infarction:the role of myofibroblasts[J].Nat Rev Cardiol,2009,7(1):30-37.
[6] 洪華山,林 嵐,王一波.胰島素促進心肌成纖維細胞增殖和心肌細胞肥大的作用[J].中國病理生理雜志,2002,18(5):505-509.
[7] Berschneider HM.Fibroblast modulation of intestinal secretory responses[J].Ann N Y Acad Sci,1992,664:140-147.
[8] Brown RD,Ambler SK,Mitchell MD,et al.The cardiac fibroblast:therapeutic target in myocardial remodeling and failure[J].Annu Rev Pharmacol Toxicol,2005,45:657-687.
[9] Souders CA,Bowers SL,Baudino TA.Cardiac fibroblast: the renaissance cell[J].Circ Res,2009,105(12):1164-1176.
[10] Holt DR,Kirk SJ,Regan MC,et al.Effect of age on wound healing in healthy human beings[J].Surgery,1992,112(2):293-297.
[11] Ashcroft GS,Horan MA,Ferguson MW.The effects of ageing on cutaneous wound healing in mammals[J].J Anat,1995,187(Pt 1):1-26.
[12] Wu L,Xia YP,Roth SI,et al.Transforming growth factor-β1 fails to stimulate wound healing and impairs its signal transduction in an aged ischemic ulcer model:importance of oxygen and age[J].Am J Pathol,1999,154 (1):301-309.
[13] Bujak M,Frangogiannis NG.The role of TGF-β signaling in myocardial infarction and cardiac remodeling[J].Cardiovasc Res,2007,74(2):184-195.
[14] Zhang YE.Non-Smad pathways in TGF-β signaling[J].Cell Res,2009,19(1):128-139.
[15] Biernacka A,Dobaczewski M,Frangogiannis NG.TGF-β signaling in fibrosis[J].Growth Factors,2011,29(5): 196-202.
[16] Lindsey ML,Goshorn DK,Squires CE,et al.Age-dependent changes in myocardial matrix metalloproteinase/ tissue inhibitor of metalloproteinase profiles and fibroblast function[J].Cardiovasc Res,2005,66(2):410-419.
[17] Cieslik KA,Trial J,Entman ML.Defective myofibroblast formation from mesenchymal stem cells in the aging murine heart rescue by activation of the AMPK pathway[J].Am J Pathol,2011,179(4):1792-1806.

