乙烯雌酚誘導的大鼠垂體瘤模型的建立*
張 猛, 張秋生, 林恒州, 紀 濤, 梁世杰, 李維平△
(1廣州醫學院研究生學院,廣東廣州510182;2深圳市第二人民醫院神經外科,廣東深圳518035)
垂體瘤是常見的顱內腫瘤之一,其發生率中僅次于腦膠質細胞瘤和腦膜瘤,約占顱內腫瘤的10%~15%。但尸體解剖中垂體瘤發現率可達10%~30%。由于腫瘤的局部壓迫、垂體激素分泌紊亂而表現出一系列的臨床癥狀和體征,嚴重影響人類的健康,同時也是不孕的重要原因之一。垂體患者的生活質量明顯降低。垂體瘤目前具體發病機制尚未明了。動物模型是研究腫瘤發病機制及治療作用的重要工具。雌激素誘發大鼠垂體瘤模型普遍為泌乳素腺瘤,在免疫組化和內分泌上與人垂體泌乳素瘤相似,外周血催乳素(prolactin,PRL)均顯著升高,且有成模快、確切等優點,常被用于垂體瘤發病機制及藥物療效等研究。本項研究擬于Wistar-Furth大鼠腹腔內注射溶于滅菌花生油(arachis oil,AO)的己烯雌酚(diethylstilbestrol,DES)誘導垂體瘤發生,并設立滅菌花生油注射及假注射組作為對照,觀察注射后不同時間內Wistar-Furth大鼠行為學、垂體形態學及組織學變化,免疫組化法對成瘤細胞分型,并對比各組不同時點組織中CD31的表達,構建合格的垂體瘤動物模型,為后繼研究提供基礎。
材料和方法
1 動物
Wistar-Furth大鼠(購自中山大學動物實驗中心)60只,體重60~80 g,雌雄不拘。所有動物于常溫、恒濕(55% ± 5%)、明暗交替光照環境(12/12)飼養,投清潔級標準顆粒飼料,自由飲用純凈水。本實驗所涉及動物的處理均經過深圳市第二人民醫院(深圳大學附屬第一醫院)倫理委員會批準。
2 主要試劑
二乙基己烯雌酚(Sigma),抗PRL多克隆抗體(Abcam),抗生長激素(growth hormone,GH)多克隆抗體(Abcam),抗促腎上腺皮質激素(adrenocorticotropic hormone,ACTH)多克隆抗體(Abcam),抗CD31抗體(Abcam),3,3'-二氨基聯苯胺四鹽酸鹽(3,3'-diaminobenzidine tetrahydrochloride,DAB)顯色試劑盒(北京中杉金橋,ZLI-9048),10%水合氯醛(深圳市兒童醫院試劑室),滅菌花生油(山東魯花;由深圳市第二人民醫院供應室以環氧乙烷法滅菌)。
3 主要方法
3.1 動物分組及處理 隨機分3組:DES組、AO組及對照組(control)。注射前分別稱重。DES組腹腔內注射5 mg/kg DES溶液,AO組注射等量花生油,對照組僅穿刺不注射,3組均為2次/周。處理后按設計條件飼養,分別于4周、8周及12周隨機處死,見表1。

表1 實驗動物分組情況Table 1 .Group assignment of experimental animals
3.2 行為學觀察 動物每2 d于Moris水迷宮中進行行為學觀察20 min,同時觀察體毛變化、體重和進食情況。
3.3 標本留取與保存 按照設定時點分別對實驗大鼠腹腔注射水合氯醛麻醉(300 mg/kg),心臟穿刺取血約2 mL備用。等速灌注4%多聚甲醛PBS液后,緊貼枕骨大孔處離斷大鼠頭顱,用血管鉗自枕骨大孔逐塊咬除枕骨、頂骨和額骨,剪斷顱底血管、神經,將鼠腦翻向腹側,手術顯微鏡下觀察垂體組織與周圍結構的關系,觀察垂體有無卒中。垂體稱重后于4%多聚甲醛PBS內固定。
3.4 血清PRL濃度測定 鼠血經3 000 r/min離心15 min分離血清,按放免測定試劑盒提供的標準程序測定血清PRL濃度。
3.5 病理與免疫組織化學檢查 常規石蠟包埋組織,切片(厚4~5 μm),HE染色后高倍鏡下觀察腺垂體組織的形態學改變情況,以確定垂體瘤發生與否。垂體瘤誘發率=(誘發數/實驗數)×100%。
切片常規脫水后行免疫組化檢測。采用免疫組化染色步驟二步法:備用切片,用0.01 mol/L PBS水化3 min。3%甲醇-雙氧水室溫孵育10 min,消除內源性過氧化物酶的活性。0.01 mol/L PBS緩沖液洗5 min×3次。0.1 mol/L枸櫞酸緩沖液高壓鍋加熱到126~130℃,抗原修復4 min,自然冷卻至室溫。0.01 mol/L PBS緩沖液洗5 min×3次。滴加Ⅰ抗(抗PRL、抗ACTH、抗GH及抗CD31抗體),0.01 mol/L PBS緩沖液作為稀釋液4℃冰箱過夜。0.01 mol/L PBS緩沖液洗5 min×3次。滴加辣根過氧化物酶標記的Ⅱ抗IgG(PV-6000)工作液,37℃水浴鍋內孵育30 min。0.01 mol/L PBS緩沖液洗2 min×3次。DAB顯色劑顯色5 min,自來水終止顯色。常規梯度乙醇脫水,二甲苯透明,中性樹膠封片。以PBS代替Ⅰ抗進行上述染色作為空白對照。
隨機5個高倍鏡下觀察DAB陽性細胞比例并求均值,按照陽性細胞比例進行分級:<25%為I級,25%~50%為II級,50%~75%為III級,>75%為IV級。
4 統計學處理
結果
1 行為學、一般表現及體重變化
處理后10 d左右,DES組部分大鼠出現行走緩慢,食欲不振,但未見出現明顯神經系統功能缺失表現。Moris水迷宮觀察3組大鼠之間無明顯差異。約第3周開始,DES組大鼠毛發光澤較其余2組變暗,并逐漸出現脫毛,以軀干最為明顯。DES組在11周死亡2只,其余均大鼠存活至相應處死時點。
在實驗進行過程中,3組大鼠體重均有不同程度的增長,但DES組大鼠體重增長速度在第2周后較其余2組明顯減慢(P<0.01),AO組及對照組體重增長速度無明顯差異,見圖1。
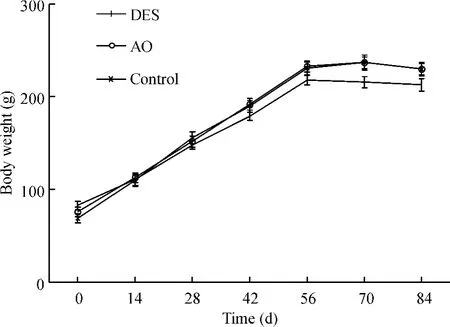
Figure 1.Body weight changes in rats of each group.±s.n= 10.DES:diethylstilbestrol;AO:arachis oil.圖1 不同時點3組大鼠體重變化情況
2 大鼠垂體重量及血清泌乳素變化
第4周DES組垂體平均重量較AO組及對照組略高,第8周及第12周DES組垂體平均重量較AO組及對照組明顯升高。血清PRL平均值在第4周后DES組較AO組及對照組均明顯升高。平均垂體重量及血清PRL在AO組及對照組間無明顯差異,見表2。
表2 不同處死時間點各組大鼠垂體重量及血清泌乳素水平Table 2 .The weight(mg)of rat pituitary gland and the serum prolactin level(μg/L)in each group at different time points(±s.n =15)
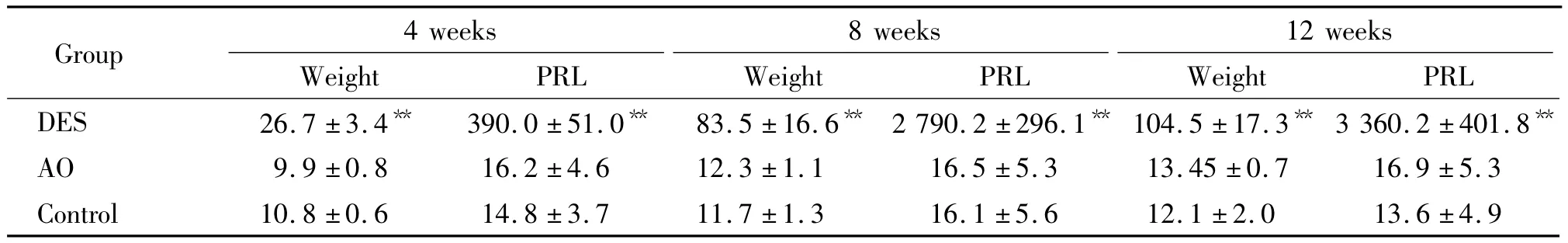
表2 不同處死時間點各組大鼠垂體重量及血清泌乳素水平Table 2 .The weight(mg)of rat pituitary gland and the serum prolactin level(μg/L)in each group at different time points(±s.n =15)
**P<0.01 vs AO or control.
?
3 成瘤情況大體及HE染色觀察結果
第4周DES組有30%(3/10)大鼠垂體組織出現了瘤樣改變。大體表現為垂體體積較AO組及對照組增大,但表面色澤無明顯變化。光鏡HE染色表現為腺垂體側翼靠近其邊緣的部分瘤樣細胞的形成和原有的腺管樣結構消失,未見出血或淋巴細胞浸潤。第8周DES組有90%(9/10)出現瘤樣改變。大體表現為垂體體積較AO組及對照組顯著增大,顏色較AO組及對照組深,呈暗紅色,部分腫瘤包膜下有血。光鏡下HE染色見細胞數目增多明顯,細胞呈圓形或多角形,胞漿帶增寬,核大小不一,深染,有核異型性,腫瘤充血并可見新生血管,腺管樣結構呈總體消失狀態。第12周DES組100%(8/8)出現瘤樣改變,垂體大小較AO組及對照組顯著增大,并見瘤內出血表現。另外,第11周DES組意外死亡2只大鼠(均為雌性),大體及光鏡下表現同第12周處死的大鼠。未形成腫瘤的DES組大鼠垂體切片可見有少量的新生血管,但未見明顯瘤樣細胞及核異形。
DES組第4周處死的大鼠中,成瘤鼠3只均為雌性,第8周處死的大鼠中,成瘤鼠有5只為雌性,第12周處死的大鼠中,成瘤鼠有3只為雌性,但第11周意外死亡的2只均成瘤,且為雌性。Fisher確切概率檢驗結果顯示,P>0.05,提示雌雄之間總體成瘤情況無明顯差異,見表3。
在第4周、第8周及第12周處死的AO組及對照組大鼠垂體未見相應改變。垂體色澤均呈灰白色,光鏡下HE染色見細胞呈均勻圓形,未見異常形態細胞、核異形及新生血管。
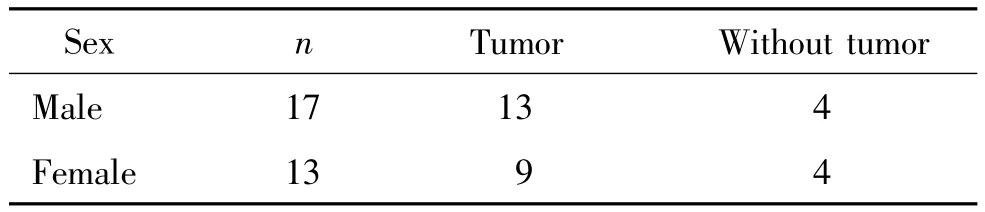
表3 DES組雌雄大鼠成瘤情況對比Table 3 .Pituitary tumor incidence of male and female rats in DES group
4 免疫組化分析腫瘤類型
分別使用3種抗垂體激素抗體通過免疫組織化學法對腫瘤細胞類型進行了鑒定。與AO組及對照組相比,DES組垂體瘤樣變化部位細胞表現為PRL陽性,部分可見散在的ACTH陽性細胞分布,見圖2;而GH無明顯表達。第4周及第8周DES組未形成腫瘤的垂體組織部分細胞仍可見較高PRL表達,見圖3。
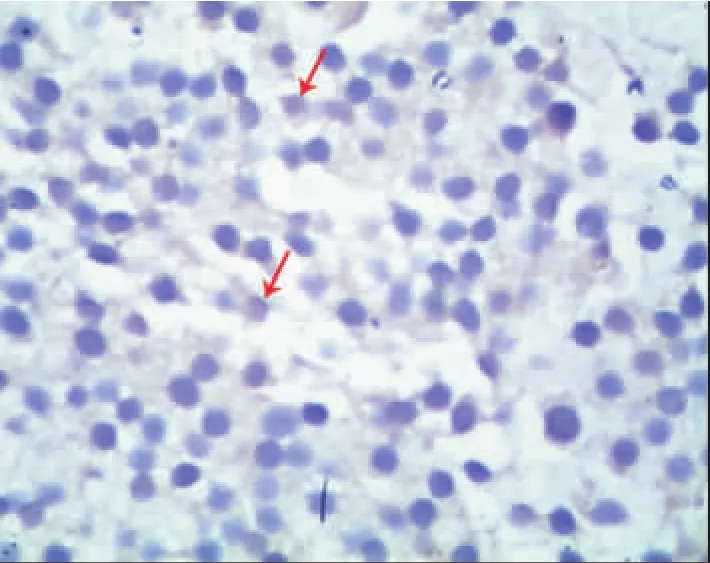
Figure 2.Rat pituitary tissue in DES group(immunohistochemical staining,×400).Red arrows show a small amount of anti-ACTH positive cells.圖2 DES組大鼠垂體的抗ACTH免疫組化染色
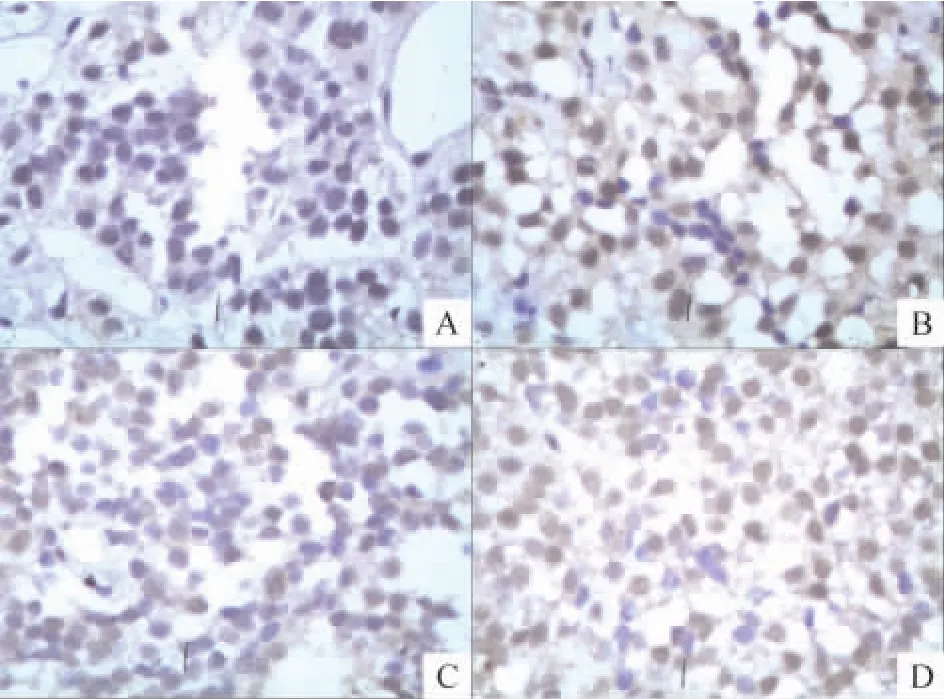
Figure 3.Pituitary tissues of rats sacrificed at 12 weeks in AO group and rats sacrificed at 4 weeks,8 weeks,and 12 weeks in DES group(immunohistochemistry with anti-PRL,×400).A:AO Group at 12 weeks;B:DES group at 4 weeks;C:DES group at 8 weeks;D:DES group at 12 weeks.圖3 于12周處死的AO組大鼠及4周、8周和12周處死的DES組大鼠垂體組織抗PRL免疫組化染色
5 成瘤過程中CD31表達的動態變化
高倍鏡下,AO組及對照組大鼠垂體組織僅胞漿中有少量CD31表達,而在有瘤樣改變的垂體組織中,CD31陽性表達見于增生的血管內皮細胞、血管壁及瘤樣改變的細胞中,實體區內皮細胞則未見有CD31陽性表達。DES組大鼠未成瘤垂體在增生的血管內皮細胞、血管壁中可見有CD31陽性較高表達,見圖4。
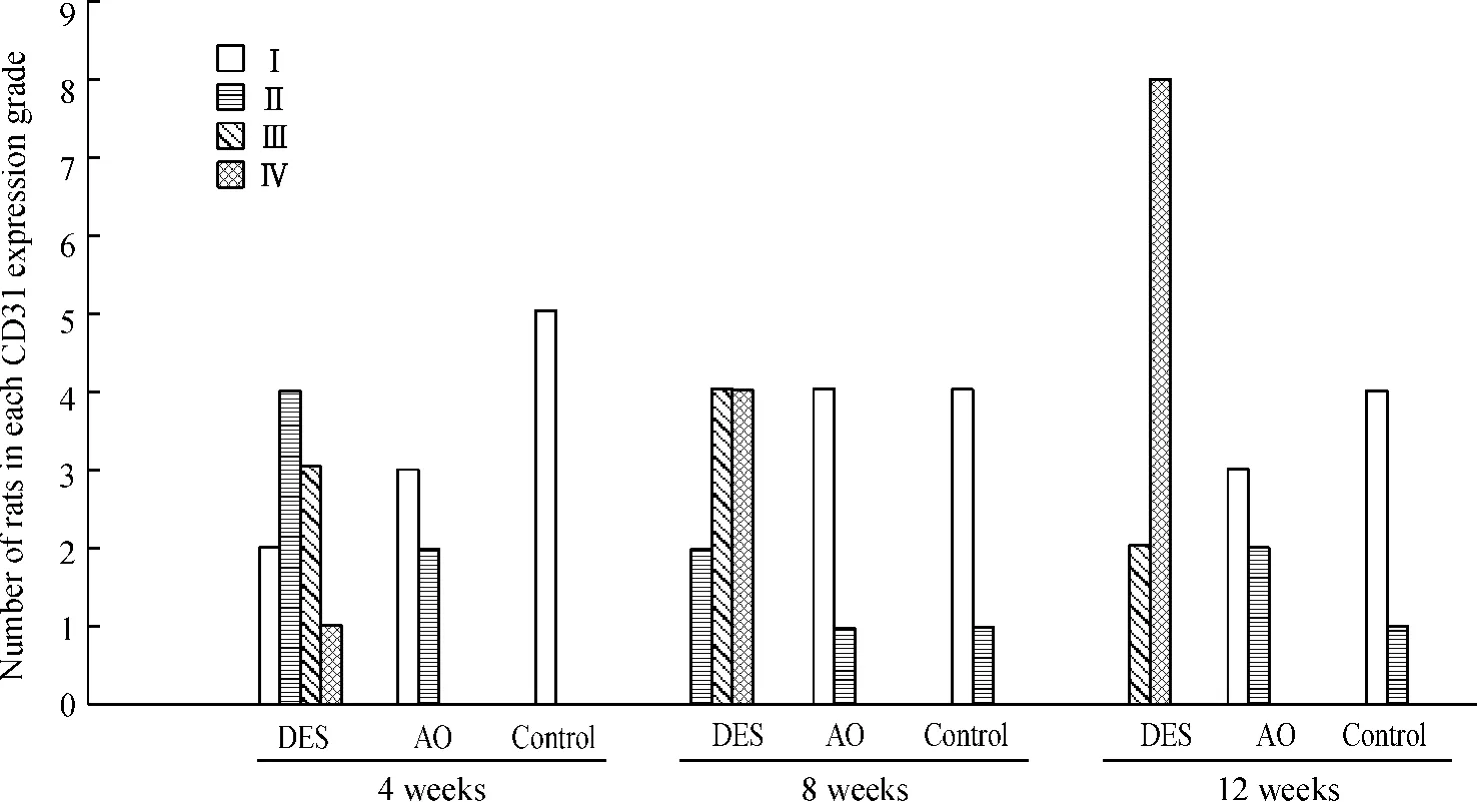
Figure 4.The expression of CD31 in rat pituitary tissues from different groups.The proportion of DAB-positive cells less than 25% is grade I,25%~50%is grade II,50%~75%is grade III,and large than 75%is grade IV.圖4 各時段不同組別大鼠垂體組織中CD31的表達情況
討論
1 垂體瘤動物模型研究現狀
泌乳素腺瘤是發生于垂體前葉泌乳素上皮細胞的腫瘤,在各種垂體瘤中,泌乳素腺瘤發生率高達60%。盡管采用藥物、放射治療和外科治療干預,其復發率仍較高[1]。由于垂體的特殊性,正常垂體難以獲得,所以人們建立了多種垂體瘤動物模型,以研究垂體瘤的病理發生和藥物作用機制。這些模型包括以下4種(1)動物自發性垂體瘤模型:與動物的種系、性別和年齡有關。其優點是腫瘤的生物學特性與人類垂體瘤的生物學特性很相像,但存在的缺點也很明顯,包括獲得成模時間長,效果不確切;腫瘤體積普遍較小,位置深在,不便于觀察,荷瘤動物容易死亡等。(2)雌激素誘導動物垂體瘤模型:其具體機制未完全明了,但文獻報道與種屬有關,如Fischer344大鼠接受長期雌激素,幾周后其腺體異常增長成瘤,質量達到正常垂體質量10~20倍。其它敏感的大鼠品系還有AxC-Irish(ACI)、Wistar-Furth大鼠和Copenhagen (COP)品系。相反,Holtzman、Sprague-Dawley和 Brown-Norway大鼠長期給予雌激素后,其垂體質量仍維持正常。雌激素誘發大鼠垂體瘤模型普遍為PRL腺瘤,且在免疫組化和內分泌上與人垂體泌乳素瘤相似,外周血PRL均顯著升高。且有成模快、確切等優點。但其缺點包括部分表現出對雌激素依賴,成瘤種類單一,絕大多數為泌乳素瘤,僅少部分為混合型腺瘤。(3)移植性垂體瘤模型:按被移植瘤的來源可分為3種:自發性可移植性垂體瘤動物模型、誘發性可移植性垂體瘤動物模型和人類可移植性垂體瘤動物模型。按移植部位分為皮下移植、腎囊內移植和顱內移植。但這種模型和人類PRL瘤有些區別:生長過快、分泌多種激素和惡性特征等缺點。(4)轉基因垂體瘤動物模型:這種模型可以通過對特定靶基因編譯,可以誘發相應類型的垂體腺瘤,但技術要求高,成本高,不利于廣泛開展[2-8]。
雌激素誘導動物垂體瘤模型,其機制可能與雌激素/ERα受體調節基因有關。另外,有報道認為雌激素通過調節垂體泌乳素細胞中多巴胺激活的GIRK通道,從而達到調節泌乳素釋放的機制[9-10]。本實驗系采用腹腔注射雌激素的方法誘導大鼠垂體腺瘤形成,較既往報道的皮下埋置雌激素緩釋膠管方法簡單,沒有皮下切口及異物,成瘤率穩定,在模型形成過程中,血清泌乳素及部分生化指標能出現動態的變化,很好地模擬了人體垂體瘤形成的過程,能為垂體瘤發病機制的研究及后繼的治療研究提供一個穩定的動物模型。但仍是局限于泌乳素腺瘤,部分ACTH陽性表達,可能與內環境的改變有關。如何建立不同激素表達類型的垂體瘤動物模型,仍有待更進一步的深入研究。
2 雌激素誘導大鼠垂體瘤成瘤過程中體重增長速度變化
體重增長減慢是己烯雌酚誘導大鼠泌乳素腺瘤形成過程中的表觀參數之一,本研究中,DES組體重增長速度較AO及對照組明顯下降。有報道在高表達DES-acyl ghrelin的轉基因小鼠中,ghrelin的正常表達受阻,不能有效刺激GH細胞,從而導致生長素分泌減少,血清中IGF-1明顯下降,同時體重減輕,體長明顯下降[11],因此DES誘導垂體瘤大鼠體重增長緩慢可能與泌乳素腺瘤細胞生長過程中生長素細胞數量下降,生長素分泌不足有關。但DES組體重增長減慢的幅度較大多數文獻報道的要低,可能與分次腹腔內注射己烯雌酚,血藥濃度未能像皮下埋置緩釋膠管那樣形成穩態高濃度的刺激。但臨床上垂體泌乳素瘤發生亦是在較高水平雌激素作用下長期緩慢演進的過程,因此本實驗所用方法可能更符合這種實際情況。
3 性別對雌激素誘導大鼠垂體瘤的影響
本組實驗設計時性別采用隨機方法,但DES組中無論雌性還是雄性大鼠,在處理4周后,無論是否形成瘤樣組織,垂體組織均可見新生血管,CD31表達陽性率亦較AO及對照組高。最終形成瘤樣組織大鼠在性別上并無明顯差異。但雄性大鼠形成瘤樣組織較雌性時間長,且DES組中雌性大鼠相同時點PRL較雄性大鼠高,可能與雌性大鼠PRL儲備較高,在實驗過程中大量釋放有關[12]。
4 CD31在垂體瘤發生及生長過程中的作用
CD31是免疫球蛋白超家族中的細胞黏附分子,為130 kD的跨膜糖蛋白,主要分布在血管細胞上。報道證實培養的血管內皮細胞的連接處CD31有高水平表達[13]。抗CD31抗體能夠阻斷正常內皮細胞間連接并影響細胞遷移,從而導致新生血管生成減少,表明他們在血管增生和損傷修復中發揮作用,并可作為內皮細胞特異的標記物,對腫瘤的微血管進行計數。有文獻報道在正常垂體組織中,CD31表達顯著低于手術取得的垂體瘤組織[14]。另有研究對照復發垂體瘤患者組織及未復發患者組織發現,所有垂體瘤組織中均有CD31表達,但復發組陽性血管數明顯高于未復發組,且復發組的CD31染色強度明顯高于未復發組。本研究中檢測到DES組垂體組織中(成瘤或未成瘤),CD31在新生血管內皮細胞、血管壁以及血管周邊瘤樣細胞中表達,說明CD31在血管內皮增生以及瘤細胞增殖過程中均有可能發揮作用。
本實驗可以證實,腹腔內分次注射己烯雌酚在12周左右,可以明確誘導Wistar-Furth大鼠形成垂體瘤,成瘤率可達100%,且腫瘤形成穩定,方法簡便。另外,在成瘤過程中,部分指標如PRL、CD31等均表現出動態變化,可在垂體瘤病因、發病機制、臨床治療、藥物開發與研制中發揮重要作用。
[1] Palaoglu S,Sungur A,Cila A,et al.Diethylstilbestrolinduced prolactinoma:dose-related tumor growth and effect of catecholaminergic cells on prolactin tumor cells[J].Surg Neurol,2005,64(Suppl 2):S42-S47.
[2] Pandey J,Bannout A,Wendell DL,et al.The Edpm5 locus prevents the‘angiogenic switch’in anestrogen-induced rat pituitary tumor[J].Carcinogenesis,2004,25 (10):1829-1838.
[3] Daniel L,Trouillas J,Renaud W,et al.Polysialylatedneural cell adhesion molecule expression in rat pituitary transplantable tumors(spontaneous mammotropic transplantable tumor in Wistar-Furth rats is related to growth rate and malignancy[J].Cancer Res,2000,60(1):80-85.
[4] Heaney AP,Femando M,Melmed S.PPAR-γ receptor ligands:novel therapy for pituitary adenomas[J].Clin Invest,2003,111(9):1381-1388.
[5] Paez-Pereda M,Kovalovsky D,Hopfner U,et al.Retinoic acid prevents experimental Cushing syndrome[J].Clin Invest,2001,108(8):1123-1131.
[6] Fedele M,Battista S,Kenyon L,et al.Overexpression of the HMGA2 gene in transgenic mice leads to the onset of pituitary adenomas[J].Oncogene,2002,21(20):3190-3198.
[7] Pernasetti F,Spady TJ,Hall SB,et al.Pituitary tumorigenesis targeted by the ovine follicle-stimulating hormone beta-subunit gene regulatory region in transgenic mice[J].Mol Cell Endocrinol,2003,203(1-2):169-183.
[8] Tascou S,Trappe R,Nayernia K,et al.TSPY-LTA transgenic mice develop endocrine tumors of the pituitary and adrenal gland[J].Mol Cell Endocrinol,2003,200 (1-2):9-18.
[9] Kim HJ,Gieske MC,Trudgen KL,et al.Identification of estradiol/ERα-regulated genes in the mouse pituitary[J].J Endocrinol,2011,210(3):309-321.
[10] Christensen HR,Zeng Q,Murawsky MK,et al.Estrogen regulation of the dopamine-activated GIRK channel in pituitary lactotrophs:implications for regulation of prolactin release during the estrous cycle[J].Am J Physiol Regul Integr Comp Physiol,2011,301(3):R746-R756.
[11] Ariyasu H,Takaya K,Iwakura H,et al.Transgenic mice overexpressing des-acyl ghrelin show small henotype[J].Endocrinology,2005,146(1):355-364.
[12] Cruz-Soto ME,Scheiber MD,Gregerson KA,et al.Pituitary tumorigenesis in prolactin gene-disrupted mice[J].Endocrinology,2002,143(11):4429-4436.
[13] DeLisser KH,Christofidou-Solomidou M,Strierter RM,et al.Involvement of endothelial PECAM/CD31 in angiogenesis[J].Am J Pathol,1997,151(3):671-674.
[14] Helen ET,Zsusha N,Kevin CG,et al.Angiogenesis in pituitary adenomas and the normal pituitary gland[J].Clin Endocrinol Metab,2000,85(3):1159-1162.

