誘導11β-HSD1表達對GC保護血管內皮炎性損傷作用的影響
王興友 王麗娜 陳曉琳 陳杭薇
根據我們前期研究,初步表明糖皮質激素(GC)能有效保護脂多糖(LPS)誘導的血管內皮炎性損傷[1]。鑒于11β-HSD是目前公認的GC受體前調節的關鍵物質,其兩型同工酶11β-HSD1和11β-HSD2在人臍靜脈內皮細胞中均有組成性表達,同時我們前面的實驗表明內毒素和糖皮質激素對11β-HSD的表達均有影響[2]。因此通過干預人臍靜脈內皮細胞內的11β-HSD表達,必定會對細胞炎癥反應有所影響。甘草次酸(glycyrrhizic acid,GA)作為11β-HSD的傳統抑制劑,在其他組織細胞對11β-HSD表達影響的研究已有很多報道,有研究表明應用甘草次酸類藥物,可抑制嗜酸細胞陽離子蛋白與氣道上皮細胞的結合從而減輕氣道炎癥[3]。但目前有關其對血管內皮細胞11β-HSD影響的研究尚未見報道,鑒于11β-HSD1可增強細胞內GC的活性,而11β-HSD2則降低細胞內GC的活性。因此我們推測,甘草次酸的抗炎作用既與抑制11β-HSD2表達有關,也與增強11β-HSD1表達有關。我們已初步證實甘草次酸對血管內皮細胞11β-HSD2表達的抑制可增強GC的抗炎作用(將另文發表),本實驗擬觀察甘草次酸(GA)能否誘導人臍靜脈內皮細胞11β-HSD1表達,從而增強GC的抗炎作用。
材料與方法
1.實驗材料:(1)主要儀器:PCR擴增儀,Lambda Bio20紫外分光光度計,AlphaImagerTM2200型凝膠成像儀,臺式冷凍離心機,Power AC電泳儀,金屬浴。(2)主要試劑:總RNA提取試劑盒,AMV反轉錄酶,Taq DNA聚合酶,Oligo(dT)15,dNTP,RNA酶抑制劑,DNA marker,甘草次酸,脂多糖,糖皮質激素,ELISA試劑盒。
2.實驗方法:(1)細胞分組及處理:1)GA對單純血管內皮細胞11β-HSD1表達的影響:為了觀察不同濃度GA對11β -HSD1 的基因轉錄的影響,用 10-8、10-7、10-6、10-5、10-3mol/L的GA分別與血管內皮細胞共培養24h,不接觸GA的細胞作對照;2)GA對炎性損傷的血管內皮細胞的效應觀察:①LPS致傷組:在培養細胞中加入100ng/ml的LPS“致傷”24h;②GA保護組:先加10-6mol/L GA 2h后,再用100ng/ml的LPS處理細胞24h;③GA-GC復合組:在培養細胞中先后加入10-6mol/L GA和Dex 2h后,再用100ng/ml的LPS處理細胞24h;④GC保護組:不加GA,在培養細胞中先后加入10-6mol/L Dex 2h后,再用100ng/ml的LPS處理細胞24h;⑤單純GA組:在培養細胞中先后加入10-6mol/L GA后,再繼續培養24h;⑥空白對照組:不用GA、LPS和Dex的正常培養細胞作正常對照。上述各組觀察時相到后分別搜集細胞和培養上清進行有關指標的檢測。(2)HUVEC內11β-HSD1的mRNA表達的檢測:11β-HSD1引物由上海博亞生物技術有限公司合成,各基因引物序列見表 1[4,5]。然后按 RT-PCR常規合成相應的PCR產物,將電泳圖像保存于計算機用Bandscan軟件進行圖像分析,計算人臍靜脈內皮細胞內11β-HSD1的mRNA與β-actin mRNA的灰度比值。(3)IL-6和sICAM-1的檢測:參照文獻[1]進行。(4)HUVEC原位細胞凋亡的檢測:參照文獻[1]進行。
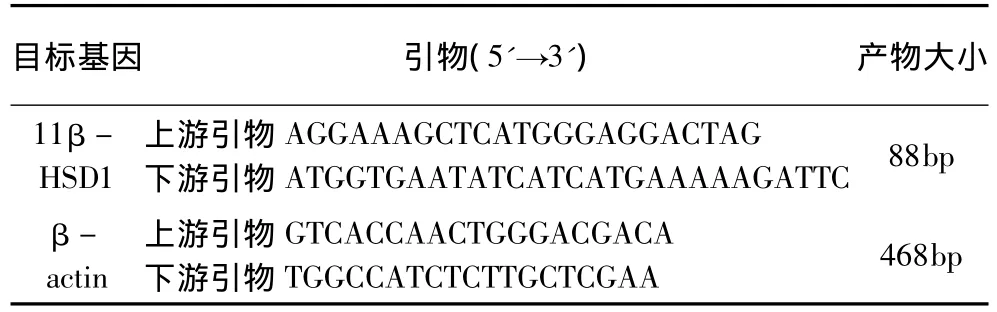
表1 PCR引物的序列及其產物長度
3.統計學方法:使用SPSS 11.0軟件包進行,全部數據都以均數±標準差(±s)表示,組間差異用方差分析,組內差異比較采用t檢驗。結果百分率采用χ2檢驗進行分析,用二變量(Bivariate)Pearson相關系數進行相關分析。以P<0.05為差異顯著,P<0.01表示差異具有非常顯著性意義。
結 果
1.GA對HUVEC11β-HSD1的mRNA表達的影響:(1)GA對血管內皮細胞11β-HSD1 mRNA的影響:在正常培養的細胞可檢測到較少量的11β-HSD1 mRNA,甘草次酸在一定劑量范圍(10-8~10-3mol/L)與細胞血管內皮共培養24h,可引起11β-HSD1 mRNA明顯增加,并隨著劑量的增高,逐漸形成平臺(表2)。(2)GA對地塞米松和 LPS誘導11β-HSD1 mRNA表達的影響:GA本身能明顯誘導11β-HSD1 mRNA的表達,GA對Dex誘導的11β-HSD1 mRNA表達有促進作用,而對 LPS誘導的11β-HSD1 mRNA表達則沒有促進作用,詳見表3。
表2 GA對血管內皮細胞11β-HSD1 mRNA的影響(±s)
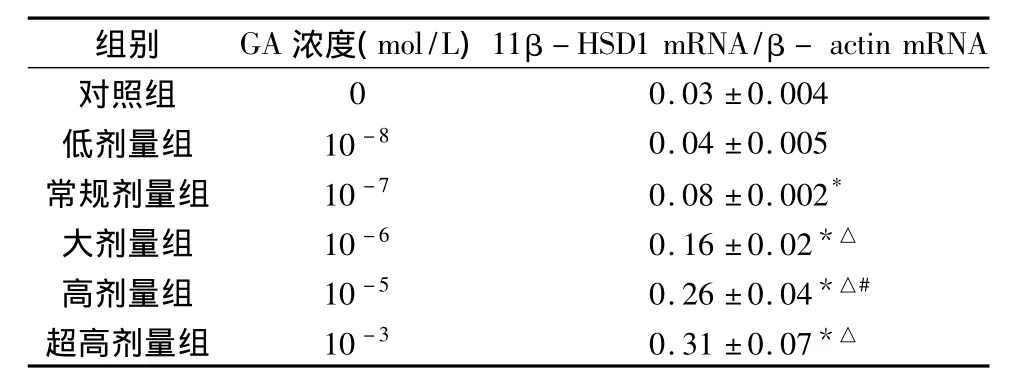
表2 GA對血管內皮細胞11β-HSD1 mRNA的影響(±s)
與對照組相比,*P<0.05;與低劑量組相比,△P<0.05;與大劑量、超高劑量組相比,#P<0.05
組別 GA濃度(mol/L)11β-HSD1 mRNA/β-actin mRNA對照組00.03±0.004低劑量組 10-8 0.04±0.005常規劑量組 10-7 0.08±0.002*大劑量組 10-6 0.16±0.02*△高劑量組 10-5 0.26±0.04*△#超高劑量組 10-3 0.31±0.07*△
表3 大劑量GA(濃度為10-6mol/L)對HUVEC的11β-HSD1 mRNA表達的影響(±s)
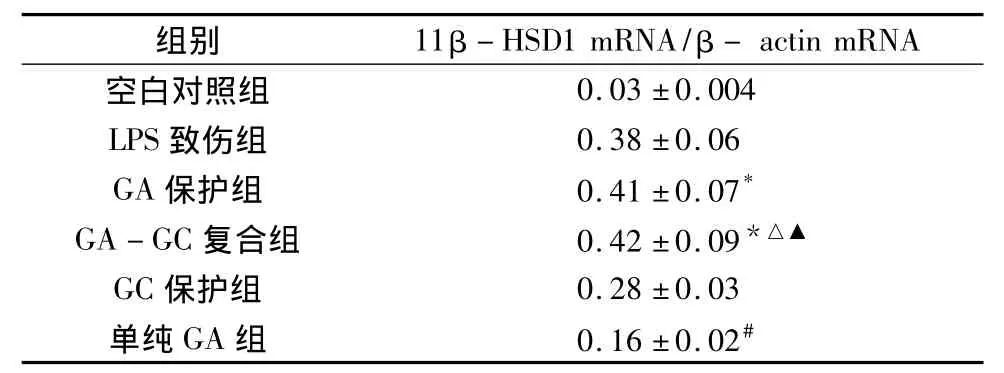
表3 大劑量GA(濃度為10-6mol/L)對HUVEC的11β-HSD1 mRNA表達的影響(±s)
與單純GA組比,*P<0.05;與GC保護組比,△P<0.05;與空白對照組比,#P<0.01;與GA保護組及LPS致傷組比,▲P>0.05
組別 11β -HSD1 mRNA/β-actin mRNA空白對照組0.03±0.004 LPS致傷組 0.38±0.06 GA保護組 0.41±0.07*GA-GC復合組 0.42±0.09*△▲GC保護組 0.28±0.03單純GA組 0.16±0.02#
2.GA對HUVEC分泌IL-6和sICAM-1的影響:在LPS的刺激下,HUVEC分泌IL-6和sICAM-1的量明顯增多。而GA和Dex均能抑制二者的分泌,GA與Dex合用可顯著抑制IL-6和sICAM-1的分泌。具體見表4。
表4 大劑量GA(濃度為10-6mol/L)對HUVEC的IL-6和sICAM-1分泌的影響(± s,pg/ml)

表4 大劑量GA(濃度為10-6mol/L)對HUVEC的IL-6和sICAM-1分泌的影響(± s,pg/ml)
與致傷組比,*P<0.05,△P<0.01
組別 IL-6含量 sICAM-1含量空白對照組63.2±6.3 23.2±2.7 LPS致傷組 606.1±17.3 516.8±15.1 GA保護組 436.2±11.8* 383.2±6.3*GA-GC復合組 168.6±21.9△ 26.3±2.9 GC保護組 66.3±5.1 216.5±12.2△單純GA組 286.5±11.3△ 156.3±11.3△
3.GA對HUVEC發生原位凋亡的影響:GA和Dex均能明顯抑制LPS誘導的血管內皮細胞凋亡,二者合用表觀上增加了對HUVEC凋亡的抑制效應,但統計學上與單獨應用Dex的作用并無差異,具體見表5。
表5 大劑量GA(濃度為10-6mol/L)對HUVEC的發生凋亡的影響( ± s,%)
與LPS致傷組比,*P<0.01,△P<0.05;與GA保護組比,#P<0.05;與GC保護組比,▲P>0.05
組別 細胞凋亡率空白對照組1.2±0.4 LPS致傷組 36.7±3.9 GA保護組 23.5±1.7△GA-GC復合組 12.6±0.6*▲#GC保護組 13.2±0.9*單純GA組1.6±0.3
討 論
甘草次酸具有抗炎、抗過敏、鎮咳、平喘及祛痰等廣泛的藥理作用,其中抗炎、抗過敏、平喘的作用與糖皮質激素相似。但至今GA與GC的內在關系缺乏深入研究,探討二者的關系將有助于進一步揭示和深化GC的抗炎作用機制,為臨床合理應用GC提供新的思路。以往研究中,甘草次酸已被視為經典的11β-羥基類固醇脫氫酶的抑制劑。有關GA與11β-羥基類固醇脫氫酶的研究主要涉及其不良反應的產生機制,比如臨床應用該藥常伴有的假醛固酮增多癥(pseudoaldosteronism)就認為與GA對11β-羥基類固醇脫氫酶的抑制有關[6]。但有關GA通過如何調節血管內皮細胞的11β-羥基類固醇脫氫酶,進而參與炎癥調控的研究,迄今未見報道。
長期以來認為GA發揮抗炎作用與阿司匹林相似,但與地塞米松不同。GA抗炎機制被認為與抑制脂氧酶和環氧酶,進而抑制 LTC4、LTD4、LTE4及PGE2等炎性介質的生成有關。但近年認為與調節T細胞分泌IL-5等細胞因子有關[7]。在本實驗中,我們觀察到GA能顯著抑制LPS誘導的HUVEC分泌IL-6和sICAM-1,同時顯著降低LPS誘導的HUVEC的細胞凋亡率。因此筆者認為抑制IL-6等前炎癥細胞因子的產生,減少血管內皮細胞和白細胞的黏附,保護血管內皮細胞的損傷也是GA的一個抗炎機制。鑒于11β-HSD是GC作用的受體前調節的關鍵物質,GA又是傳統的11β-HSD抑制劑,但在本實驗中,我們觀察到GA并沒有對11β-HSD1的表達進行抑制,相反卻能誘導11β-HSD1的表達,故我們推測GA主要對11β-HSD2表達起抑制作用,而對11β-HSD1則主要起誘導作用,也許GA對11β-HSD的這種雙向作用,正是其發揮抗炎作用的根本途徑。因此11β-HSD1完全可以作為GA抗炎等作用的一個靶點。GA與GC合用所增強的抗炎效應與11β-HSD的表達情況必定會有聯系。
近年來抑制11β-HSD1的研究主要是關于代謝疾病,例如肥胖和糖尿病[8]。本研究發現,GA單獨作用于人臍靜脈內皮細胞時,能夠上調 11β-HSD1mRNA的表達。GA與GC(Dex)合用也可促進11β-HSD1mRNA的表達。同時加強了GC對LPS誘導的人臍靜脈內皮細胞凋亡的抑制作用及炎性細胞因子IL-6、sICAM-1分泌的抑制作用,對GA對炎癥的影響有一定意義。
1 王興友,陳杭薇,錢桂生.糖皮質激素對血管內皮炎性損傷的保護機制[J]. 解放軍醫學雜志,2007,32(5):508-512
2 Liu Y,Mladinov D,Pietrusz JL,et al.Glucocorticoid response elements and 11b-hydroxysteroid dehydrogenases in the regulation of endothelial nitric oxide synthase expression[J].Cardiovasc Res,2009,81(1):140-147
3 Hao-Teng,Louis JT,Ta-Jen H,et al.Inhibition of the interactions between eosinophil cationic protein and airway epithelial cells by traditional[J].Chinese herbs,2010,4(Suppl 2):S8-S18
4 Liu Y,Park F,Pietrusz JL,et al.Suppression of 11fbetag-hydroxysteroid dehydrogenase type 1 with RNA interference substantially attenuates 3T3-L1 adipogenesis[J].Physiol Genomics,2008,32(3):343-351
5 Tian Z,Greene AS,Usa K,et al.Renal regional proteomes in young Dahl salt-sensitive rats[J].Hypertension,2008,51(4):899-904
6 Kageyama K,Takayasu S,Moriyama T,et al.A case of pseudoaldosteronism,accompanied with hypocalcemia and exaggerated ACTH response[J].Endocr J,2004,51(1):83-87
7 Xiu-Min L,Laverne B.Efficacy and mechanisms of action of traditional Chinese medicines for treating asthma and allergy[J].J Allergy Clin Immunol,2009,123(2):297-308
8 Stanetty C,Czollner L,Koller I,et al.Synthesis of novel 3-amino and 29-hydroxamic acid derivatives of glycyrrhetinic acid as selective 11β -hydroxysteroid dehydrogenase 2 inhibitors[J].Bioorg Med Chem,2010,18(21):7522-7541

