IGF-1R抑制劑AG1024對頭頸鱗癌FaDu細胞放射敏感性的影響
俞立萍 李萍 章青 徐文才 李兆斌 傅深
頭頸鱗癌是世界第6大惡性腫瘤,在我國年發病率可達15.22/10萬,排在惡性腫瘤發病的第7位。早期的頭頸鱗癌對單一的手術或者放療效果較好。然而,超過一半的頭頸部鱗癌患者首次就診時就已經處于晚期階段,故5年生存率低于50%。以鉑類為基礎的化療藥物作為放療增敏劑能提高治愈率,卻會導致更嚴重的并發癥和死亡率。所以,尋找一種新的靶向頭頸鱗癌的治療方法至關重要。胰島素樣生長因子1受體(insulin-like growth factor 1 receptor,IGF-1R)是酪氨酸蛋白激酶家族的成員,在各種類型細胞上均有表達,與多種腫瘤的發生、發展、增生、侵襲、轉移和凋亡密切相關,在頭頸鱗癌中高表達[1-3]。
本研究擬設計體外實驗,研究IGF-1R抑制劑AG1024在體內外對人咽鱗癌FaDu細胞的放射增敏作用,并分析其產生放射增敏的可能機制.
1 材料和方法
1.1 主要藥物和試劑
MEM細胞培養液和胎牛血清購自Hyclone公司,AGl024購自德國Calbiochem公司,AnnexinⅤ-FITC/PI購自Invitrogen公司,γ-H2AX抗體購自Millipore公司。蛋白質印跡法(Western blot)及免疫沉淀所用抗體購自cell signaling 公司, protein-A/G beads購自碧云天公司。
1.2 FaDu細胞的培養
頭頸鱗癌FaDu細胞購自中國科學院上海生命科學研究院生物化學與細胞生物學研究所細胞庫,在含10%胎牛血清的MEM培養液中于37 ℃、CO2體積分數為5%的條件下培養,每3~4 d傳代1次。所有實驗均在細胞處于對數增長期時進行。
1.3 克隆形成實驗檢測細胞集落形成情況
取對數生長期細胞接種于6孔板。細胞培養24 h后,10 μmol/L AG1024溫育處理細胞24 h后,6 MV X線分別照射0、2、4、6、8、10 Gy,1 h后按不同濃度梯度接種于6 cm培養皿中培養2周。細胞集落經4%多聚甲醛溶液固定以及0.1%結晶紫染色后,顯微鏡下觀察細胞集落形成情況。以含>50個細胞的集落計為1個存活克隆,計數各組細胞的克隆數。應用Sigma plot多靶單擊模型擬和存活曲線。
1.4 AnnexinⅤ-FITC/PI 雙標記法分析細胞凋亡
取對數生長期FaDu細胞接種于6孔板。培養24 h后,分別給予如下處理: ①對照組,不處理;②放射組,給予6 MV X線 4 Gy照射;③AG1024組,給予10 μmol/L AG1024;④聯合組,給予10 μmol/L AG1024溫育1 h,給予6 MV X線 4 Gy照射。各組于24 h后用胰酶消化,PBS洗滌細胞2次,收集細胞。用500 μL結合緩沖液懸浮細胞后,加入5 μL AnnexinⅤ-FITC/PI混勻,再加入5 μL碘化丙啶(propidiumiodide,PI)混勻,避光反應15 min后,上流式細胞儀檢測細胞凋亡率。
1.5 PI單染法分析周期分布
細胞收集方法如上,預冷的70%酒精固定過夜,再用預冷的PBS洗滌2次,加入50 μg/mL的用PBS稀釋的PI工作液,避光冰浴30 min,使用流式細胞儀檢測細胞周期。
1.6 γ-H2AX形成實驗分析DSBs修復情況
取對數生長期細胞于24孔板內爬片,培養24 h后加入10 μmol/L AG1024溫育24 h,6 MV X線 4 Gy照射。于照射后0.5、1、6、24 h分別固定,破膜,封閉,染色,檢測γ-H2AX焦點的表達。熒光顯微鏡下觀察計數γ-H2AX焦點形成數,計數50個細胞取平均值。
1.7 Western blot檢測IGF-1R下游活化蛋白pAkt和pErk1/2的表達
用4 ℃預冷PBS洗滌各組細胞3次后,冰上裂解蛋白30 min,收集蛋白裂解液,12 000×g離心15 min,收集上清液。采用BCA法測定蛋白濃度后,將蛋白與5倍的上樣緩沖液混勻,煮沸5 min,蛋白上樣量為20 μg,行SDSPAGE分離蛋白;然后將蛋白轉印至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上,用5%脫脂牛奶于室溫下封閉l h,TBST緩沖液清洗3次(每次5 min);分別加入相應一抗(1∶1 000稀釋),4 ℃搖晃培育過夜后,TBST清洗3次;加入辣根過氧化物酶標記的兔或鼠二抗(1∶5 000稀釋),室溫溫育l h,TBST清洗3次;電化學發光試劑盒顯影約5 min,曝光反應。
1.8 動物實驗
4~6周齡的裸鼠,右下肢皮下注射2×107的細胞懸液0.1 mL,V=π/6ab2,其中a為長軸直徑,b為其垂直的短軸直徑。到腫瘤長至100 mm3時分成4組:對照組;AG1024組;放射組;聯合組。AG1024每周使用5次,每次用量為30 μg 腹腔注射,使用2周,第1、8天分別用8 Gy照射,共照射2次。
1.9 統計學處理
所有實驗均重復3次,采用SPSS 13.0軟件進行數據分析,兩組間比較用t檢驗,多組間比較采用單因素方差分析,P<0.05為差異有統計學意義。
2 結 果
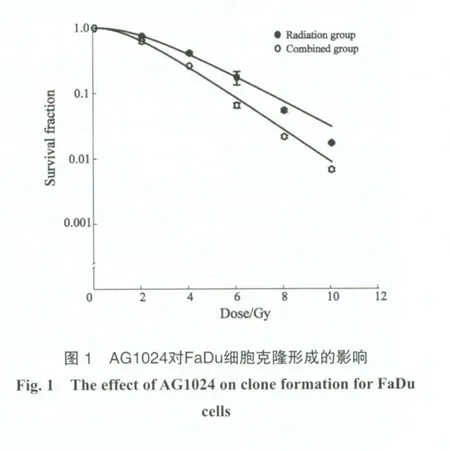
2.1 AG1024對FaDu細胞克隆形成的影響
FaDu細胞經AG1024溫育24 h后接受照射與放射組比較,其存活曲線明顯下降,肩區變窄。放射組的D0值為2.44,聯合組下降為1.77。細胞在10%存活處的DMF為1.25。AG1024可以提高FaDu細胞的放射敏感性(圖1)。
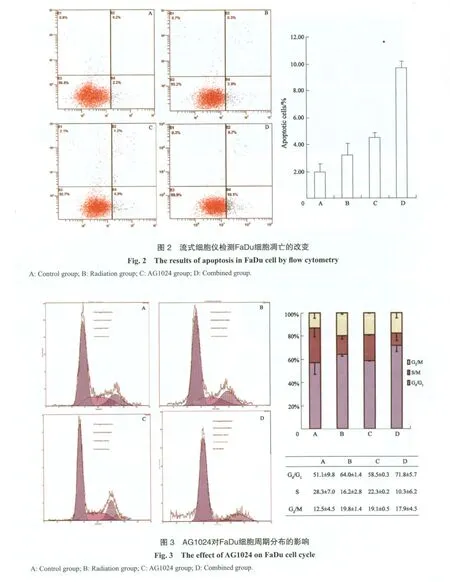
2.2 AG1024對FaDu細胞凋亡的影響
對照組凋亡細胞比例為(1.97±0.60)%,放射組為(3.2±0.99)%,AG1024組為(4.50±0.38)%,聯合組為(9.68±0.53)%。聯合組細胞凋亡明顯高于放射組及AG1024組(P<0.05,圖2)。
2.3 AG1024對FaDu細胞周期分布的影響
FaDu 細胞經過不同的處理后,其細胞周期發生了改變(圖3)。細胞經過藥物處理后,S期細胞減少;聯合照射后,能進一步使G0/G1期細胞比例升高,細胞阻滯于G0/G1期。與放射組相比,聯合組的細胞發生G0/G1期阻滯(P<0.05),S期細胞比例明顯降低(P<0.05)。
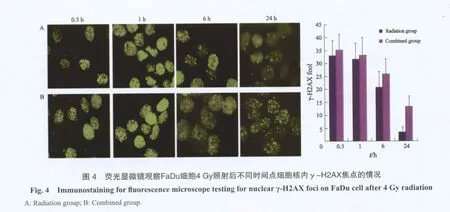
2.4 γ-H2AX形成實驗DSBs修復情況
聯合組FaDu細胞經 AG1024溫育24 h后,6 MV X線4 Gy照射,放射后0.5、1、6、24 h的γ-H2AX焦點形成數為(35.20±5.93、33.10±6.71、25.92±5.79和13.33±3.93),照射組為(32.91±5.83、31.68±6.02、20.72±6.09和3.43±2.04)。照射后0.5、1、6 h兩組焦點數相比差異無統計學意義(P>0.05)。照射24 h后,聯合組的焦點數明顯多于放射組(P<0.05)。AG1024能抑制DSBs的修復(圖4)。
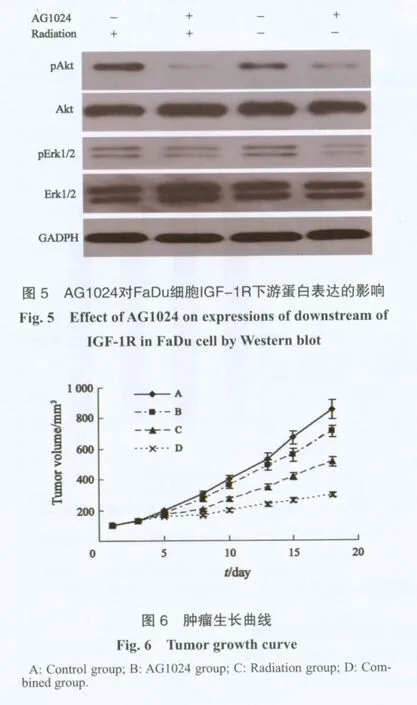
2.5 AG1024對IGF-1R下游活化蛋白pAkt和pErk1/2表達的影響
Western blot檢測結果顯示,10 μmol/L AG1024處理FaDu細胞后,AG1024組以及聯合組的IGF-1R下游的活化蛋白pAkt和pErk1/2表達下降(圖5)。
2.6 AG1024對荷瘤小鼠腫瘤生長情況的影響
腫瘤體積雙倍時間在對照組、放射組、AG1024組及聯合組分別為4.3±0.21、7.1±0.25、5.2±0.19和10.9±0.24,與放射組和AG1024組相比,聯合組的腫瘤生長延遲(P<0.05,圖6)。
3 討 論
頭頸鱗癌在我國的發病率呈現上升趨勢,進年來隨著分子生物學的發展以及分子靶向藥物的不斷涌現,靶向治療日漸成為頭頸鱗癌治療的重要選擇。其中EGFR在95%~100%的頭頸鱗癌中存在過表達。放療或者化療聯合EGFR的靶向治療在頭頸鱗癌的治療中取得一定的成效,但是臨床發現有很大一部分患者存在EGFR耐藥[4]。針對EGFR靶點治療的局限性,尋找頭頸鱗癌的更多的相關靶點的治療勢在必行。其中IGF-1R作為酪氨酸蛋白激酶家族的成員,在頭頸鱗癌中多是高表達,Jun等[5]發現IGF-1R的高表達和進展患者的生存率相關,提示抑制IGF-1R可以作為頭頸鱗癌治療的相關靶點。
本研究結果顯示,AG1024阻斷IGF-1R后,能增加頭頸鱗癌FaDu細胞的放射敏感性,可能和其能增強放療引起的細胞凋亡,并能引起細胞周期阻滯在G0/G1期,使得細胞處在靜止期,減少其細胞的分裂和增殖,而對放射不敏感的S期細胞則明顯減少有關。進一步通過檢測DNA雙鍵斷裂(DSBs)修復的情況以及IGF-1R下游蛋白的活化水平表明。AG1024能延緩DSBS的修復,并阻斷P13K/Akt及Ras/Raf/MAPK信號通路。其中DSBs被認為是DNA最嚴重的損傷,射線引起的細胞損傷主要是DSBs從而進一步引起細胞凋亡以及增殖性死亡。當DSBs時,H2AX在139位迅速發生磷酸化(γ-H2AX) ,并在斷裂附近形成焦點,而在DSBs修復后迅速發生去磷酸化。所以γ-H2AX形成的數量可作為衡量DSBs的指標[6-7]。有報道指出,IGF-1R抑制劑可通過下調BRCA2這個DNA損傷后同源修復(HR)的關鍵蛋白使得DSBs修復不足,導致高放射敏感性[7-8]。從克隆形成實驗可見AG1024有放射增敏作用,但對DSBs這個射線引起的最主要的DNA致死性損傷的作用至今還沒有被評估。所以我們檢測了射線引起DSBs后AG1024在DSBs修復上的作用。在接受照射后,30 min到1 h γ-H2AX焦點形成數達到最高,之后隨著DSBs的修復,γ-H2AX焦點數開始下降。在照射后0.5、1和6 h,焦點數沒有明顯差異,但是在24 h后,AG1024組的γ-H2AX焦點數明顯比非處理組高,即DSBs的修復被抑制,增加放射敏感性。而P13K/Akt及Ras/Raf/MAPK信號通路與細胞的生存、分化、增殖和凋亡等密切相關,并與放療阻抗相關。AG1024能抑制Akt和MAPK的磷酸化,從而能抑制IGF-1R介導的細胞增殖、分化等。而動物實驗的結果則進一步驗證了藥物聯合放療能抑制頭頸腫瘤FaDu細胞的增殖。
綜上所述,IGF-1R抑制劑AG1024能抑制DSBs的修復,阻斷P13K/Akt及Ras/Raf/MAPK信號通路,增加放療引起的細胞凋亡。為臨床尋找有效的以IGF-1R為靶點的頭頸鱗癌治療提供了實驗依據。
[1]RESNICOFF M, ABRAHAM D, YUTANAWIBOONCHAI W,et al.The insulin-like growth factor I receptor protects tumor cells from apoptosis in vivo[J].Cancer Res, 1995, 55:2463-2469.
[2]BASERGA R.The insulin-like growth factor-Ⅰ receptor as a target for cancer therapy[J].Expert Opin Ther Targets,2005, 9: 753-768.
[3]POLLACK M N, SCHERNHAMMER E S, HANKINSON S E,et al.Insulin-like growth factors and neoplasia[J].Nat Rev Cancer, 2004, 4: 505-518.
[4]MEHRA R, SEREBRIISKII I G, DUNBRACK R L, et al.Protein-intrinsic and signaling network-based sources of resistance to EGFR- and ErbB family-targeted therapies in head and neck cancer[J].Drug Resist Updat, 2011, 14(6):260-279.
[5]JUN H, CHANG M, KO Y, et al.Clinical significance of type 1 insulin-like growth factor receptor and insulin-like growth factor binding protein-3 expression in squamous cell carcinoma of head and neck[J].J Clin Oncol, 2009, 27(15):6036.
[6]ROGAKOU E P, BOON C, REDON C, et al.Megabase chromatin domains involved in DNA double-strand breaks in vivo[J].J Cell Biol, 1999, 146: 905-916.
[7]SCHULTZ L B, CHEHAB N H, MALIKZAY A, et al.p53 binding protein 1(53BP1) is an early participant in the cellular response to DNA double strand breaks[J].J Cell Biol,2000, 151: 1381-1390.
[8]YU D, SEKINE E, FUJIMORI A, et al.Down regulation of BRCA2 causes radio-sensitization of human tumor cells in vitro and in vivo[J].Cancer Sci, 2008, 99: 810-815.

