碘酸鉀氧化合成3-碘對氨基苯磺酸的研究
孫 濤,孟慶朝,董玉環,劉興順
(1. 唐山師范學院 化學系,河北 唐山 063000;2. 遷安夏官營高級中學 化學組,河北 遷安 064409)
碘酸鉀氧化合成3-碘對氨基苯磺酸的研究
孫 濤1,孟慶朝1,董玉環1,劉興順2
(1. 唐山師范學院 化學系,河北 唐山 063000;2. 遷安夏官營高級中學 化學組,河北 遷安 064409)
以對氨基苯磺酸和碘化鉀為原料,碘酸鉀為氧化劑,合成了3-碘對氨基苯磺酸,并對影響合成3-碘對氨基苯磺酸的一系列因素進行了研究。研究結果表明,對氨基苯磺酸用量為0.008 mol,碘酸鉀用量為1.05 g,以30 mL水作為溶劑,加入4 mL醋酸,溫度為70~80 ℃,反應4 h,3-碘對氨基苯磺酸的產率可達到90.05%。
對氨基苯磺酸;碘化鉀;碘酸鉀;3-碘對氨基苯磺酸
在眾多的有機化合物中,碘代芳烴有著獨特的地位,它們廣泛應用于醫藥、農藥以及材料等領域,是合成藥物活性和生物活性化合物的重要中間體[1-4]。
芳香化合物的碘化基本上可分為兩類。一類是間接碘化,如用重氮化反應由苯酚制對碘苯酚,需經過硝化、還原、重氮化和置換等步驟,整個過程比較繁雜,每步均有副產物,需經多次萃取、洗滌,產率通常不高于70%,并且產生的大量副產物對環境污染比較大,現在日益被其他方法所取代[5]。另一類是直接碘化,即將單質碘或含碘化合物在一定條件下與芳香化合物反應而直接碘化。它的特點是反應步驟少、條件溫和、選擇性較好、產率高。如果用單質碘來碘化芳香化合物,因為碘是一種不太活潑的親電試劑,也難于直接在芳環上發生碘化反應,常常要有氧化劑(如硝酸、雙氧水、次氯酸、氯酸鉀等)參與才能進行[6-9]。例如以硝酸為氧化劑進行的碘化反應[10]。
本實驗采用無水對氨基苯磺酸作為底物,碘化鉀代替碘,用碘酸鉀作氧化劑,以水作溶劑合成3-碘對氨基苯磺酸。反應方程式如下:
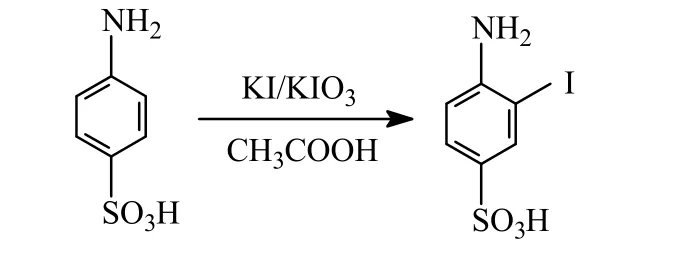
這些反應條件與傳統方法相比表現出兩個優點:(1)反應效率高,選擇性好,單碘取代物收率較高;(2)副產物少,環境污染小。
1 實驗部分
無水對氨基苯磺酸、碘化鉀、碘酸鉀、冰乙酸、硫代硫酸鈉等均為市售分析純試劑。
將1.4 g(0.008 mol)無水對氨基苯磺酸和1.4 g(0.008 4 mol)碘化鉀加入100 mL三口燒瓶中并加入30 mL水溶解,加入4 mL冰醋酸,攪拌加熱至70~80 ℃,分兩次(間隔半小時)向其中加入碘酸鉀1.05 g(0.005 mol),保持溫度為70~80 ℃,反應4 h,反應結束后在冰水中靜置半小時,逐滴加入10%(質量分數)的硫代硫酸鈉溶液直至溶液不會使淀粉碘化鉀試紙顯藍色,將此混合物抽濾并用蒸餾水洗滌,得到褐色晶狀粗產品。用95%乙醇重結晶得淺色針狀晶體。計算產率。
2 結果與討論
2.1 溫度對3-碘對氨基苯磺酸產率的影響
固定無水對氨基苯磺酸用量為0.008 mol,碘化鉀的量為1.4 g,碘酸鉀用量為1.05 g并分兩次間隔半小時加入,加入4 mL冰醋酸,反應4 h,水用量為30 mL。改變溫度,考查溫度對3-碘對氨基苯磺酸產率的影響,結果見表1。
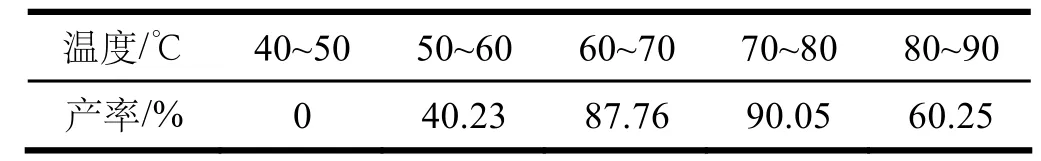
表1 溫度對3-碘對氨基苯磺酸產率的影響
由表1可看出,溫度過低在規定時間內反應不完全甚至不反應,溫度過高可能發生副反應或碘揮發使產率偏低,由此可確定反應最佳溫度為70-80 ℃。
2.2 碘酸鉀用量對3-碘對氨基苯磺酸產率的影響
固定無水對氨基苯磺酸用量為0.008 mol,碘化鉀用量為1.4 g,溫度保持70-80 ℃,反應4 h,加入4 mL冰醋酸,水的量為30 mL,碘酸鉀分兩次間隔半小時加入。改變碘酸鉀用量,考查碘酸鉀用量對3-碘對氨基苯磺酸產率的影響,結果見表2。

表2 碘酸鉀用量對3-碘對氨基苯磺酸產率的影響
由表2可看出,隨著碘酸鉀用量的增加,3-碘對氨基苯磺酸的產率會升高,當碘酸鉀用量達到1.05 g時,3-碘對氨基苯磺酸的產率也隨之達到最高值90.05%,隨后,繼續增加碘酸鉀用量3-碘對氨基苯磺酸的產率迅速下降。實驗過程中也發現,當氧化劑用量高于1.05 g時,副產物增多,這就造成了3-碘對氨基苯磺酸產率的下降。由此選擇氧化劑碘酸鉀用量為1.05 g。
2.3 反應時間對3-碘對氨基苯磺酸產率的影響
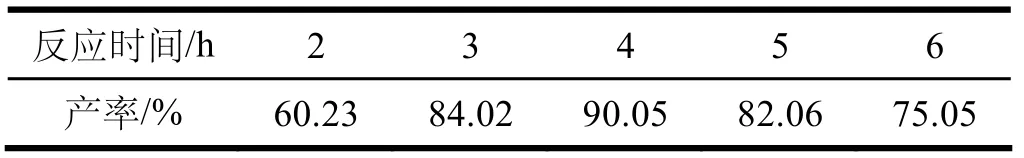
表3 反應時間對3-碘對氨基苯磺酸產率的影響
固定無水對氨基苯磺酸用量為0.008 mol,碘化鉀用量為1.4 g,溫度保持70~80 ℃,碘酸鉀用量為1.05 g并分兩次間隔半小時加入,加入4 mL冰醋酸,水用量為30 mL。改變反應時間,考查反應時間對3-碘對氨基苯磺酸產率的影響,結果見表3。
由表3可見,該反應4 h時3-碘對氨基苯磺酸的產率達到最高的90.05%。反應時間太短造成反應不夠充分,致使3-碘對氨基苯磺酸的產率較低;而當反應時間太長時,由于副產物的生成,同樣也會造成對3-碘對氨基苯磺酸的產率降低。由此選擇反應時間為4 h。
2.4 各種酸對3-碘對氨基苯磺酸產率的影響
固定無水對氨基苯磺酸用量為0.008 mol,碘化鉀用量為1.4 g,溫度保持70~80 ℃,氧化劑碘酸鉀用量為1.05 g并分兩次間隔半小時加入,水用量為30 mL,反應4 h。改變酸的種類(均加入4 mL),考查各種酸對3-碘對氨基苯磺酸產率的影響,結果見表4。
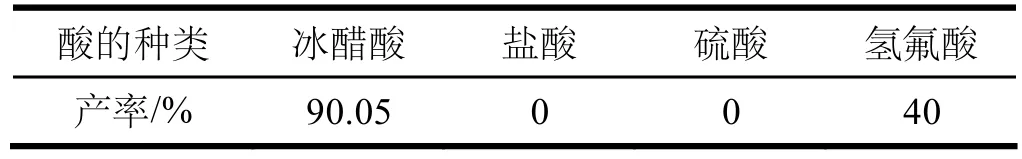
表4 酸的種類對3-碘對氨基苯磺酸產率的影響
由表4可知,加入冰醋酸時3-碘對氨基苯磺酸的產率最高為90.05%。換用其他酸時,3-碘對氨基苯磺酸的產率會降低,這可能是由于強酸釋放大量的氫離子,氫離子與氨基結合成銨正離子,大大降低了苯環上親電反應的活性;弱酸由于不能釋放足夠的氫離子,不能有效提高氧化劑的氧化性,致使產率降低。由此可見,選用冰醋酸為宜。
2.5 冰醋酸的用量對3-碘對氨基苯磺酸產率的影響
固定無水對氨基苯磺酸用量為0.008 mol,碘化鉀用量為1.4 g,溫度保持70~80 ℃,氧化劑碘酸鉀用量為1.05 g并分兩次間隔半小時加入,水用量為30 mL,反應4 h。加入冰醋酸,考查不同的酸用量對3-碘對氨基苯磺酸產率的影響,結果見表5。
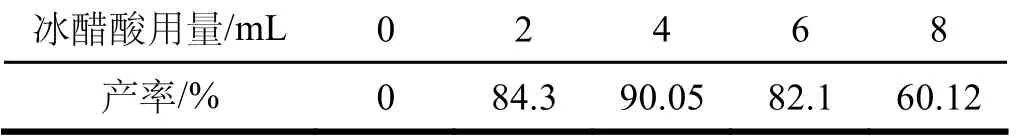
表5 冰醋酸用量對3-碘對氨基苯磺酸產率的影響
由表5可見,冰醋酸的最佳用量為4 mL,此時3-碘對氨基苯磺酸的產率達到最高為90.05%。換作其它量時,3-碘對氨基苯磺酸的產率會降低,這可能是由于酸濃度較高時,氨基轉變為銨正離子,使苯環上親電反應的活性降低,而酸濃度較低時不能有效地提高氧化劑的氧化性,導致產率降低。由此可見,冰醋酸用量以4 mL為宜。
2.6 氧化劑加入方式對3-碘對氨基苯磺酸產率影響

表6 氧化劑加入方式對3-碘對氨基苯磺酸產率的影響
固定無水對氨基苯磺酸用量為0.008 mol,碘化鉀的量為1.4 g,溫度保持70~80 ℃,水用量為30 mL,反應4 h,加入冰醋酸4 mL,氧化劑碘酸鉀用量為1.05 g,考查氧化劑的不同加入方式對3-碘對氨基苯磺酸產率的影響,結果見表6。
由表6可見,分兩次間隔0.5 h加入氧化劑碘化鉀時,3-碘對氨基苯磺酸的產率達到最高為90.05%。換用其它加入方式時,3-碘對氨基苯磺酸的產率都會降低,這可能是由于氧化劑一次加入反應過于激烈,副反應增多;當間隔時間較長時,由于不能發生連續的氧化反應,也會使產率降低。由此確定氧化劑以分兩次間隔半小時加入為宜。
2.7 溶劑對3-碘對氨基苯磺酸產率的影響
固定無水對氨基苯磺酸用量為0.008 mol,碘化鉀用量為1.4 g,溫度保持70~80 ℃,氧化劑碘酸鉀用量為1.05 g并分兩次間隔半小時加入,反應4 h,加入冰醋酸4 mL,考查不同溶劑(用量為30 mL)對3-碘對氨基苯磺酸產率的影響,結果見表7。

表7 溶劑種類對3-碘對氨基苯磺酸產率的影響
由表7可見,以水為溶劑時3-碘對氨基苯磺酸的產率達到最高為90.05%。換用其它溶劑時,3-碘對氨基苯磺酸的產率都會降低,這可能是由于碘酸鉀在水中溶解度較大且冰醋酸在水溶液中有更好的效果。由此確定以水為溶劑。
2.8 溶劑用量對3-碘對氨基苯磺酸產率的影響
固定無水對氨基苯磺酸用量為0.008 mol,碘化鉀的量為1.4 g,溫度保持70~80 ℃,氧化劑碘酸鉀用量為1.05 g并分兩次間隔半小時加入,反應4 h,加入冰醋酸4 mL,以水為溶劑,考查溶劑的不同用量對3-碘對氨基苯磺酸產率的影響,結果見表8。

表8 溶劑的量對3-碘對氨基苯磺酸產率的影響
由表8可見,溶劑水的用量為30 mL時,3-碘對氨基苯磺酸的產率達到最高為90.05%。因此溶劑用量以30 mL為宜。
3 產品檢測
在TENSOR37傅立葉紅外光譜儀上做產品的紅外光譜圖,主要吸收峰有:499.95 cm-1為C-I鍵伸縮振動頻率;1 546.76 cm-1為S=O雙鍵的伸縮振動頻率;1 453.67 cm-1,1 632.23 cm-1和1 600.15 cm-1為苯環骨架振動頻率;829.26 cm-1和689.32 cm-1是三取代苯環的特征吸收頻率;1 155.91 cm-1是C-N的伸縮振動。
4 結論
以無水對氨基苯磺酸作為底物,碘化鉀為碘代試劑,碘酸鉀為氧化劑,以水作溶劑合成了3-碘對氨基苯磺酸,最佳反應條件為(以對氨基苯磺酸用量為0.008 mol為基準):反應溫度為70~80 ℃,氧化劑用量為1.05 g(分兩次間隔半小時加入)、反應時間為4 h、冰醋酸用量4 mL,30 mL水為溶劑,在此條件下,3-碘對氨基苯磺酸的產率可達90.05%。該碘代方法具有環境污染少、產物與反應物易分離、產品后處理簡單、產率高等優點,具有良好的應用前景。
[1]AMEGADZIE A K, BECKJ P, GARDINIER K M, et al. Preparation of thiazolopyridinones as MCH receptor antagonists for treating and preventing symptoms assocd with obesity and related diseases: WO, 2006066174[P]. 2006-06-06.
[2]SATO M, MOTOMURAT, ARAMAKIH, et al. Novel HIV1 integrase inhibitors derived from quinolone antibiotics[J]. J. Med. Chem., 2006, 49(5): 1506-1508.
[3]許丹紅,孫楠,胡寶祥,等.碘代芳烴的合成研究[J].浙江工業大學學報,2008,36(1):20-21.
[4]李輝,高永民.3,5-二碘水楊酸合成新工藝[J].精細與專用化學品,2009(11):21-22.
[5]陳紅艷,吳兆民.一氯化碘乙酸溶液對芳香化合物碘化的研究[J].山西師大學報,2003,17(3):43.
[6]楊桂春,陳祖興,黃錦霞等.載氯化磷樹脂的制備及其對活潑芳香化合物的碘化研究[J].有機化學,2000,20(1): 98-101.
[7]李龍章,馬美玲,謝明貴.4-碘苯氧乙酸合成方法的改進[J].四川大學學報(自然科學版),1995,32(6):752-754.
[8]李綺云,曾昭鈞,劉巧云.碘化酚合成工藝條件考察[J].中國藥物化學雜志,2002,4(4):286-288.
[9]王華.去活化芳香化合物的電解-碘化反應初探[J].惠陽師專學報,1988(1):56-57.
[10]畢維笳.合成5,7-二氯吲哚類化合物的新方法[D].天津:天津大學,2007.
(責任編輯、校對:琚行松)
Studies on the Synthesis of 3-Iodine Sulfanilic Acid Using Potassium Iodate as Oxidant
SUN Tao1, MENG Qing-zhao1, DONG Yu-huan1, LIU Xing-shun2
(1. Department of Chemistry, Tangshan Teachers College, Tangshan 063000, China; 2. Group of Chemistry, Qian’an Xia Guanying Senior High School, Qian’an 064409, China)
Sulfanilic acid and potassium iodide are used as raw materials and potassium iodate is used as the oxidant in order to get 3-iodine sulfanilic acid, and a number of factors were studied during the synthesis of 3-iodine sulfanilic acid. The result shows that the yield of 3-iodine sulfanilic acid is 90.05% under the optimum operation conditions that, the temperature is between 70 ℃ and 80 ℃, the amount of anhydrous sulfanilic acid is 0.008 mol and the amount of acetic acid is 4 mL, the oxidant is 1.05 g, the reaction time is 4 hour, the solvent is water with the amount of 30 mL.
sulfanilic acid; potassium iodide; potassium iodate; 3-iodine sulfanilic acid
TQ031.7
A
1009-9115(2012)05-0011-03
2012-03-20
孫濤(1977-),男,河北唐山人,實驗師,研究方向為有機化學。

