pH值對大豆分離蛋白構象及表面疏水性的影響
王中江,江連洲,2,*,魏冬旭,3,李 楊,王 辰,李 丹,4
(1.東北農業大學食品學院,黑龍江 哈爾濱 150030;2.國家大豆工程技術研究中心,黑龍江 哈爾濱 150030;3.黑龍江出入境檢驗檢疫局,黑龍江 哈爾濱 150001;4.寧德師范學院,福建 寧德 352100)
pH值對大豆分離蛋白構象及表面疏水性的影響
王中江1,江連洲1,2,*,魏冬旭1,3,李 楊1,王 辰1,李 丹1,4
(1.東北農業大學食品學院,黑龍江 哈爾濱 150030;2.國家大豆工程技術研究中心,黑龍江 哈爾濱 150030;3.黑龍江出入境檢驗檢疫局,黑龍江 哈爾濱 150001;4.寧德師范學院,福建 寧德 352100)
采用Lowery法、ANS熒光探針法、圓二色光譜、熒光光譜方法分別對不同pH值大豆分離蛋白溶解度、表面疏水性、蛋白質二級、三級結構進行分析。結果表明:隨著pH值的升高,大豆分離蛋白的二級結構發生由β-折疊結構向α-螺旋結構的轉變,其Trp殘基所處微環境極性增強。大豆分離蛋白表面疏水性與溶解度呈負相關關系,同時大豆分離蛋白表面疏水性也與α-螺旋結構含量呈負相關關系。
大豆分離蛋白;pH值;表面疏水性;構象
在我國的大豆蛋白質市場上,大豆分離蛋白是產量最大的一種產品。目前大豆分離蛋白被廣泛應用于食品加工中的各個領域,這一方面是由于大豆蛋白質自身豐富的營養價值,而更重要的另一方面是由于大豆分離蛋白具有許多優良的功能特性。針對不同的功能性質,大豆分離蛋白被應用在不同食品及化工領域,化工及材料工業主要利用了大豆分離蛋白的表面疏水性質。
蛋白質是由多種氨基酸相互聯結構成的具有特定空間結構的生物大分子,而維持蛋白質的三級結構最重要的作用力是疏水基之間的相互作用。疏水作用是一種配位體間非共價鍵相互作用,它在生物體內的許多精細化學和物理特性以及對其反應性的研究方面的知識迄今仍很不完全。一般來說,多數構成蛋白質的非極性氨基酸側鏈分布在分子內部形成疏水內核,而極性氨基酸分布在表面的親水環境中。對于一些已知結構的蛋白質表面性質的分析表明,一些疏水基團也會出現在蛋白質表面,使蛋白質表面也具有一定的疏水性。疏水作用對蛋白質的穩定性、構象和蛋白質功能具有重大意義。由于蛋白質是大分子結構,表面疏水性影響分子間的相互作用,因此比整體的疏水性對蛋白質的功能具有更大的影響[1]。蛋白質表面疏水性可作為疏水基團和極性溶液環境結合數目的指標,而疏水基團和極性溶液環境結合數目可衡量分子間相互作用的強弱,因而表面疏水性是蛋白質一種很重要的表面性質。
研究表明,蛋白質的表面疏水性不僅與其來源、加工條件、加工方法等有關,而且與蛋白質的物理化學性質、結構特征等密切相關,包括蛋白質的大小、形狀、氨基酸組成及序列及其含量分布、三級及四級結構、分子內或分子間交聯等[2-3]。本實驗通過圓二色光譜、熒光光譜檢測方法,系統研究pH值對大豆球蛋白表面疏水性和結構的影響,從而可進一步探討pH值與大豆蛋白表面疏水性之間的關系,期望為大豆精深加工及高值化應用提供理論依據。
1 材料與方法
1.1 材料與試劑
大豆(東農-46號)由東北農業大學大豆研究所提供。大豆粉碎后過60目篩,用石油醚脫脂,得脫脂大豆粉。
所用試劑最低純度為分析純。
1.2 儀器與設備
J-815圓二色光譜儀 日本Jasco公司;CR22G高速冷凍離心機、F-4500型熒光分光光度計 日本日立公司;PHS-3D pH計 上海雷磁儀器廠。
1.3 方法
1.3.1 大豆分離蛋白制備工藝流程
脫脂豆粉→ pH8.0堿提→離心→ pH4.5酸沉→溶解→冷凍干燥→成品
工藝條件:用水以料液比1:10(m/V)的比例溶解豆粕,用2mol/L NaOH溶液調節pH值至8.0,在磁力攪拌下提取3h;然后10000×g離心30min;上清液用2mol/L HCl溶液調節pH值至4.5,再10000×g離心30min;瀝去上清液,用水洗沉淀3次,加少量的水溶解沉淀,用2mol/L NaOH溶液調節pH值至7.0;最后冷凍干燥得到大豆分離蛋白成品(蛋白質含量為88.89%)。
1.3.2 不同pH值緩沖液的配制
配制0.01mol/L的pH值為2~6的檸檬酸-磷酸二氫鈉緩沖液,pH值為7~9的Tris-HCl緩沖液,pH10的甘氨酸-HCl緩沖液,pH11和pH12的NaOH-NaH2PO4緩沖液(離子濃度約為0.05mol/L)。
1.3.3 溶解度測定
稱取100mg蛋白樣品分散于10mL的去離子水中,磁力攪拌30min,然后用1mol/L的NaOH或HCl溶液調節溶液的pH值,攪拌30min后離心(12000×g,20min,20℃)。上清液經適度稀釋,采用Lowery法測定蛋白質含量[4],以牛血清白蛋白為標準物制作標準曲線。以上清液蛋白質量濃度占總蛋白質量濃度的百分比表示蛋白質的溶解度。
1.3.4 表面疏水性的測定
采用ANS熒光探針法。將蛋白質樣品溶于0.01mol/L不同緩沖液中,配成10mg/mL的溶液,均質1min后8000×g離心20min,取上清液用Lowery法測定溶液中大豆蛋白的質量濃度,然后將上清液稀釋成不同的梯度后,取不同的樣品溶液10ml,分別加入50μL 8mmol/L的ANS溶液,振蕩,靜置10min后測其熒光強度(FI)。在本實驗中激發波長330nm,發射波長490nm。以熒光強度對蛋白質作圖,初始段的斜率即為蛋白質分子的表面疏水值[5-6]。
1.3.5 圓二色光譜分析
采用遠紫外區域圓二色光譜用于研究不同pH值對蛋白二級結構的影響。準確稱取一定量的蛋白樣品,溶于不同pH值緩沖液中,蛋白質量濃度為0.4mg/mL,室溫下將樣品放置4h。樣品pH值采用高精度的pH酸度計進行監控。采用圓二色光譜儀在190~250nm之間掃描,實驗溫度為20℃,樣品池光程為1mm,靈敏度為100mdeg/cm,掃描速度率為100nm/min,分辨率0.1nm,實驗值為5次掃描的均值。蛋白二級結構組成采用CDPro曲線擬合軟件包,使用的算法為CONTIN/LL,使用的參考蛋白為SMP56,取蛋白平均殘基摩爾質量(MRW)為115g/mol,計算波長范圍為200~240nm,每個樣品重復3次測定。
1.3.6 熒光光譜分析
采用F-4500型熒光分光光度計測定大豆分離蛋白的熒光光譜。蛋白分散于不同pH值緩沖液中,蛋白質量濃度為0.2mg/mL,激發波長為295nm,發射光譜范圍為300~400nm,激發和發射狹縫均為5nm,掃描5次。
1.3.7 數據統計方法
用SAS 8.12進行相關分析和方差分析,如果方差分析效應顯著,使用Duncan multiple range test進行多重比較(P<0.05)。
2 結果與分析
2.1 不同pH值的大豆分離蛋白溶解度曲線
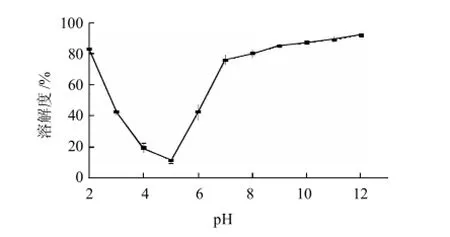
圖1 不同pH值對大豆分離蛋白溶解度的影響Fig.1 Effect of pH on solubility of soybean protein isolate
大豆分離蛋白的等電點在4.2~4.6,由圖1可知,大豆分離蛋白的溶解度在4.5附近出現最小值(約為7%),而在pH4.5兩側的pH值范圍內溶解性均有顯著升高(P<0.05),同時可以看出大豆分離蛋白在強酸及堿性范圍內表現出良好的溶解性。
由于工業上生產大豆分離蛋白的pH值范圍在4~9,因而選取這一區段進行研究,如溶解度曲線所示,大豆分離蛋白的溶解度在pH4~5時,溶解度在19%以下,呈現出較差的溶解性,并伴有沉淀及聚集體的形成,因而在后期的光譜分析中,未選取這一區段的pH值,主要由于光譜分析要求樣品具有良好的溶解性,否則圖譜將無法表現出典型的結構特征。
2.2 不同pH值的大豆分離蛋白表面疏水性曲線

圖2 不同pH值對大豆分離蛋白表面疏水性的影響Fig.2 Effect of pH on surface hydrophobicity of soybean protein isolate
由圖2可知,大豆分離蛋白的表面疏水性在等電點兩側呈現顯著下降趨勢,并在等電點附近出現最大值。與溶解度曲線的比較發現,在等電點以外的其他pH值下大豆分離蛋白的表面疏水值與溶解度呈現負相關,這與Hayakawa等[7]的研究相符。分析其原因在于蛋白質的溶解性取決于蛋白質分子的親水性/疏水性的平衡,這種平衡取決于蛋白質分子的氨基酸組成,尤其取決于暴露于蛋白質分子表面的氨基酸組成[8]。在氨基酸側鏈殘基中,亮氨酸、異亮氨酸等疏水性殘基,通過疏水鍵相互結合于蛋白質分子中心,形成疏水性區域;另一方面,谷氨酸、天門冬氨酸、精氨酸、賴氨酸等親水性殘基,配列于能夠與水分子接觸的蛋白質分子外側,形成親水性區域[9]。非極性基團轉向分子內部,形成疏水鍵;極性基團轉向分子內部的,可以相互作用形成氫鍵和鹽鍵,轉向分子表面的,可與水分子相互作用。蛋白質的非極性疏水基團常趨向于分子結構域的內部,形成一個疏水核,這種聚集是由于水對非極性基團的排斥造成的,疏水側鏈基團從水介質轉到蛋白質內部的疏水環境是受熵增的驅動自發進行的[10]。蛋白質結構復雜、種類繁多,并非上述一種結構模式,疏水核如果不在核心而暴露在分子表面,則表現為一定的疏水性,而親水溶解性降低,由于疏水、親水程度不同,造成蛋白質不同的溶解分散性[11]。同時研究表明,具有較高的溶解性蛋白質其分子表面存在較少數量的疏水性殘基[5]。
2.3 pH值對大豆分離蛋白的二級結構的影響
圓二色光譜可以表征不同pH值對大豆分離蛋白二級結構的影響,圖3A表示不同pH值的大豆分離蛋白圓二色光譜圖,圖3B為不同pH值大豆分離蛋白在208nm及222nm波長處的平均殘基摩爾橢圓度(θ),用于直觀的分析α-螺旋的變化趨勢。

圖3 pH值對大豆分離蛋白二級結構的影響Fig.3 Effect of pH on secondary structure of soybean protein isolate
由圖3A可知,大豆分離蛋白在194nm附近顯示一個正峰,218nm波長處顯示一個負肩峰,208nm和222nm顯示出兩個負凹槽,并且還在220~230nm之間存在一個很微弱的正峰。194nm正峰和218nm負肩峰的存在表示大豆蛋白中存在β-折疊結構,208nm和222nm負凹槽則是由于α-螺旋結構引起的負科頓效應引起的,220~230nm之間的微弱正峰則可表征蛋白質中存在無規卷曲結構。由此可見大豆分離蛋白包含4種類型的二級結構組分:α-螺旋,β-轉角,β-折疊以及無規卷曲,其中β-折疊以及無規卷曲含量較多[12],這與通過CONTIN/LL程序分析出的結果相吻合,見表1。通過擬合分析發現,大豆分離蛋白隨著pH值的升高,α-螺旋結構的含量逐漸增大,β-折疊結構逐漸降低,而無規卷曲結構略微降低,表明大豆分離蛋白的二級結構發生由β-折疊結構向α-螺旋結構的轉變。圖3B可以看出,由于α-螺旋結構的含量會隨208和222nm處峰強的負增長而增大,因此通過[θ]208nm及[θ]222nm數值的降低趨勢可以看出,α-螺旋結構的含量隨pH值升高而增大,與CONTIN/LL程序分析結論一致。
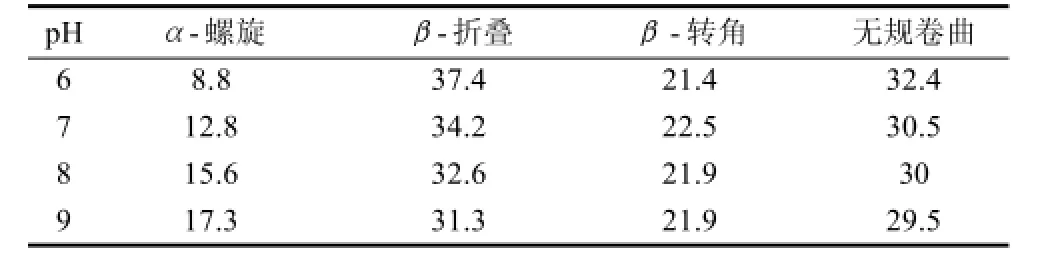
表1 CONTIN/LL程序分析出不同pH值的大豆分離蛋白二級結構含量Table 1 Secondary structure contents of soybean protein isolate at different pH conditions %
與中性及堿性條件比較發現pH6(弱酸性)時大豆分離蛋白的α-螺旋結構相對較低,分析其原因可能為:α-螺旋結構主要由多肽鏈上羰基(-CO)和氨基(NH-)之間的氫鍵穩定[13-14],而大豆分離蛋白的等電點約為4.5,這說明在中性條件下,蛋白是呈負電荷的,酸性環境可能會增加蛋白間因為電荷中和而產生的靜電作用,從而影響氫鍵的穩定性[14]。靜電作用和氫鍵穩定性的變化會依次引起在酸性條件下α-螺旋的丟失[15]。
Kato等[16]通過對卵白蛋白和溶菌酶的CD譜圖波長為220nm處橢圓率的測定發現,蛋白質的表面疏水性和α-螺旋結構呈現負相關,即蛋白質分子內α-螺旋結構含量降低時,分子內部“埋藏”的疏水性位點的暴露程度增大,表現出更強的表面疏水性。因此,大豆分離蛋白在pH6~9的范圍內,隨著pH值的降低,[θ]222nm的數值逐漸升高,表明分子內α-螺旋結構含量逐漸降低(圖3B),分子內部“埋藏”的疏水性位點的暴露程度增大,表現出更大的表面疏水性,這與大豆分離蛋白的表面疏水性曲線所表現出的增大趨勢相符。
2.4 pH值對大豆分離蛋白的三級結構的影響
在295nm激發的大豆分離蛋白樣品熒光發射光譜主要是由色氨酸所發射的,和其他含色氨酸和酪氨酸殘基的球蛋白一樣,由于其分子中從酪氨酸殘基到色氨酸殘基之間發生了能量轉移,從而導致了酪氨酸殘基的熒光熄滅和色氨酸殘基的熒光增加。因此大豆分離蛋白的熒光峰實際上是色氨酸殘基的熒光峰,其峰位在325~350nm波長之間[17]。
蛋白質是兩性物質,在不同的環境中具有不同的狀態,這是由于蛋白中所含的羧基和氨基個數和所處的環境決定的。蛋白質中可離解的基團除了一端的α-氨基和另一端α-羧基外,大多數是側鏈的基團,如天冬氨酸的β-羧基、組氨酸的咪唑基、賴氨酸的ε-氨基、酪氨酸的羥基等。蛋白質可解離基團的電離情況隨著溶液中pH值的變化而改變,從而導致蛋白質中的構象的變化。因而,通過研究溶液中酸堿度的變化對大豆分離蛋白熒光性質的影響,可以得出其結構信息。通過實驗,在溶液酸堿度從pH 6.0到pH 9.0環境中,發現不同pH值對大豆分離蛋白的熒光光譜形狀幾乎沒有影響(圖4),而對其λmax及熒光強度有改變,其變化情況見表2。
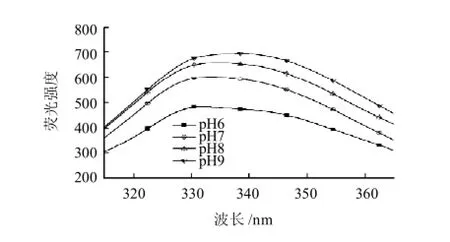
圖4 不同pH值大豆分離蛋白的熒光光譜Fig.4 Fluorescence spectra of soybean protein isolate at different pH conditions

表2 不同pH值的大豆分離蛋白的熒光強度及λmaxTable 2 Fluoreseenee intensity and λmax of soybean protein isolate at different pH conditions
大豆分離蛋白的λmax分布在331.2~338.4nm范圍內,有研究表明λmax與Trp殘基所處微環境的有關,λmax小于330nm表示Trp殘基位于蛋白質分子內部的非極性環境中,λmax大于330nm時表明Trp殘基位于蛋白質分子外部的極性環境中[18]。由此可見,大豆分離蛋白在pH6~9的范圍內,其Trp殘基主要分布于蛋白質分子外部的極性環境中。由表2可知,隨著pH值增大,大豆分離蛋白的λmax向長波方向移動(紅移),表明原來處于球狀結構內部非極性環境中的Trp殘基轉移到蛋白質分子外部,其所處的微環境極性有所提高。
另一方面,大豆分離蛋白在pH6~9的范圍內,熒光強度隨pH值增大而增強。分析其熒光強度的變化可能與大豆分離蛋白中Trp殘基的量子產率及Tyr→Trp殘基能量傳遞有關[19]。由于實驗研究選擇的pH值范圍在微酸性及堿性范圍內,因而pH值的變化對大豆分離蛋白電荷分布影響較小,表現在對Trp殘基的發光效率影響不大。而Tyr→Trp能量傳遞可能受pH值變化的影響,從而導致Trp殘基總的熒光強度隨pH值的變化而改變。另外,隨著pH值的增大,受質子解離作用影響,原本帶負電荷且靠近Trp殘基的帶電基團離開,解除了對Trp熒光的猝滅作用。
蛋白質中的3種芳香氨基酸殘基與其他氨基酸相比疏水性較強,其中Trp和Phe殘基是高度疏水的非極性基團,Tyr殘基是中度疏水的極性基團。目前關于利用上述疏水性氨基酸微環境變化預測表面疏水性關系的研究較多,但主要用于蛋白變性過程中,利用在酸堿變性時,蛋白質分子的空間結構會發生變化,結構的變化對疏水性氨基酸殘基在蛋白質分子內外的分配產生影響,從而改變了蛋白質分子的表面疏水性,使蛋白質分子表面功能發生變化。
在本研究中主要的研究對象為Trp殘基,其在pH值的增大過程中的“暴露”在一定意義上表明大豆分離蛋白的三級結構發生變化,但這種“暴露”并未帶來類似于蛋白質變性過程中疏水性氨基酸“暴露”而引起的表面疏水性降低,關于上述現象的原因仍需進一步研究。結合2.3節關于二級結構的分析考慮,原因可能在于在非變性狀態下大豆分離蛋白的三級結構未發生類似變性過程中發生的解折疊現象,“包裹”在球狀結構內部的疏水性基團并未完全“暴露”出來[20],而是在二級結構基礎上伴隨著多肽鏈逐步卷曲為其它特定構象而使疏水性氨基酸殘基發生“暴露”,這種“暴露”對表面疏水性的影響不具有代表意義。綜上所述,疏水性較強的芳香氨基酸殘基微環境變化目前仍無法用于預測非變性蛋白質表面疏水性的變化。
3 結 論
3.1 大豆分離蛋白的表面疏水性隨pH值的變化趨勢為:在等電點兩側呈現顯著下降趨勢,并在等電點附近出現最大值。
3.2 結合溶解性研究發現大豆分離蛋白表面疏水性與溶解度呈現負相關。
3.3 圓二色光譜分析表明,隨著pH值的升高,大豆分離蛋白的二級結構發生由β-折疊結構向α-螺旋結構的轉變。這種變化進一步驗證了蛋白質的表面疏水性和α-螺旋結構呈現負相關。
3.4 熒光光譜分析表明,隨著pH值的增大,大豆分離蛋白的熒光強度及λmax均呈現增大趨勢,表明大豆分離蛋白中Trp殘基所處微環境極性增強,這種變化對表面疏水性的影響尚需進一步研究。
[1]SHEARD P R, FELLOWS A, LEDWARD D A, et al. Macromolecular charges associated with the heat treatment of soya isolate[J]. Food Technology, 1988, 21(12): 55-60.
[2]HUANG Weining, SUN Xiuzhi. Adhesive properties of soy protein modified by sodium dodecyl sulfate and sodium dodecylbenzenz sulfonate [J]. JAOCS, 2000, 77(7): 705-708.
[3]FUKUSHIMA D. Recent progress of soybean protein isolate foods: chemistry, technology and nutrition[J]. Food Reviews International, 1991, 7(3): 323-351.
[4]LOWRY O H, ROSEMBROUG H J, LEWIS A, et al. Protein measurement with the folin phenol reagent[J]. Journal of Biological Chemistry, 1951, 193(1): 265-275.
[5]KATO A, NAKAI S. Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins[J]. Biochem Biophy Acta, 1980, 624(1): 13-20.
[6]HUANG Weining, SUN Xiuzhi. Adhensive properties of soy proteins modified by urea and guanidine hydrechloride[J]. JAOCS, 2000, 77(1): 101-104.
[7]SHIGERU H, SHURYO N. Relationships of hydrophobicity and net charge to the solubility of milk and soy proteins[J]. Journal of Food Science, 1985, 50(2): 486-491.
[8]ANDRES M, SINEIRO J, HERMINIA D, et al. Functionality of oilseed protein products: a review[J]. Food Research International, 2006, 39(9): 945-963.
[9]SHURYO N. Structure-function relationships of food proteins with an emphasis on the importance of protein hydrophobicity[J]. Journal of Agricultural and Food Chemistry, 1983, 31(4): 676-683.
[10]PETRUECELLI S, ANON M C. Relationship between the method of obtention and the structural and functional properties of soy protein isolates.2.Surface properties[J]. Journal of Agricultural and Food Chemistry, 1994, 42(10): 2170-2176.
[11]CHERRY J P. Protein functionality in foods[M]. Washington, D C: ACS Symposium, 1980: 147.
[12]SREERAMA N, VENYAMINOV S Y U, WOODY R W. Estimation of the number of α-helical andβ-strand segments in proteins using circular dichroism spectroscopy[J]. Protein Science, 1999, 8(2): 370-380.
[13]SANO T, OHNO T, OTSUKA-FUCHINO H, et al. Carp natural actomyosin: thermal denaturation mechanism[J]. Journal of Food Science, 1994, 59(5): 1002-1008.
[14]DAMODARAN S. Amino acids, peptides, and proteins[M]. 3rd ed. New York: Marcel Dekker, 1996: 321-429.
[15]LIU Ru, ZHAO Siming, XIONG Shanbai, et al. Role of secondary structure in the gelation of porcine myosin at different pH values[J]. Meat Science, 2008, 80(3): 632-639.
[16]KATO A, TSUTSUI N, MATSUDOMI N, et al. Effects of partial denaturation on surface properties of ovalbumin and lysozyme[J]. Agricultural and Biological Chemistry. 1981, 45(12): 2788-2760.
[17]KALAPATHY U, HETTIARACHCHY N S, RHEE K C. Effect of drying methods on molecular properties and functionalities of disulfide bond-cleaved soy proteins[J]. Journal of the American Oil Chemists’Society, 1997, 74(3): 195-199.
[18]VIVIAN J T, CALLIS P R. Mechanisms of tryptophan fluorescence shifts in proteins[J]. Biophysical Journal, 2001, 80(5): 2093-2109.
[19]劉清亮, 吳雙頂, 張玉慧, 等. 皖南尖吻蛇毒糖增水解酶的熒光光譜研究[J]. 無機化學學報, 1998, 14(1): 53-57.
[20]ANNA M, ZOFIA D. Differential scanning microcalorimetry study of the thermal denaturation of haemoglobin[J]. Biophysical Chemistry, 2005, 118(2): 93-101.
Effect of pH on Conformation and Surface Hydrophobicity of Soybean Protein Isolate
WANG Zhong-jiang1,JIANG Lian-zhou1,2,*,WEI Dong-xu1,3,LI Yang1,WANG Chen1,LI Dan1,4
(1. College of Food Science, Northeast Agricultural University, Harbin 150030, China;2. National Soybean Engineering Technology Research Center, Harbin 150030, China;3. Heilongjiang Entry-Exit Inspection and Quarantine Bureau, Harbin 150001, China;4. Ningde Normal University, Ningde 352100, China)
Lowry method, ANS fluorescence probe, circular dichroism and fluorescent spectroscopy were applied to explore the solubility, surface hydrophobicity, secondary structure and tertiary structure of soybean protein isolate at different pH conditions. The results showed that the transformation from β-sheet structure to α-helix structure, and the microenvironment polarity of Trp residues revealed an obvious increase with increasing pH. A negatively linear correlation between the surface hydrophobicity and solubility of soybean protein isolate was observed. Meanwhile, the surface hydrophobicity of soybean protein isolate was negatively correlated with the amount of α-helix structure.
soybean protein isolate;pH;hydrophobicity;structure
TS201.2
A
1002-6630(2012)11-0047-05
2011-06-06
國家自然科學基金項目(C200101)
王中江(1987—),男,碩士研究生,研究方向為糧食、油脂及植物蛋白工程。E-mail:zibeizhe@126.com
*通信作者:江連洲(1960—), 男,教授,博士,研究方向為糧食、油脂及植物蛋白工程。E-mail:jlzname@163.com

