酶解脫脂蠶蛹蛋白制備ACE抑制肽
李 勇,王 穎,黃先智,闞建全,*,晉圣坤,賀亞萍,胡益僑,廖 晨
(1.西南大學食品科學學院,重慶 400715;2.重慶市農產品加工及貯藏重點實驗室,重慶 400715;3.西南大學生物技術學院,重慶 400715)
酶解脫脂蠶蛹蛋白制備ACE抑制肽
李 勇1,2,王 穎1,2,黃先智3,闞建全1,2,*,晉圣坤1,賀亞萍1,2,胡益僑1,2,廖 晨1,2
(1.西南大學食品科學學院,重慶 400715;2.重慶市農產品加工及貯藏重點實驗室,重慶 400715;3.西南大學生物技術學院,重慶 400715)
以實驗室自制的脫脂蠶蛹蛋白為原料,利用酶工程技術,通過對中性蛋白酶、堿性蛋白酶、木瓜蛋白酶、復合蛋白酶、風味蛋白酶、胰蛋白酶等的篩選及單因素和響應面優化試驗,對ACE抑制肽的制備工藝條件進行較系統的研究。結果表明:選擇堿性蛋白酶作為脫脂蠶蛹蛋白制備ACE抑制肽的酶,制備ACE抑制肽的最佳工藝條件為料液比11.88:100、溫度50.22℃、pH 9.46、加酶量7.03%、酶解4h。在此條件下制備的ACE抑制肽的ACE抑制率達到41.98%。
蠶蛹蛋白;ACE抑制肽;酶解;工藝條件
血管緊張素轉換酶(angiotensin converting enzyme,ACE)在人體血壓形成過程中起重要作用,它催化血管緊張素Ⅰ從C端裂解二肽形成血管緊張素Ⅱ(腎素-血管緊張素系統中已知最強的血管收縮劑)。同時,它能阻抗血管舒張劑——舒緩激肽的降解[1],抑制ACE的活性,可使血管緊張素Ⅱ的生成和激肽的破壞均減少,從而達到治療高血壓的目的。目前已從許多食源性蛋白質中分離得到了ACE抑制肽,如牛乳酪蛋白[2]、沙丁魚[3]、大豆蛋白[4]、花生蛋白[5]、向日葵蛋白[6]等。
蠶蛹(silkworm pupa)含有豐富的蛋白質,目前已有報道利用其制備蛋白小肽[7-8]。閔建華等[7]采用堿性蛋白酶、風味蛋白酶、復合蛋白酶、木瓜蛋白酶、胰蛋白酶水解蠶蛹蛋白,并研究了其產物的抗氧化活性。陳靜等[8]以脫脂蠶蛹蛋白為原料,采用堿性蛋白酶水解蠶蛹蛋白制備緩解體力疲勞的蛋白肽運動飲料。蠶蛹豐富的蛋白質中疏水性氨基酸的含量比較高[9],有研究表明,疏水性氨基酸能提高ACE抑制肽的活性[10-13]。因此,用蠶蛹作為開發ACE抑制肽的原料是可行的。本實驗以脫脂蠶蛹蛋白作為原料,研究在酶解過程中其ACE抑制率的變化,確定酶解脫脂蠶蛹蛋白制備ACE抑制肽的最佳工藝條件,以期為深入開發利用蠶蛹蛋白資源及蠶蛹蛋白深加工提供理論依據,為開發具有降血壓效果的蠶蛹蛋白ACE抑制肽提供理論支持。
1 材料與方法
1.1 材料與試劑
1.1.1 材料
脫脂蠶蛹蛋白粉,實驗室采用索氏-無水乙醚抽提12h自制。
1.1.2 試劑
ACE、馬尿酰-組胺酰-亮氨酸(HHL) 美國Sigma公司;Neutrase中性蛋白酶、Papain木瓜蛋白酶、A l c a l a s e堿性蛋白酶、P r o t a m e x復合蛋白酶、Flavourzyme風味蛋白酶 南寧東恒華道生物科技有限公司;Trypsin胰蛋白酶 北京索萊寶科技有限公司。
1.2 儀器與設備
HH-6數顯恒溫水浴鍋 金壇市富華儀器有限公司;PB-10酸度計 上海雷磁儀器廠;JA2003電子天平 上海精天電子儀器有限公司;DHG-9240電熱恒溫鼓風干燥箱 上海一恒科技有限公司;ALPAAI-4LSC真空冷凍干燥機 美國Chris公司;Milli-Qbiocel超純水機 美國密理博公司;1-15PK冷凍離心機 美國Sigma公司;LC-20AD 高效液相色譜儀 日本島津公司。
1.3 方法
1.3.1 水解度(DH)的測定
在中性和堿性條件下采用pH-stat法[14]計算水解度,計算公式如式(1)所示。

式中:c、V分別為水解過程中所加NaOH的濃度/ (mol/L)和體積/mL;mp為原料中凈蛋白質質量/g;htot為1g原料蛋白質中所含肽鍵的毫摩爾數,為7.8mmol/g pro;α為氨基的平均解離度,可按α=10pH-pK/(1+10pH-pK)計算。其中,pH為水解溶液的pH值;pK為α-氨基的解離度的負對數,此處取值為7.0。
1.3.2 ACE抑制率的測定[15]
在37℃反應體系中依次加入80μL HHL液、降血壓肽液、超純水,每次測試的總體積為0.2mL,把以上混合液放入37℃恒溫水浴中保溫3min,然后加入10μL ACE酶液啟動反應,恒溫保持30min后,加入0. 2mL 1mol/L HCl中止反應,至室溫,取5μL反應產物進樣,通過反相高效液相色譜洗脫圖譜定量馬尿酸的生成量,從而計算降血壓肽的抑制率。對ACE 抑制率為50% 時的降血壓肽濃度為半抑制濃度,即IC50。
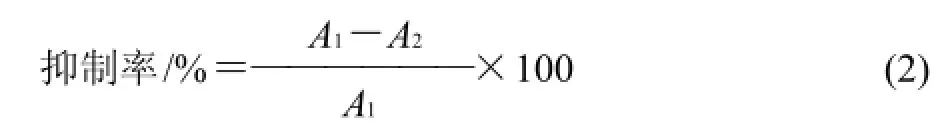
式中:A1為不存在降血壓肽時的峰面積;A2為存在降血壓肽與酶時的峰面積。
測定ACE抑制率的色譜條件:檢測器:SPD-M20A;色譜柱:島津 VP-ODS (4.6mm×150mm);洗脫液:25%乙腈-75% 超純水;洗脫液流速:1mL/min;檢測波長:228nm;進樣量:5μL。
1.3.3 蛋白酶的選擇
分別選用6種蛋白酶水解脫脂蠶蛹蛋白,反應在恒溫水浴鍋中進行。料液比1:20,加酶量2%,水解條件分別為:1)Neutrase中性蛋白酶:pH7.0、50℃;2) Papain木瓜蛋白酶:pH6.5、65℃;3)Alcalase堿性蛋白酶:pH8.0、50℃;4)Protamex復合蛋白酶:pH6.5、50℃;5)Flavourzyme風味蛋白酶:pH7.5、50℃;6) Trypsin胰蛋白酶:pH 7.5、50℃;酶解6h,計算水解度。取樣,立即置于沸水浴中加熱10min滅酶,流水冷卻,水解物在5℃。8000r/min離心10min,收集上清液,用于ACE抑制活性的測定。
1.3.4 Alcalase堿性蛋白酶水解的單因素試驗
料液比為1:20、加酶量為2%、溫度50℃、pH8.0、酶解6h,并每隔1h取樣品,分別測其ACE抑制率。
1.3.4.2 pH值對酶解效果的影響
料液比1:20、加酶量2%、溫度50℃、酶解4h,調節pH值分別為8.0、8.5、9.0、9.5、10.0,分別測酶解液的ACE抑制率。
1.3.4.3 料液比對酶解效果的影響
加酶量2%、pH9.0、酶解4h、溫度50℃,料液比分別為3:50、9:100、3:25、3:20、9:50,分別測酶解液的ACE抑制率。
1.3.4.4 酶解溫度對酶解效果的影響
料液比1:20、加酶量2%、pH9.0、酶解4h,酶解溫度分別為45、50、55、60、65℃,分別測酶解液的ACE抑制率。
2.3.2 固定效應與隨機效應的判定 需要通過Hausman檢驗(原假設為“隨機影響模型中個體影響與解釋變量不相關”),進一步確定是選取固定效應模型還是隨機效應模型.
1.3.4.5 加酶量對酶解效果的影響
料液比1:20、pH9.0、溫度50℃、酶解4h,加酶量分別為3%、5%、7%、9%、11%,分別測酶解液的ACE抑制率。
1.3.5 Alcalase堿性蛋白酶的水解條件優化試驗
根據單因素試驗的結果,采用響應面優化試驗設計,運用Box-Benhnken中心組合試驗設計原理,選擇對ACE抑制率有影響的4個因素:料液比、加酶量、pH值、溫度,進行四因素三水平的響應面優化試驗(表1),以ACE抑制率作為響應變量。

表1 響應面優化試驗因素與水平Table 1 Coded values and corresponding actual values of the hydrolysis conditions tested in response surface analysis
1.4 數據處理方法
實驗數據均是經過3次平行實驗得到的平均值,并計算其誤差,使用Design Expert分析響應面數據。
2 結果與分析
2.1 酶解的單因素試驗結果
2.1.1 不同蛋白酶對ACE抑制率及其水解度的影響
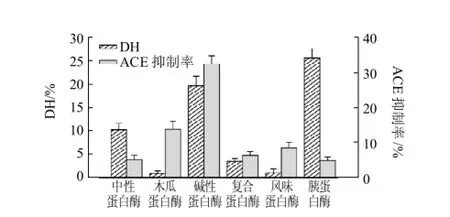
圖1 6種酶解液的ACE抑制率及其水解度的比較Fig.1 ACE-inhibitory rates and hydrolysis degrees of pupa protein hydrolysates from 6 kinds of proteases
由圖1可知,在酶解6h時,使用堿性蛋白酶的脫脂蠶蛹蛋白酶解液的ACE抑制率最高,達到了32.46%,這說明酶解得到的多肽具有抑制ACE酶活的作用。而使用胰蛋白酶的酶解液的水解度最高,達到25.66%,其酶解的程度較其他酶高,但其ACE抑制率只有4.87%,這說明其酶解生成的多肽大多不具有抑制ACE酶活性的作用。由此可看出ACE抑制率與水解度并沒有相關性,這與前人的研究一致。因此,之后的研究就只以ACE抑制率為指標,篩選用堿性蛋白酶生產ACE抑制肽的工藝條件。
2.1.2 酶解時間對酶解液ACE抑制率的影響
由圖2可知,在前3h內,ACE抑制率增加的趨勢很快,到了3h后就比較平緩。4h時,ACE抑制率為32.09%,6h為32.46%,增加不明顯。考慮生產成本,選擇酶解4h作為后期實驗的酶解時間。

圖2 酶解時間對酶解液ACE抑制率的影響Fig.2 Effect of hydrolysis time on ACE-inhibitory rate of pupa protein hydrolysate
2.1.3 pH值對酶解液ACE抑制率的影響
pH值是酶反應的主要條件之一,最適pH值是酶促反應的重要參數。過酸過堿都會使酶的空間構象發生改變,使酶活降低,而且p H值可改變底物空間解離狀態,影響與酶的結合。pH值對酶解液ACE抑制率的影響見圖3。在pH9.5時,其ACE抑制率達到最高,為35.42%。隨著pH值的繼續增加,其ACE抑制率逐漸降低。因此,選取9.5作為其較佳的酶解pH值。

圖3 pH值對酶解液ACE抑制率的影響Fig.3 Effect of hydrolysis pH on ACE-inhibitory rate of pupa protein hydrolysate
2.1.4 料液比對酶解液ACE抑制率的影響
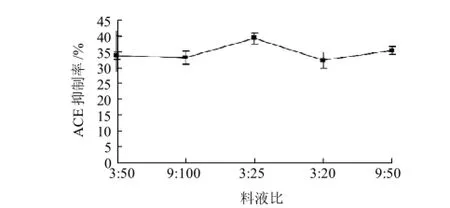
圖4 料液比對酶解液ACE抑制率的影響Fig.4 Effect of material/liquid ratio on ACE-inhibitory rate of pupa protein hydrolysate
由圖4可知,隨著料液比的增加,其ACE抑制率也逐漸增加,當料液比為3:25時,其ACE抑制率最高,為39.20%,之后又緩慢下降。因此,選取3:25作為其較佳的料液比。
2.1.5 酶解溫度對酶解液ACE抑制率的影響
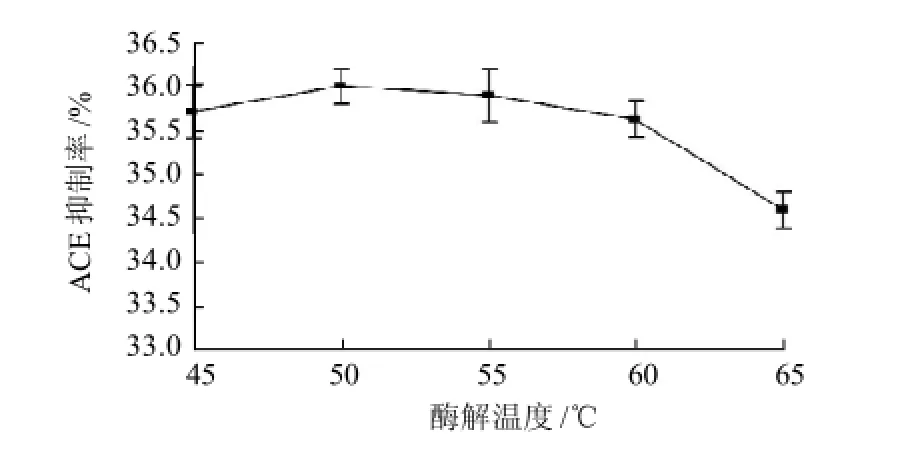
圖5 酶解溫度對酶解液ACE抑制率的影響Fig.5 Effect of hydrolysis temperature on ACE-inhibitory rate of pupa protein hydrolysate
由圖5可知,酶解溫度對酶解液的ACE抑制率的影響呈現先升高后降低的趨勢,當50℃時為最大值36.00%。因此,取酶解溫度為50℃。
2.1.6 加酶量對酶解液ACE抑制率的影響
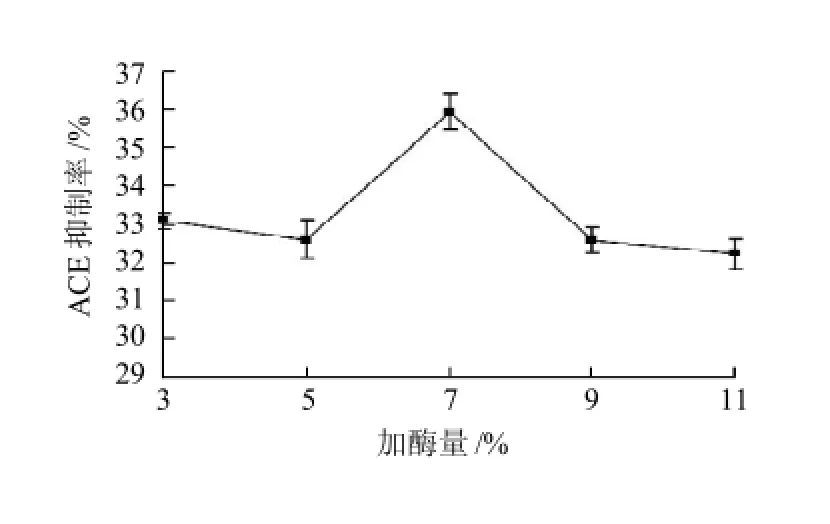
圖6 加酶量對酶解液ACE抑制率的影響Fig.6 Effect of enzyme concentration on ACE-inhibitory rate of pupa protein hydrolysate
由圖6可知,加酶量為5%~7%時,其酶解液的ACE抑制率逐漸變大,在7%時達到峰值35.92%,之后隨著加酶量的繼續增加,其抑制率卻變小。因此,選取加酶量為7%。
2.2 響應面優化試驗結果與分析
2.2.1 響應面優化試驗
采用Box-Behnken設計,利用Design Expert 7.0軟件對試驗結果進行響應面分析(表2),得出回歸模型參數的方差分析,見表3。
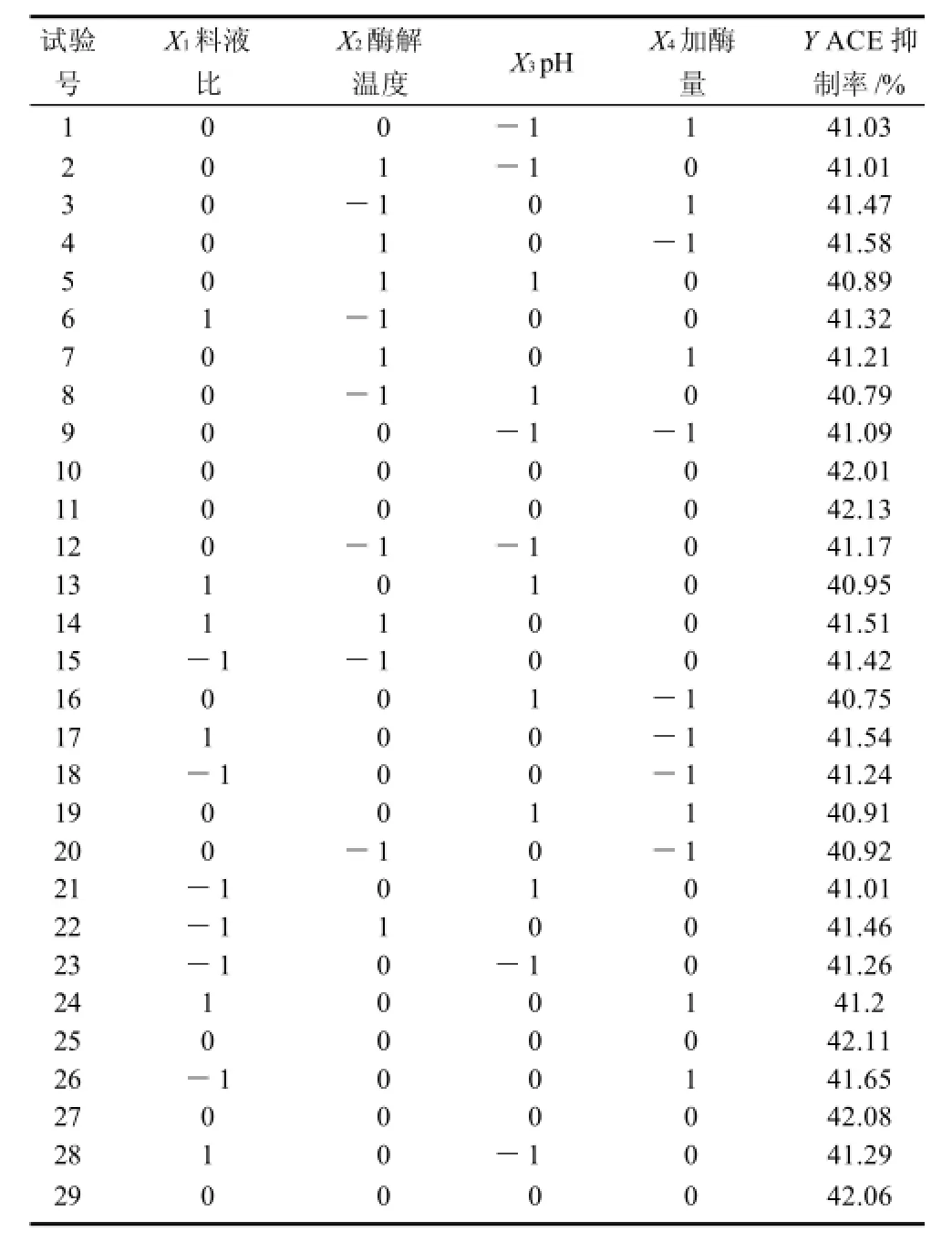
表2 響應面分析方案及試驗結果Table 2 Experimental design and results for response surface analysis
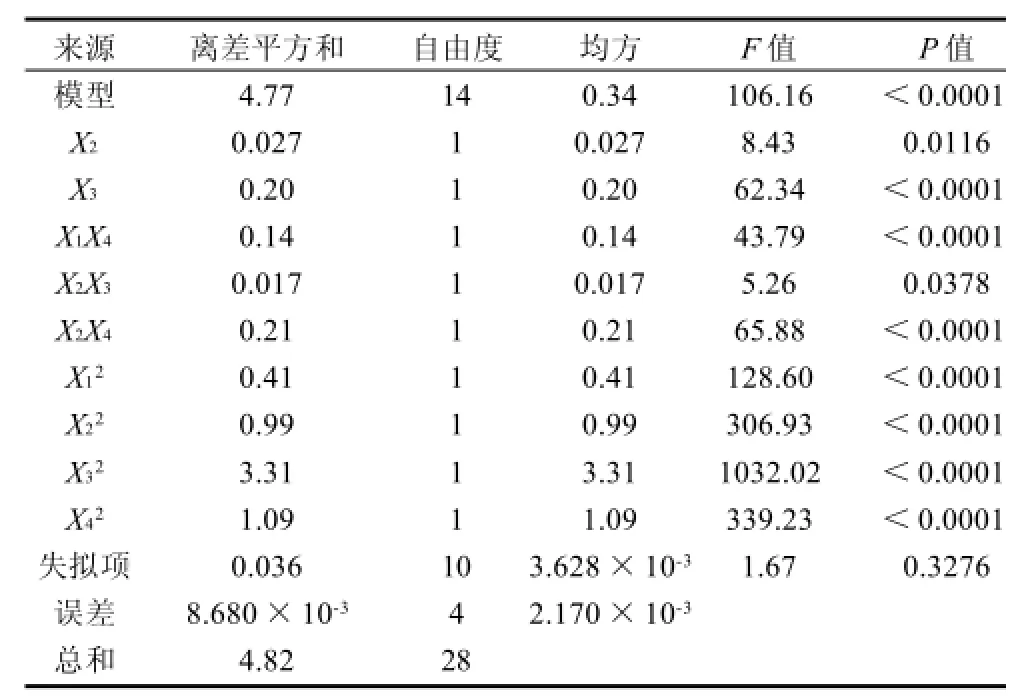
表3 二次響應模型方差分析Table 3 ANOVA results obtained for the established regression model
由表3方差分析可知,模型的P值顯著。失擬項P=0.3276(>0.05),差異不顯著,未知因素對試驗結果干擾小,說明殘差均由隨機誤差引起。R2=0.9907,說明模型擬合程度良好,試驗誤差小,該模型能夠反映響應值的變化。其二次方程為:
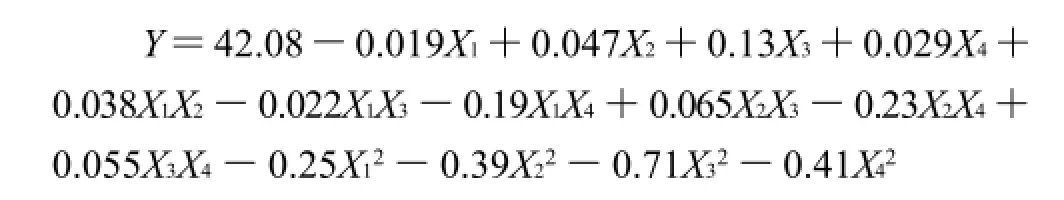
對表2的結果作響應面及其等高視線圖,如圖8~12所示,可以看出,任意兩個因素間均存在比較明顯的交互作用,最佳落點在試驗考察的區域內。
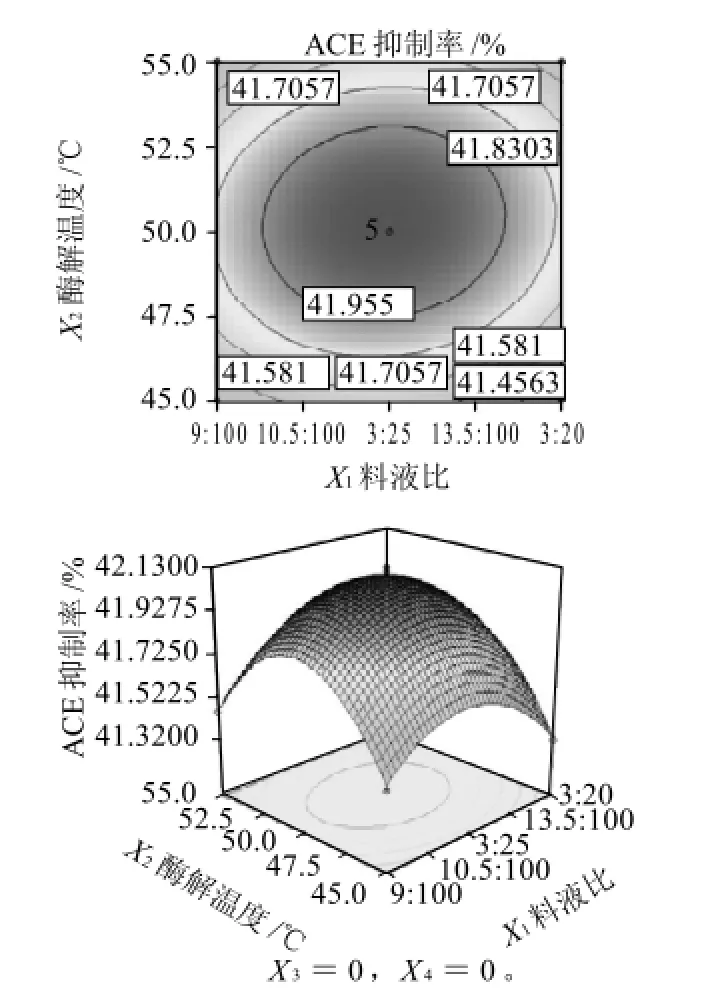
圖7 料液比和酶解溫度相互作用對ACE抑制率影響的響應面和等高線Fig.7 Response surface and contour plots for the effect of material/ liquid ratio and hydrolysis temperature on ACE-inhibitory rate of pupa protein hydrolysate

圖8 料液比和pH值相互作用對ACE抑制率影響的響應面和等高線Fig.8 Response surface and contour plots for the effect of material/ liquid ratio and enzymatic hydrolysis pH on ACE-inhibitory rate of pupa protein hydrolysate
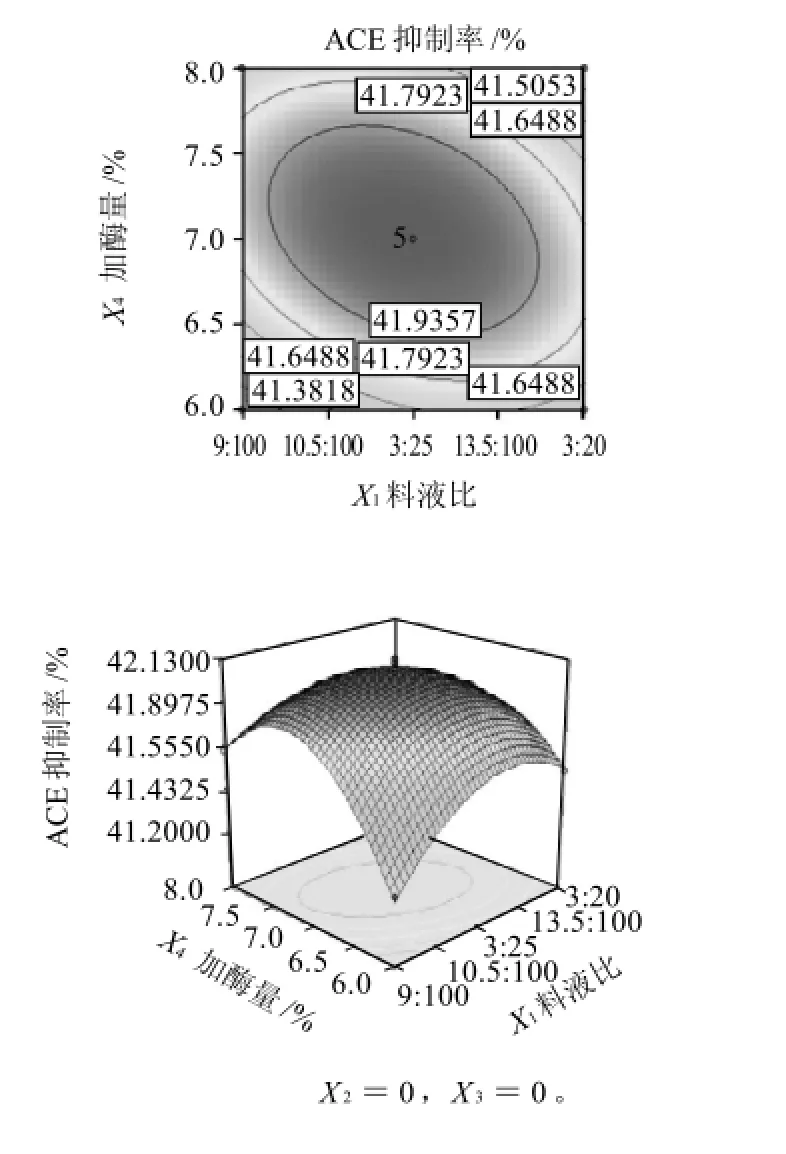
圖9 料液比和加酶量相互作用對ACE抑制率影響的響應面和等高線Fig.9 Response surface and contour plots for the effect of material/ liquid ratio and enzyme addition amount on ACE-inhibitory rate of pupa protein hydrolysate
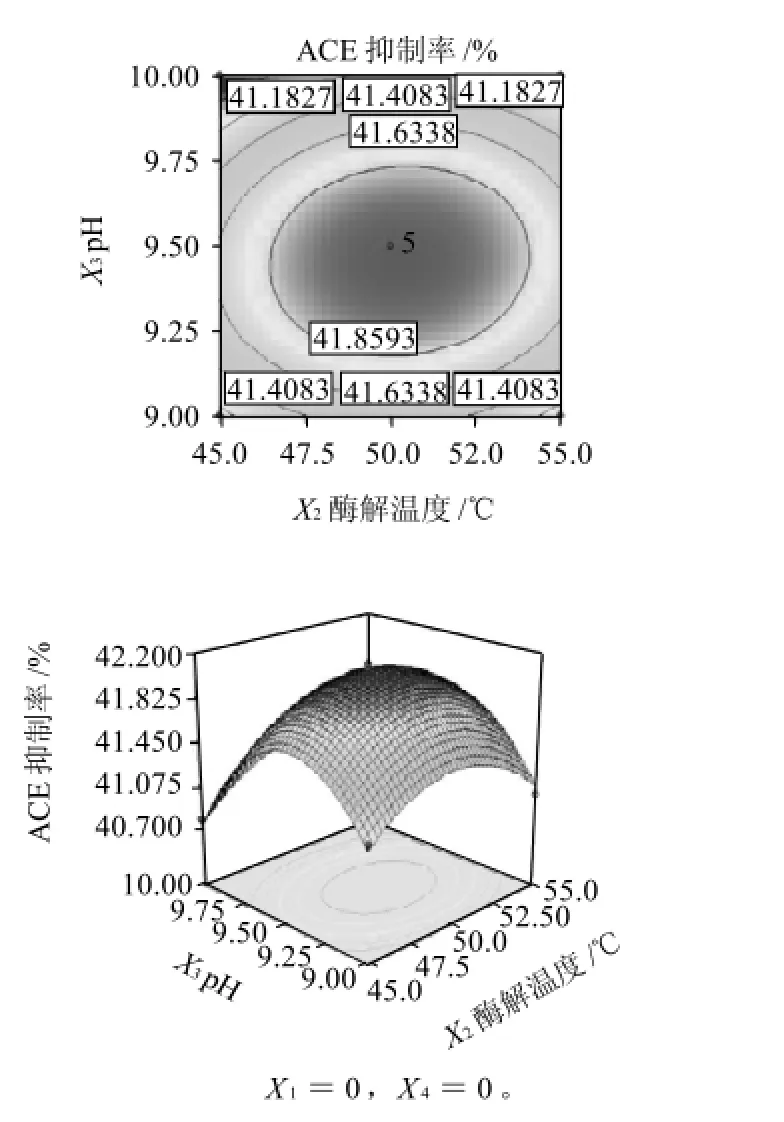
圖10 酶解溫度和pH值相互作用對ACE抑制率影響的響應面和等高線Fig.10 Response surface and contour plots for the effect of hydrolysis temperature and enzymatic hydrolysis pH on ACE-inhibitory rate of pupa protein hydrolysate
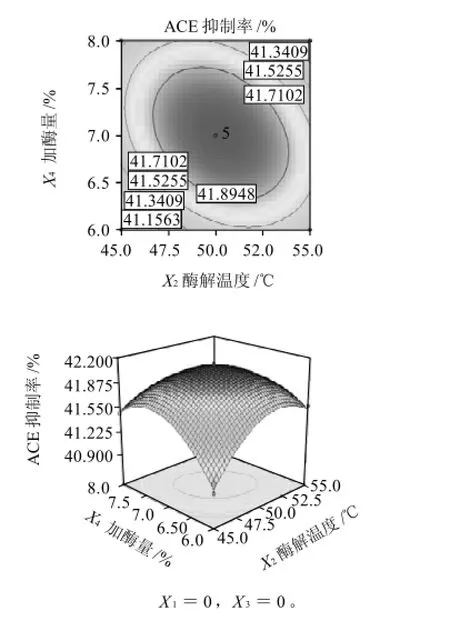
圖11 酶解溫度和加酶量相互作用對ACE抑制率影響的響應面和等高線Fig.11 Response surface and contour plots for the effects of hydrolysis temperature and enzyme addition amount on ACE-inhibitory rate of pupa protein hydrolysate
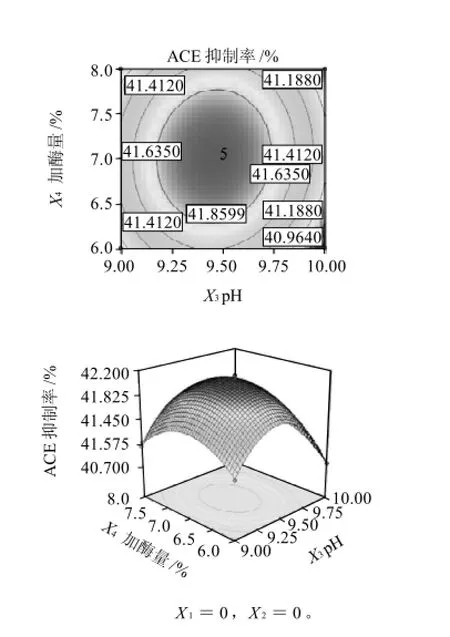
圖12 pH值和加酶量相互作用對ACE抑制率影響的響應面和等高線Fig.12 Response surface and contour plots for the effects of hydrolysis pH and enzyme addition amount on ACE-inhibitory rate of pupa protein hydrolysate
2.2.2 驗證實驗
利用Design Expert 7.0軟件進行工藝參數的優化組合[16],對優化工藝參數進行驗證,在料液比11.88:100、酶解溫度50.22℃、pH9.46、加酶量7.0 3%的條件下,所得ACE抑制膠A C E抑制率的預測值為42.09%,實際值為(41.98±0.06)%。

圖13 HPLC測定脫脂蠶蛹多肽的ACE抑制活性色譜圖Fig.13 HPLC chromatograms of pupa polypeptide with ACE inhibitory activity
脫脂蠶蛹多肽的ACE抑制活性HPLC色譜圖如圖13所示,與預測值基本一致,從而驗證了回歸方程的正確性,證明了實驗設計與分析方法較為準確可靠。
3 結 論
比較了6種商業化蛋白酶水解脫脂蠶蛹蛋白所得水解產物的ACE抑制活性,結果表明:堿性蛋白酶為最適生產脫脂蠶蛹蛋白ACE抑制肽的生產用酶。對酶解條件進行優化,在料液比11.88:100、溫度50.22℃、pH9.46、加酶量7.03%、水解4h時,脫脂蠶蛹蛋白酶解產物有最大ACE抑制活性,為41.98%。
[1]CUSHMANH D W, CHEUNG H S. Spectrophotometric assay and properties of the angiotensin-converting enzyme of rabbit lung[J]. Biochemical Pharmacology, 1971, 20(7): 1637-1648.
[2]MARUYAMA S, SUZUKI H. A peptide inhibitor of angiotensinⅠ-converting enzyme in the tyrptic hydrolysates of casein[J]. Agric Biol Chem, 1982, 46(5): 1393-1394.
[3]ARIYOSHI Y. Angiotensin-converting enzyme inhibitors derived fromfood proteins[J]. Trends in Food ScienceTechnology, 1993, 4(5): 139-144.
[4]孔保華. 蛋白質水解活性肽的研究現狀[J]. 中國畜產與食品, 1999 (3): 135-137.
[5]江利華. 花生ACE抑制肽的分離純化、結結構鑒定及體內降血壓功能研究[J]. 食品工業科技, 2009(10): 94-100.
[6]MEGIAS C, del MAR YUST M, PEDROCHE J, et al. Purification of an ACE inhibitory peptide after hydrolysis of sunflower(Helianthus annuus L.)proteinisolates[J]. J Agric Food Chem, 2004, 52(7): 1928-1932.
[7]閔建華, 李建科, 陳婷. 蠶蛹多肽的制備工藝及其體外抗氧化活性[J]. 食品科學, 2009, 30(14): 123-126.
[8]陳靜, 鄭明珠, 王浩. 蠶蛹蛋白肽的制備及其運動飲料研制[J]. 食品科學, 2009, 30(14): 318-320.
[9]王偉. 蠶蛹蛋白的綜合利用現狀分析和開發前景展望[J]. 食品與發酵工業, 2006, 32(9): 112-115.
[10]ZHAO Yuanhui, LI Bafang, LIU Zunying, et al. Antihypertensive effect and purification of an ACE inhibitory peptide from sea cucumber gelatin hydrolysate[J]. Process Biochemistry, 2007, 42(12): 1586-1591.
[11]MIYOSHI S, ISHIKAWA H, KANEKO T, et al. Structures and activity of angiotensin-converting enzyme inhibitors in analpha-zein hydrolysate [J]. Agricultural and Biological Chemistry, 1991, 55(5): 1313-1318.
[12]MIZUNO S, NISHIMURA S, MATSUURA K, et al. Release of short and proline-rich antihypertensive peptides from casein hydrolysate with an Aspergillus oryzae protease[J]. Journal of Dairy Science, 2004, 87 (10): 3183-3188.
[13]SAIGA A, OKUMURA T, MAKIHARA T, et al. Action mechanism of an angiotensinⅠ-converting enzyme inhibitory peptide derived from chicken breast muscle[J]. Journal of Agricultural and Food Chemistry, 2006, 54(3): 942-945.
[14]ADAMSON N J, REYNOLDS E C. Characterization of casein phosphopeptides prepared using alcalase: determination of enzyme specificity[J]. Enzyme and Microbial Technology, 1996, 19(3): 202-209.
[15]KUNIO S. Isolation and characterization of angiotensinⅠ-converting enzyme inhibitor dipeptides derived from Allium sativum L. (garlic)[J]. Nutr Biochem, 1998, 9(7): 415-419.
[16]吳有煒. 試驗設計與數據處理[M]. 蘇州: 蘇州大學出版社, 2002: 115-154.
Enzymatic Preparation of ACE-Inhibitory Peptide from Pupa Protein
LI Yong1,2,WANG Ying1,2,HUANG Xian-zhi3,KAN Jian-quan1,2,*,JIN Sheng-kun1,HE Ya-ping1,2, HU Yi-qiao1,2,LIAO Chen1,2
(1. College of Food Science, Southwest University, Chongqing 400715, China;2. Chongqing Key Laboratory of Produce Processing and Storage, Chongqing 400715, China;3. College of Biotechnology, Southwest University, Chongqing 400715, China)
Defatted pupa protein was prepared in our laboratory and used further to prepare ACE-inhibitory peptide by enzymatic hydrolysis. The best protease for preparing ACE-inhibitory peptide from pupa protein was chosen out of neutral protease, alcalase, papain, protamex, flavourzyme and trypsin. The hydrolysis process was optimized using response surface methodology. Neutral protease was found to be the best among all investigated proteases. The optimal hydrolysis conditions were determined as follows: substrate concentration of 11.88:100, hydrolysis temperature of 50.22 ℃, hydrolysis pH of 9.46, and enzyme concentration of 7.03%, hydrolysis time of 4 h. Under these conditions, pupa protein hydrolysate with an ACE-inhibitory rate of 41.98% was obtained.
pupa protein;ACE-inhibitory peptide;enzymatic hydrolysis;process conditions
TS218
A
1002-6630(2012)11-0151-07
2011-06-06
國家現代農業(桑蠶)產業技術體系建設專項(CARS-22-ZJ0503)
李勇(1986—),男,碩士研究生,研究方向為食品化學與營養學。E-mail:frog46@126.com
*通信作者:闞建全(1965—),男,教授,博士,研究方向為食品化學與營養學、食品生物技術。E-mail:ganjq1965@163.com

