紅曲菌的復(fù)合誘變及其固態(tài)發(fā)酵條件的優(yōu)化
楊歡歡,胡中澤*
(武漢工業(yè)學(xué)院食品科學(xué)與工程學(xué)院,湖北 武漢 430023)
紅曲菌的復(fù)合誘變及其固態(tài)發(fā)酵條件的優(yōu)化
楊歡歡,胡中澤*
(武漢工業(yè)學(xué)院食品科學(xué)與工程學(xué)院,湖北 武漢 430023)
通過紫外線和LiCl對一株紅曲菌MP進行復(fù)合誘變,并通過響應(yīng)面法對其固態(tài)發(fā)酵條件進行優(yōu)化分析。結(jié)果表明:在前期溫度為30℃,后期溫度為24℃,初始含水量為60%的條件下,Monacolin K的產(chǎn)量最高可達5.33mg/g。
紅曲菌;復(fù)合誘變;Monacolin K;響應(yīng)面
紅曲起源于中國,其在食品方面的應(yīng)用已很廣泛。目前,隨著對紅曲研究的深入,紅曲在醫(yī)藥保健方面的用途也越來越受關(guān)注,其中功能性紅曲在此方面的價值更為突出。功能性紅曲是指可降膽固醇、治療高血脂的紅曲[1-2]。
紅曲菌的主要功能性產(chǎn)物之一——Monacolin K是日本遠藤章利用小型發(fā)酵罐深層發(fā)酵培養(yǎng)紅曲菌得到的。Monacolin K抑制膽固醇形成的機理是Monacolin K能競爭性地抑制羥甲基戊二酰輔酶A (HMG-CoA) 還原酶(HMG-R),進而抑制了膽固醇的合成,其中HMGCoA還原酶是膽固醇合成中的限速酶[3]。Monacolin K還能增加膽固醇的分解代謝,降低甘油三酯及低密度脂蛋白(LDL)[4]。由于此種特性,如何提高紅曲菌中Monacolin K的產(chǎn)量成為研究重點。
目前紅曲生產(chǎn)中廣泛采用的是固態(tài)發(fā)酵法,其具有投資少,產(chǎn)量大,生產(chǎn)經(jīng)驗豐富等優(yōu)點[5]。生產(chǎn)Monacolin K一般也利用紅曲菌固體發(fā)酵法,但在工業(yè)化固體培養(yǎng)時,培養(yǎng)條件對其產(chǎn)量的影響很大,因此合理設(shè)計固態(tài)發(fā)酵工藝條件是達到高產(chǎn)Monacolin K目的的關(guān)鍵步驟[6]。
本實驗利用理化復(fù)合誘變方法提高紅曲菌產(chǎn)Monacolin K的能力,并通過響應(yīng)面分析法研究固態(tài)發(fā)酵過程中各工藝條件對紅曲生產(chǎn)Monacolin K的影響,最終得到固態(tài)發(fā)酵條件的最優(yōu)組合。
1 材料與方法
1.1 菌株與培養(yǎng)基
紅曲菌MP 本實驗室分離保藏。
基礎(chǔ)培養(yǎng)基:麥芽汁10°Bx,瓊脂2%。用作斜面和平板培養(yǎng)。固態(tài)發(fā)酵培養(yǎng)基:適量發(fā)芽糙米洗凈浸泡后于250mL錐形瓶中蒸煮,滅菌20min。
1.2 試劑與儀器
無水乙醇、磷酸(分析級)、乙腈(色譜級)、洛伐他汀對照品。
PHS-3C型精密pH計 上海精密科學(xué)儀器有限公司;YM50型不銹鋼立式蒸汽消毒器 上海三申醫(yī)療器械有限公司;YM50型不銹鋼立式高壓蒸汽滅菌箱 上海三申醫(yī)療器械有限公司;DNP-9082型電熱恒溫培養(yǎng)箱上海精密實驗設(shè)備有限公司;SW-CJ-2D型凈化工作臺廣州瑞智科學(xué)儀器有限公司。
1.3 方法
1.3.1 菌株誘變的處理方法
在紅曲菌的培養(yǎng)過程中,Monacolin K是次級代謝產(chǎn)物,代謝機制復(fù)雜,其產(chǎn)量是由多基因決定的,誘變后產(chǎn)量提高是多基因效應(yīng)的結(jié)果[7]。本實驗采用LiCl作為化學(xué)因子和UV作為物理因子對紅曲菌MP進行復(fù)合誘變處理。
具體操作步驟:量取6mL孢子懸液于無菌平皿中,在距離紫外燈30cm處打開皿蓋開始照射。將照射后的菌懸液轉(zhuǎn)入無菌試管中,并立即浸入冰水中暗室保存3h。按10倍稀釋法將經(jīng)UV處理過的孢子懸液依次稀釋,并各吸取0.1mL涂布在含有0.8g/L LiCl溶液的平板上,放入暗室中34℃培養(yǎng)6d,以備分離篩選[7]。
1.3.2 誘變篩選
在對菌種進行誘變時,只有每次誘變后有1~2個控制產(chǎn)量的基因突變,使產(chǎn)量合成稍有增加且又能維持其最起碼代謝平衡的菌株才能生存下來,因此,高產(chǎn)菌株的產(chǎn)量提高,是通過多代誘發(fā)突變逐漸積累的結(jié)果[8]。
采用傳統(tǒng)選育中常用的方法,挑選的菌落直接接入固體培養(yǎng)基中培養(yǎng)。
第一代:紅曲菌MP→制備孢子懸液→UV照射→分離到含有LiCl的MEA平板上→挑選200個菌落→初篩50株→復(fù)篩4株[8]。第二代:出發(fā)菌株4株→制備孢子懸液→UV照射→分離到含有LiCl的MEA平板上→挑選200個菌落→初篩50株→復(fù)篩4株。第三、四代與以上操作方法相同。
初篩:選擇生長速度減緩和形態(tài)發(fā)生明顯變異的菌落。
復(fù)篩:對初篩出的50株紅曲菌進行固態(tài)發(fā)酵培養(yǎng)14d,采用HPLC法對發(fā)酵產(chǎn)物中的Monacolin K進行定量檢測,篩選出產(chǎn)量高的菌株[9-10]。
1.3.3 HPLC法定量檢測
樣品處理:將發(fā)酵后的紅曲米于60℃烘干至質(zhì)量恒定,研磨過100目篩。取適量樣品溶于5mL流動相中,并超聲助溶30min,40℃水浴1h,5000r/min離心15min,取上清液過0.45μm濾膜待用。
色譜柱:Welchrom-C18(4.6mm×250mm,5μm);檢測波長:238nm;流動相:乙腈-磷酸水溶液;流速:1mL/min;進樣量:20μL。
1.3.4 響應(yīng)面試驗分析法
在紅曲菌固態(tài)發(fā)酵萌芽米過程中采用變溫培養(yǎng),以前期培養(yǎng)溫度、后期培養(yǎng)溫度以及初始含水量為3個主要影響因素,進行單因素試驗,基于單因素試驗結(jié)果確定響應(yīng)面試驗因素水平。具體設(shè)計見表1。

表1 響應(yīng)面試驗因素水平及編碼設(shè)計表Table 1 Factors and levels in Box-Behnken design
2 結(jié)果與分析
2.1 復(fù)合誘變
2.1.1 紫外線復(fù)合0.8g/L LiCl誘變對菌株的影響
選擇紫外線照射時間分別為15、30、45、60、75、90、105、120s,將孢子懸液涂布在含LiCl質(zhì)量濃度為0.8g/L的MEA平板上,觀察紅曲菌的生長情況。

圖1 紫外線照射時間對紅曲孢子的致死作用Fig.1 Lethal effect of UV light on Monascus purpureu
由圖1可知,孢子的致死率隨著紫外照射時間的延長而增大,當照射時間為120s時,孢子的致死率近100%。而照射時間90s時致死率為90%左右,將此時間作為復(fù)合誘變處理的紫外照射時間。
2.1.2 復(fù)合誘變篩選出菌種的發(fā)酵產(chǎn)量

圖2 突變菌株和出發(fā)菌株M-H2的比較Fig.2 Comparative monacolin K yield of original strain M-H2 and its mutant strains
對紅曲菌MP進行上述復(fù)合誘變,誘變條件為紫外照射時間90s,LiCl質(zhì)量濃度為0.8g/L。MP經(jīng)誘變后得到80多株突變株,挑取菌落形態(tài)發(fā)生明顯變異的30株進行固態(tài)發(fā)酵培養(yǎng)14d,采用HPLC法對發(fā)酵產(chǎn)物中的Monacolin K進行定量檢測。按1.3.2節(jié)的篩選步驟和方法,連續(xù)誘變4代后得到以下突變株,結(jié)果如圖2所示。15株菌株為第一、二、三代突變株中Monacolin K產(chǎn)量較高菌株,而第四代誘變時,相同條件下致死率下降,產(chǎn)Monacolin K能力無明顯變化。經(jīng)過初篩和復(fù)篩,并與誘變前進行比較得到目的菌株M-H4-3,其Monacolin K的產(chǎn)量為4.02mg/g,而相同發(fā)酵條件下出發(fā)菌株M-H2的Monacolin K的產(chǎn)量僅為2.35mg/g。
2.1.3 遺傳穩(wěn)定性實驗
對目的菌株M-H4-3進行遺傳穩(wěn)定性實驗,將其接種在麥芽汁培養(yǎng)基上連續(xù)傳代至第五代,每代均接種到萌芽米上進行固態(tài)發(fā)酵培養(yǎng)。利用HPLC法對發(fā)酵樣品進行檢測,結(jié)果見圖3。菌株M-H4-3在固態(tài)發(fā)酵萌芽米過程中對Monacolin K有較高的產(chǎn)量,且性能穩(wěn)定。

圖3 突變株M-H4-3遺傳穩(wěn)定性實驗結(jié)果Fig.3 Genetic stability of mutant strain M-H4-3
2.2 前期溫度對Monacolin K產(chǎn)量的影響

圖4 前期溫度對Monacolin K產(chǎn)量的影響Fig.4 Effect of initial temperature on monacolin K yield
Monacolin K是紅曲發(fā)酵過程中產(chǎn)生的次級代謝產(chǎn)物,而次級代謝的一個重要特征是其代謝產(chǎn)物一般只在菌絲體的生長速率降低時才合成[11],因此Monacolin K的形成應(yīng)滯后于菌絲體的生長,而紅曲菌絲體的良好生長是高產(chǎn)Monacolin K的重要基礎(chǔ)[12]。采用變溫培養(yǎng),在其他條件不變的情況下,首先固定后期溫度為25℃,研究前期發(fā)酵溫度對Monacolin K產(chǎn)量的影響,結(jié)果見圖4。30℃時Monacolin K產(chǎn)量最高,之后Monacolin K產(chǎn)量隨著溫度的升高而增大,當溫度升至38℃時幾乎沒有產(chǎn)量,說明此溫度紅曲菌菌絲體幾乎不生長。
2.3 后期溫度對Monacolin K產(chǎn)量的影響
在紅曲米發(fā)酵過程中后期溫度直接影響Monacolin K在菌絲體生長中的代謝積累[13],因此,固定前期溫度30℃,后期溫度分別設(shè)為20、24、28、32℃培養(yǎng)紅曲米,研究后期溫度對Monacolin K產(chǎn)量的影響,結(jié)果見圖5。

圖5 后期溫度對Monacolin K產(chǎn)量的影響Fig.5 Effect of late temperature on monacolin K yield
由圖5可知,后期溫度為24℃時Monacolin K的產(chǎn)量達到最大,而當溫度高于24℃時Monacolin K的產(chǎn)量驟降,當后期溫度高于前期溫度時紅曲生長緩慢幾乎不代謝Monacolin K。
2.4 初始含水量對Monacolin K產(chǎn)量的影響

圖6 初始含水量對Monacolin K產(chǎn)量的影響Fig.6 Effect of original moisture content on monacolin K yield
在固態(tài)發(fā)酵時,孢子萌發(fā)及菌絲生長都需要適宜的水分,而固態(tài)發(fā)酵最大的特點就是無游離水[14],因此底物含水量的變化對微生物的生長及代謝能力會產(chǎn)生重要的影響[15]。在其他條件不變的情況下進行發(fā)酵實驗,研究初始含水量對Monacolin K產(chǎn)量的影響,結(jié)果見圖6。在初始含水量60%時Monacolin K累積量達到最大值,通過觀察各水平紅曲米的發(fā)酵生長情況得知潮濕的環(huán)境比較適合紅曲菌的生長。
2.5 固態(tài)發(fā)酵條件的響應(yīng)面分析結(jié)果
以Monacolin K的產(chǎn)量為響應(yīng)值(Y),通過Box-Behnken設(shè)計并進行試驗,得到紅曲菌固態(tài)發(fā)酵萌芽米的最優(yōu)組合條件。結(jié)果見表2。方差分析見表3。根據(jù)回歸方程,采用軟件繪制響應(yīng)面和等值線圖,考察響應(yīng)曲面情況,見圖7。

表2 響應(yīng)面試驗設(shè)計方案與結(jié)果Table 2 Box-Behnken experimental design and results for response surface analysis
對表2中的數(shù)據(jù)進行二次多項回歸擬合,獲得回歸方程:
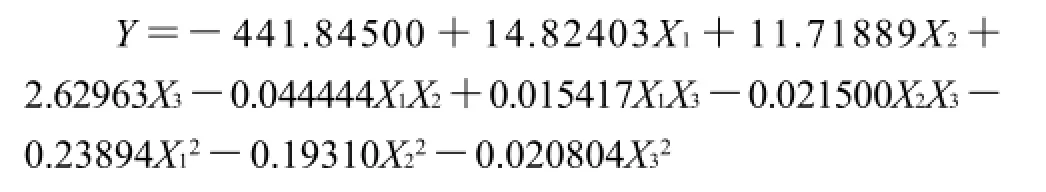
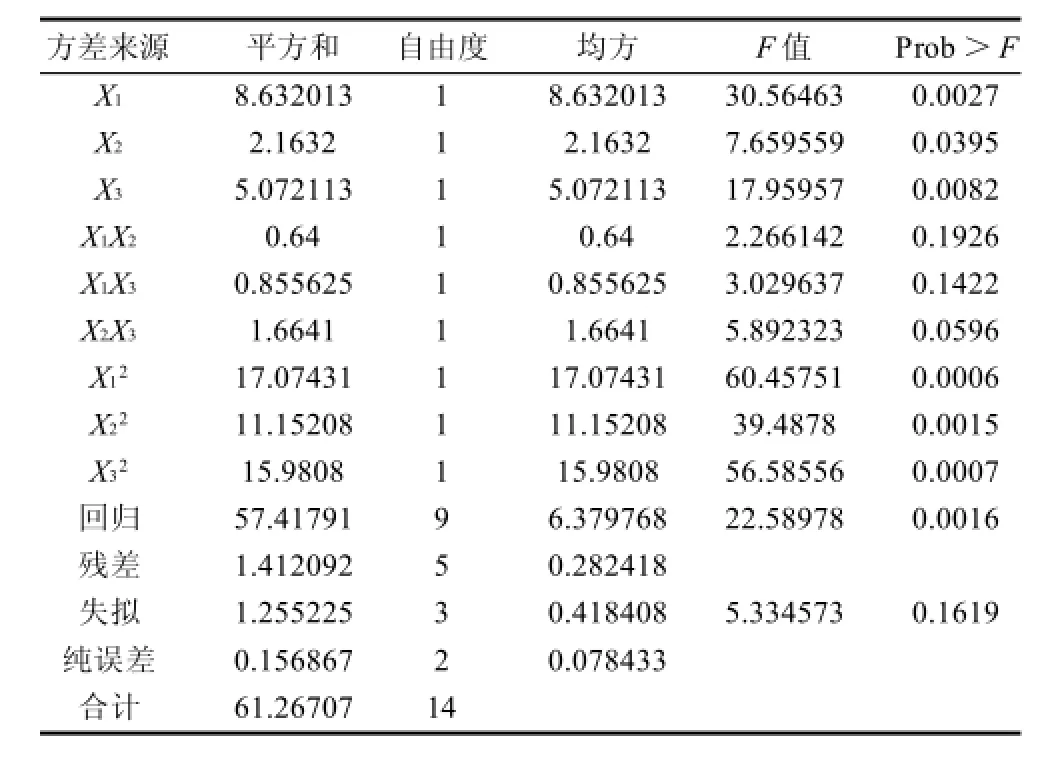
表3 方差分析Table 3 Variance analysis for the fitted regression equations
對回歸方程求一階偏導(dǎo)數(shù)并等于零,得到有3個方程組成的方程組,解答該方程組得到:X1=30.53,X2=25.68,X3=60.07。即應(yīng)用數(shù)學(xué)模型得出的理論最優(yōu)培養(yǎng)條件:前期溫度為30.53℃,后期溫度為25.68℃,初始含水量為60.07%,Y的最大值為5.92mg/g。而第4組試驗的產(chǎn)量最高,即在前期溫度為30℃、后期溫度為24℃、初始含水量為60%的條件下,Monacolin K產(chǎn)量是5.69mg/g。因此可以看出理論最優(yōu)點在此附近。
由表3可知,一次項以及二次項對響應(yīng)值的影響均很顯著,交互項則不顯著。在此模型中失擬項不顯著,回歸高度顯著,可以用此模型進行響應(yīng)值的預(yù)測。模型的復(fù)相關(guān)系數(shù)的平方R2=0.9981,說明回歸方程的擬合程度良好,可以用該方程代替真實試驗點進行分析。
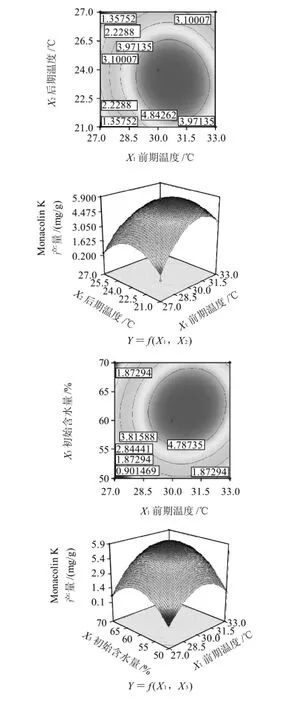

圖7 前期溫度、后期溫度和初始含水量對Monacolin K產(chǎn)量影響的響應(yīng)面及等值線圖Fig.7 Response surface and contour plots for the effects of initial temperature, late temperature and original moisture content on monacolin K yield
2.6 擬合優(yōu)化的驗證
為檢驗響應(yīng)面法所得結(jié)果的可靠性,通過重復(fù)性實驗對統(tǒng)計分析計算出的理論最優(yōu)條件進行驗證,即在前期溫度為30℃、后期溫度為24℃、初始含水量為60%的條件下,用目的菌株M-H4-3固態(tài)發(fā)酵萌芽米,進行5次固態(tài)發(fā)酵所得的實驗數(shù)據(jù)的平均值為5.33mg/g,與理論值的相對誤差為0.91%。
3 結(jié) 論
3.1 以LiCl作為化學(xué)因子和UV作為物理因子對紅曲菌MP進行復(fù)合誘變處理,通過反復(fù)誘變和篩選得到一株Monacolin K產(chǎn)量較高的菌株M-H4-3,其產(chǎn)量為4.02mg/g,與作為對照的出發(fā)菌株(2.35mg/g)相比,其產(chǎn)量提高1.7倍。
3.2 通過單因素及響應(yīng)面試驗對紅曲菌固態(tài)發(fā)酵萌芽米條件進行優(yōu)化,并通過Box-Behnken試驗設(shè)計,建立紅曲菌固態(tài)發(fā)酵萌芽米過程中Monacolin K代謝積累的回歸模型,分析各因素效應(yīng)的顯著性以及兩兩因素間的交互作用。在前期溫度為30℃、后期溫度為24℃、初始含水量為60%的條件下,Monacolin K產(chǎn)量提高至5.33mg/g。
[1]熊曉輝, 張李陽, 韋策, 等. 紅曲霉菌產(chǎn)Monacolin K固體發(fā)酵條件的優(yōu)化[J]. 無錫輕工大學(xué)學(xué)報, 2004, 23(1): 8-10.
[2]崔有貴, 李永峰, 任南奇, 等. 甜菜廢蜜生物制氫細菌的誘變育種[J].中國甜菜糖業(yè), 2004, 1(3): 36-40.
[3]張素青. 糖蜜發(fā)酵選育高產(chǎn)蛋白酵母及發(fā)酵條件優(yōu)化研究[J]. 內(nèi)蒙古農(nóng)業(yè)大學(xué), 2009, 12(7): 76-80.
[4]丘振宇, 王雅琴, 許喜林, 等. 紅曲霉的特點及應(yīng)用研究[J]. 食品工業(yè)科技, 2006(12): 55-59.
[5]張良. 高產(chǎn)Monacolin K紅曲菌的誘變選育及其固態(tài)發(fā)酵條件的優(yōu)化[D]. 南昌: 南昌大學(xué), 2010.
[6]王金字. 紅曲菌固態(tài)發(fā)酵產(chǎn)紅曲色素和Monacolin K條件研究[J]. 陜西科技大學(xué), 2010, 20(3): 67-71.
[7]索江華, 黃現(xiàn)青, 郭爽, 等. 紅曲霉及其主要產(chǎn)物[J]. 鄭州牧業(yè)工程高等專科學(xué)校學(xué)報, 2006(1): 21-23.
[8]孫嘉龍, 鄒曉, 劉愛英, 等. 高產(chǎn)Monacolin K紅曲菌株的復(fù)合誘變選育[J]. 菌物學(xué)報, 2007, 26(4): 507-516.
[9]王立新, 莫海濤, 石紅. 紅曲霉固態(tài)發(fā)酵生產(chǎn)洛伐他汀的研究[J]. 中國抗生素雜志, 1999, 24(2): 96-98.
[10]SAYYAD S A, PANDA B P, JAVED S, et al. Optimization of nutrient parameters for lovastatin production by Monascus purpureus MTCC 369 under submerged fermentation using response surface methodology [J]. Microbiol Biotechnol, 2007, 73(21): 1054-1058.
[11]WANG J, LEE C L, PAN T M. Improvement of Monacolin K, γaminobutyric acid and citrinin production ratio as a function of environmental conditions of Monascus purpureus NTU 601[J]. Microbiol Biotechnol, 2003, 30(12): 669-676.
[12]諶斌. 紫紅曲的原生質(zhì)體紫外線誘變育種[J]. 廣西科學(xué)院學(xué)報, 1999, 15(2): 86-89.
[13]BLANC P J, LAUSZAC J P, le BARS J, et a1. Characterization of monascidin A from Monascus as citrinin[J]. Int J Food Micmbiol, 1995, 27(2/3): 201-213.
[14]CHULEE C H. Mycelial reactions and mycelial compatibility group of red rice mould (Monascus purpureus)[J]. The British Mycological Society, 2002, 106(3): 298-304.
[15]MAARSE H. Volatile compounds in foods and beverages[M]. New York: Mareel Dekker, 1991: 168-173.
Combined Mutation of Monascus and Optimization of Fermentation Conditions for Monacolin K Production
YANG Huan-huan,HU Zhong-ze*
(College of Food Science and Engineering, Wuhan Polytechnic University, Wuhan 430023, China)
A strain of Monascus purpureu was treated with UV irradiation and its spore was then incubated in media containing LiCl to induce mutation. A mutant strain with high yield of monacolin K was obtained and its fermentation conditions were optimized for monacolin K production. The results showed that the optimal fermentation conditions were initial temperature of 30 ℃, late temperature of 24 ℃ and original moisture content of germinated brown rice of 60%. Under these conditions, the yield of monacolin K reached 5.33 mg/g.
Monascus;combined mutation;monacolin K;response surface methodology
Q939.99
A
1002-6630(2012)11-0247-05
2011-05-18
湖北省自然科學(xué)基金重點項目(2009CDA099)
楊歡歡(1986—),女,碩士研究生,研究方向為食品微生物。E-mail:yanghuanhuan022@126.com
*通信作者:胡中澤(1968—),男,教授,碩士,研究方向為糧油工程。E-mail:hzz1968@126.com

