不同免疫球蛋白啟動子控制的白喉毒素A鏈基因對淋巴瘤細胞的抑制作用
姚娜 芮紅兵
白喉毒素A鏈(DT-A)基因在真核細胞中的表達可以產生細胞毒性作用并殺死該細胞[1,2]。白喉毒素對于真核細胞來說,其毒性是極其強烈的,但將DT-A基因與組織細胞特異性順式調控序列(啟動子/增強子)連接,則該基因的表達只限定在該種特定細胞中,在其他細胞中將不表達。已有實驗證明,在轉基因老鼠中導入由組織細胞特異性啟動子控制的DT-A基因只能在特定細胞中表達,而對其他細胞無毒性作用,因此,白喉毒素基因組織特異性表達的特性可以應用于惡性腫瘤的靶向治療[3,4]。免疫球蛋白啟動子/增強子可以有效而特異性地控制其下游基因在產免疫球蛋白的B淋巴細胞或骨髓瘤細胞中表達[5]。如將免疫球蛋白啟動子/增強子與某些毒素基因相連,可以使該基因特異性地在產免疫球蛋白的細胞中表達,從而可將此毒素應用于某些B淋巴系惡性腫瘤的治療。本研究探討了不同免疫球蛋白啟動子控制的白喉毒素A鏈基因對淋巴瘤細胞的抑制作用。
1 材料與方法
1.1 質粒與試劑 由鼠免疫球蛋白κ輕鏈啟動子/增強子控制的白喉毒素A鏈真核表達載體pcDNA3IgκDTA、由鼠免疫球蛋白重鏈啟動子/增強子控制的白喉毒素A鏈真核表達載體pcDNA3IgHDTA由本室構建,同時構建的還有含報告基因β半乳糖苷酶基因的真核表達載體 pcDNA3IgκLacZ、pcDNA3IgHLacZ。巨細胞病毒(CMV)啟動子控制的真核表達載體pcDNA3LacZ由蘇津自博士(福建省高血壓研究所)惠贈。SP2/0-Ag14細胞(SP2)為鼠骨髓瘤細胞株,不產生也不分泌免疫球蛋白;CA46為人Burkitt's淋巴瘤細胞株,產生及分泌IgM免疫球蛋白及表面IgMκ輕鏈,K562為人白血病細胞株,該三種細胞株均購自中國典型培養物保藏中心(CCTCC)。培養條件:含10%滅活小牛血清的HDMEM培養液,37℃、5%CO2飽和濕度的CO2培養箱中培養。Wizard DNA Clean-up System DNA純化試劑盒、細胞活力檢測試劑盒Cell-Titer 96? AQueousOne Solution Cell Proliferation Assay及脂質體轉染試劑盒TransfastTMTransfection Reagent購自Promega公司;培養基HDMEM購自GIBCO公司。
1.2 方法
1.2.1 質粒DNA的轉染及β半乳糖苷酶活性測定 質粒DNA的轉染由脂質體(TransfastTMtransfection reagents,Promega)介導,同時轉染三種細胞。轉染方法按說明書進行:在0.5ml無血清的 HDMEM培養液中加入4μg質粒 DNA、12 μl脂質體,立即渦旋混勻以形成脂質體/DNA混合體,再將脂質體/DNA混合體加入培養于6孔培養板的1×106細胞中,置37℃、5%CO2培養箱中轉染1 h,再加入含10%小牛血清的完全培養基5ml,置37℃、5%CO2中培養48 h后收集細胞,將細胞反復凍融三次獲得細胞提取液,然后按《分子克隆實驗指南》中的方法進行β-半乳糖苷酶活性的檢測[6]。為了消除脂質體在不同細胞中轉染率差異的影響,同時以質粒pcDNA3LacZ轉染相同的細胞,以pcDNA3LacZ轉染細胞的β半乳糖苷酶活性為標準,目的基因轉染細胞的β半乳糖苷酶相對活性為pcDNA3IgκLacZ/pcDNA3LacZ和pcDNA3IgHLacZ/pcDNA3LacZ。
1.2.2 不同免疫球蛋白啟動子控制的白喉毒素A鏈基因對β-半乳糖苷酶活性的抑制 將質粒 pcDNA3IgκDTA或pcDNA3IgHDTA與β-半乳糖苷酶基因進行共轉染實驗,轉染細胞為CA46細胞株,轉染方法仍由脂質體(TransfastTMtransfection reagents,Promega)介導,轉染方法按說明書進行。質粒DNA包含2μg質粒 pcDNA3LacZ 及 2μg質粒 pcDNA3IgκDTA 或pcDNA3IgHDTA,對照組以質粒pcDNA3代替pcDNA3IgκDTA或pcDNA3IgHDTA。以共轉染CA46細胞后48 h瞬時表達的半乳糖苷酶活性的抑制程度來估測質粒pcDNA3IgκDTA或pcDNA3IgHDTA在CA46細胞中DT-A的表達水平。
1.2.3 DT-A基因的表達對腫瘤細胞的抑制作用 按每孔2×105細胞在24孔板中接種CA46細胞,脂質體介導含DT-A基因質粒pcDNA3IgκDTA或pcDNA3IgHDTA轉染細胞,同時以質粒 pcDNA3IgκLacZ或 pcDNA3IgHLacZ作為對照,觀察DT-A基因的表達對腫瘤細胞的毒性作用。轉染后第1、3、5、7天由臺盼藍拒染實驗計數活細胞并繪制細胞生長曲線,比較實驗組與對照組細胞存活情況。另外,細胞活力也通過試劑盒CellTiter 96?AQueousOne Solution Cell Proliferation Assay(Promega)以MTS法測定,方法按說明書進行,在轉染的96孔培養板細胞中按每孔20 μl加入MTS試劑,再繼續培養4 h,以酶標儀在490nm波長處測每孔的光密度值(OD490),細胞活力以公式[(轉染的CA46細胞的OD490)/(未經處理的CA46細胞的 OD490)×100],以未經處理的 CA46細胞的OD490值為標準。
1.2.4 統計學方法 運用SPSS統計學軟件進行統計學分析。
2 結果
2.1 免疫球蛋白啟動子/增強子在不同細胞中的活性 轉染后48 h,在產生及分泌IgM免疫球蛋白及表面IgMκ輕鏈的CA46細胞中,可檢測出較高水平的β半乳糖苷酶活性,相反,在非產免疫球蛋白的K562及SP2細胞中,難以檢測出β半乳糖苷酶活性。而pcDNA3LacZ轉染的3種細胞中均檢測出較高的β半乳糖苷酶活性(表1)。
2.2 β半乳糖苷酶基因的表達抑制 在CA46細胞中將質粒pcDNA3IgκDTA或pcDNA3IgHDTA與β-半乳糖苷酶基因共轉染后進行β半乳糖苷酶活性檢測。pcDNA3IgκDTA在CA46細胞中導致約80%的β半乳糖苷酶表達抑制,pcDNA3IgHDTA在CA46細胞中只導致約65%的β半乳糖苷酶表達抑制,表明在CA46細胞中質粒pcDNA3IgκDTA較pcDNA3IgHDTA能表達更高的 DT-A水平(表2),這說明免疫球蛋白κ輕鏈啟動子/增強子較免疫球蛋白重鏈啟動子/增強子有更強的啟動轉錄活性。
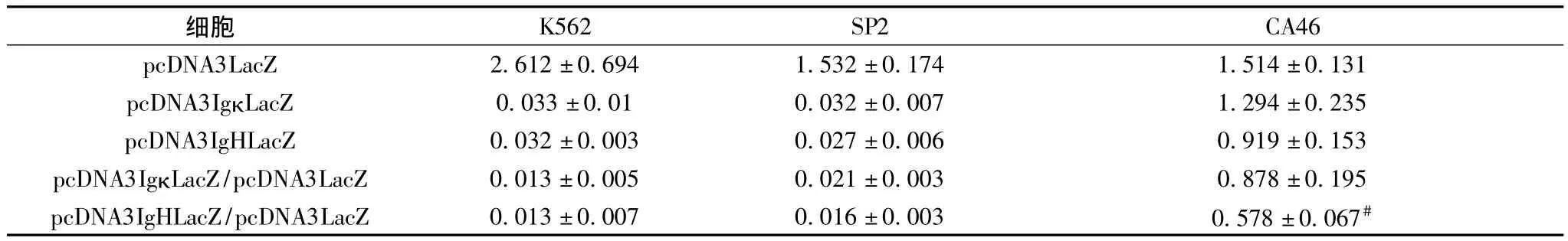
表1 pcDNA3IgκLacZ及pcDNA3IgHLacZ在不同真核細胞中的表達(10-8 u/細胞)
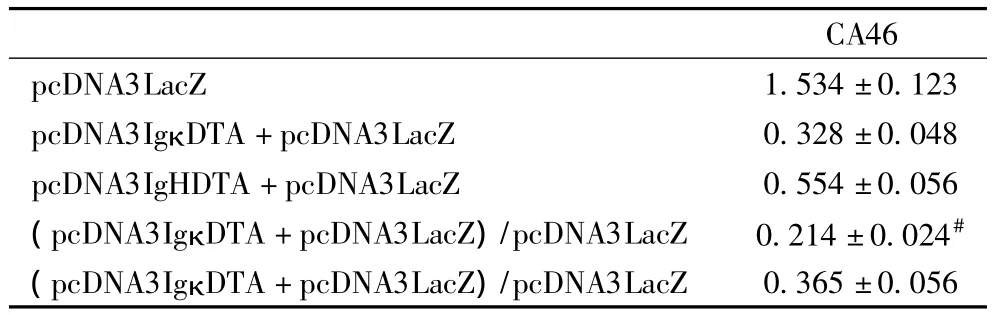
表2 β半乳糖苷酶基因的表達抑制(10-8 u/細胞)
2.3 DT-A對細胞生長的抑制 在轉染質粒pcDNA3IgκDTA或pcDNA3IgHDTA第1、3、5、7天進行了細胞計數及細胞活力測定。如圖1所示,pcDNA3IgκDTA和pcDNA3IgHDTA的轉染導致 CA46細胞明顯的生長抑制,與 pcDNA3IgκLacZ和pcDNA3IgHLacZ轉染的CA46細胞相比有明顯的差異(P<0.05)。細胞抑制在轉染后第5天最明顯,大約25%的細胞在轉染后死亡。同樣,MTS法檢測細胞活力表明,pcDNA3IgκDTA和pcDNA3IgHDTA轉染的CA46細胞活力明顯下降,pcDNA3IgκLacZ和 pcDNA3IgHLacZ轉染的 CA46細胞活力未見明顯變化(圖 2)。圖 1和圖 2均表明,與 pcDNA3IgHDTA相比,pcDNA3IgκDTA能更加明顯抑制 CA46細胞的生長。
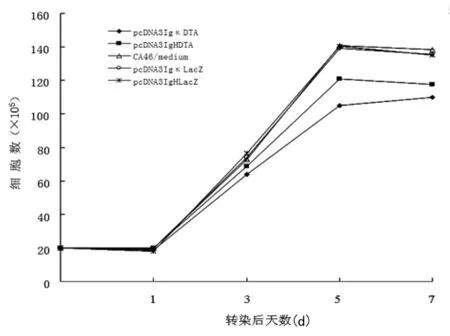
圖1 不同啟動子控制的DTA基因對CA46細胞的抑制作用
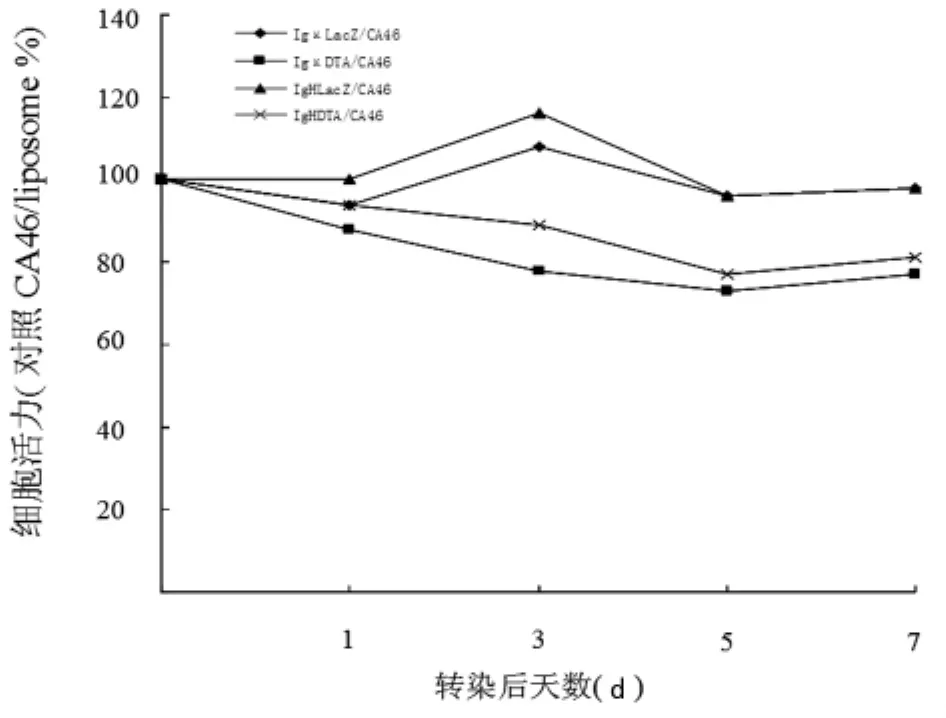
圖2 pcDNA3IgκDTA及pcDNA3IgHDTA對CA46細胞活力的影響
3 討論
基因的組織細胞特異性表達及外源基因進入靶細胞的轉運系統的高效性是決定基因治療療效的兩個重要因素。本研究表明,由免疫球蛋白κ輕鏈(或重鏈)啟動子/增強子調控的細菌β半乳糖苷酶基因能在產免疫球蛋白的細胞中特異性地表達,而難以在其他非產免疫球蛋白的細胞中檢測出其活性。另外,免疫球蛋白κ輕鏈(或重鏈)啟動子/增強子調控的DT-A基因與β半乳糖苷酶基因共同轉染至產免疫球蛋白的CA46細胞中時,DT-A基因的表達能明顯抑制β半乳糖苷酶的表達活性。進一步的結果表明,由免疫球蛋白κ輕鏈(或重鏈)啟動子/增強子調控的DT-A基因能特異性地作用于產免疫球蛋白的惡性淋巴瘤細胞,導致CA46細胞明顯的生長抑制;并且發現,免疫球蛋白κ輕鏈啟動子/增強子較免疫球蛋白重鏈啟動子/增強子有更強的啟動轉錄活性,由免疫球蛋白κ輕鏈啟動子/增強子控制的基因能更有效的表達。SP2細胞雖然為骨髓瘤細胞,但因其不生產也不分泌免疫球蛋白,這樣免疫球蛋白κ輕鏈(或重鏈)啟動子/增強子在這種細胞中也無活性。實事上,由組織細胞特異性啟動子調控的DT-A基因已經在許多惡性腫瘤細胞的治療實驗中取得了滿意的效果[7-10]。
目前,雖然對于用何種基因治療的方法能最有效地清除腫瘤細胞尚無定論,但有一點很明確,即能直接清除腫瘤細胞的方法是最好的。腫瘤細胞自我更新的特性也說明,對腫瘤的治療應是盡可能地殺滅腫瘤細胞而不只是生物學上的修飾[11]。因此,在基因治療中最常用的目的基因是那些能直接殺死細胞的基因如腫瘤自殺基因及細菌毒素基因等。我們的研究表明由免疫球蛋白κ輕鏈(或重鏈)啟動子/增強子控制的DT-A基因在體外有高度細胞特異性的外源性自殺基因特性。雖然免疫球蛋白κ輕鏈(或重鏈)同樣在正常B細胞中也有表達,但在腫瘤治療過程中如能正確區分正常與異常B細胞,那么由免疫球蛋白κ輕鏈(或重鏈)啟動子/增強子調控的DT-A基因就可能用于B淋巴系惡性腫瘤的靶向治療。當然,研究由惡性腫瘤細胞特異性順式調控序列控制的DT-A真核表達載體則可能達到真正意義上的惡性腫瘤靶向基因治療[7,10,12]。
許多實驗表明DT-A基因可能用于惡性腫瘤的治療,但限制這種應用的主要障礙之一在于當前轉運外源基因手段的低效率,這種低效率的轉染方法不能在體內將目的基因導入所有的腫瘤細胞。在本實驗中,使用了脂質體介導DT-A基因的轉染,脂質體雖然具有能攜帶大片斷DNA、無免疫原性、相對病毒載體安全性好、能大批生產等優點[13],但其轉染真核細胞的效率較低而不能阻止所有腫瘤細胞生長,因為在本實驗中只有約25%的細胞被抑制。所以,在脂質體用于體內治療之前其轉染效率應有較大程度的提高。另外,如將組織細胞特異性順式調控序列控制的DT-A基因與復制缺陷型腺病毒或逆轉錄病毒相結合,利用外源基因能在病毒基因組中忠實表達的特點,可能發展出一種高效體內基因轉運方法,更有利于DT-A基因的靶向治療。
[1]Maxwell IH,Maxwell F,Glode LM.Regulated expression of a diphtheria toxin A-chain gene transfected into human cells:possible strategy for inducing cancer cell suicide.Cancer Res,1986,46(9):4660-4664.
[2]Yoshihiko Murayama,Takushi Tadakuma,Michito Kumitomi,et al.Cell-specific expression of the diphtheria toxin A-chain coding sequence under the control of the upstream region of the human alpha-fetoptrotein gene.Journal of Surgical Oncology,1999,70(3):145-149.
[3]Palmiter RD,Behringer RR,Quaife CJ,et al.Cell lineage ablation in transgeinc mice by cell-specific expression of a toxin gene.Cell,1987,50(3):435-443.
[4]Breitmanml,Clapoff S,Rossant J,et al.Genetic ablation:programmed lineage suicide by tissue-specific expression of the diphtheria toxin A gene in transgenic mice.Science,1987,238(4833):1563-1565.
[5]Maxwell IH,Glode M,Maxwell F.Expression of the diphtheria toxin A-chain coding sequence under the control of promoters and enhancers from immunoglobulin genes as a means of directing toxicity to B-lymphoid cells.Cancer Res,1991,51(16):4299-4304.
[6]Sambrook J,Fritsch EF,Maniatis T.Molecular Cloning:A Laboratory Manual. Cold Spring Harbor Laboratory Press,1989:804-809.
[7]Shen Pang.Targeting and eradicating cancer cells by a prostate-specific vector carrying the diphtheria toxin A gene.Cancer Gene Therapy,2000:7(7):991-996.
[8]Mizrahi A,Czerniak A,Levy T,et al.Development of targetedtherapyfor ovarian cancer mediated by a plasmid expressingdiphtheria toxinunder the control of H19 regulatory sequences.J Transl Med,2009,7(6):69.
[9]Smaldone MC,Davies BJ.BC-819,a plasmid comprising the H19 generegulatory sequences anddiphtheria toxinA,for the potential targetedtherapyof cancers.Curr Opin Mol Ther,2010,12(5):607-616.
[10]Amit D,Tamir S,Birman T,et al.Development of targetedtherapyfor bladder cancer mediated by a double promoter plasmid expressingdiphtheria toxinunder the control of IGF2-P3 and IGF2-P4 regulatory sequences.Int J Clin Exp Med,2011,4(2):91-102.
[11]Vile RG,Russell SJ,Lemoine NR.Cancer gene therapy:hard les-sons and new courses.Gene therapy,2000,7(1):2-8.
[12]Massuda ES,Dunphy EJ,Redman RA,et al.Regulated expression of the diphtheria toxin A chain by a tumor-specific chimeric transcription factor results in selective toxicity for alveolar rhabdomyosarcoma cells.Proc Natl Acad Sci USA,1997,94(26):14701-14706.
[13]Kamimura K,Suda T,Zhang G,et al.Advances inGeneDelivery Systems.Pharmaceut Med,2011,25(5):293-306.

