麝香保心丸促進斑馬魚血管生成作用
李惠玲
斑馬魚(Danio reio,舊稱Brachydanio reirio),俗稱“zebra fish”或者“zebrafish”,屬硬骨魚類,輻鰭綱(Actinopterygii),鯉形目(Cypriniformes),鯉科(Cyprinidae)短擔尼魚屬(Danio)。原產印度,是一種性情溫和、雜食性的淡水魚[1]。斑馬魚約有10余個品系,目前研究中常用的有源于德國的Tübingen和源于美國的AB兩個品系。斑馬魚體呈梭型,個體長約5 cm左右,喂養簡單,經濟成本低,容易大規模飼養。斑馬魚生長周期短,3個月就可以性成熟。雌魚每周個產卵一次,每次幾百枚不等。斑馬魚的胚胎發育在體外完成,并且透明可見,胚胎時期血管走向清晰,結構簡單,這使得研究者能從完整的活體觀察到心血管系統發育情況和血液循環,甚至可以觀察到基因的轉錄和蛋白表達情況,避免了殺死或解剖動物,非常適合用于血管發生的研究。
血管新生是促進腫瘤生長和進展的因素之一,同時也是治療缺血性疾病的關鍵。然而影響血管新生的因素有很多,包括血管內皮生長因子(vascular endothelial growth factor,VEGF)及其受體家族(VEGF receptor)、血管生成素及其受體Tic家族和重組堿性成纖維細胞生長因子(basic fibroblast grouth factor,bFGF)對血管的新生和發育起著相當重要的作用。然而,現在對促血管生成的中藥研究和應用還比較少。麝香保心丸是中藥治療冠心病的代表藥之一,臨床實踐和藥理研究證明麝香保心丸有顯著的抗心肌缺血作用[2],但對其在缺血心臟冠脈側枝血管生成方面的作用機制尚未清楚,本實驗通過觀察麝香保心丸對斑馬魚模型血管新生影響,探討麝香保心丸促血管生成的效應,為進一步研究其在改善缺血心臟側枝循環方面的作用提供依據。
1 材料與方法
1.1 斑馬魚胚胎的準備 實驗斑馬魚為AB系普通斑馬魚和血管熒光轉基因斑馬魚(Flk-1),取自美國哈佛大學醫學院。根據Westerfield[3]的方法進行養殖和繁殖,雌雄分開喂養于(28.5±1)℃的環境中,使用自動計時器保持14 h光照/10 h黑暗交替循環,每日分三次定時喂以豐年蝦(brine shrimp)。養魚系統中使用日夜循環水,每天補充10%新鮮去離子水。
參照斑馬魚手冊[4]闡述的方法,將健康成熟的斑馬魚按雌雄1/2的比例放入交配魚缸中,次日搜集雄魚雌魚交配產下的受精胚胎。每次試驗設置4~5對斑馬魚交配,平均每對魚能夠產下100~150個受精胚胎,斑馬魚胚胎培養在胚胎水中(0.2 g/L的即溶海鹽水溶液),放于28.5℃的孵箱中培養。培養大約20 h(21個體節階段)后挑出健康的胚胎,用1 mg/ml的蛋白酶(Sigma,p5459)水解去卵膜,再放入胚胎水中浸泡洗滌5 min。將胚胎隨機分組后培養到96孔板中,每組設6個副孔,每孔放3個,每孔加入200 μL胚胎水。因為斑馬魚胚胎可以從卵黃球里汲取營養,所以在整個實驗過程都不要給予營養補充。
1.2 藥物的配制和加入 取1 g麝香保心丸(購于上海和黃藥業有限公司)溶于20 ml蒸餾水中(50 g/L),37℃攪拌成混懸液,再分別胚胎水稀釋成25 g/L,12.5 g/L,和6.25 g/L,離心后取上清,用0.22 μm的濾頭過濾滅菌。bFGF購于武漢人禾醫藥有限公司,用0.22 μm微孔濾膜過濾載體,高溫蒸汽滅菌后待用。選擇受精20 h(hours post fertilization,h pf)的斑馬魚胚胎,將不同濃度的麝香保心丸按組別加入到斑馬魚的培養基中,每孔 20 μL,陽性對照組每孔加入 50 μL bFGF,陰性對照組每孔加入20 μL 0.9%的生理鹽水。然后將斑馬魚胚胎置于28.5℃的孵箱中繼續培養48 h.
1.3 結果觀察和處理 斑馬魚胚胎發育到72 h pf時,吸出培養基,加入200 μL 4%的多聚甲醛PBS(pH=7.4)溶液,室溫靜置10 min后將斑馬魚置于凹槽載玻片里,在體系顯微鏡(Nikon AZ100)下觀察拍照。為了使斑馬魚側躺在載玻片里,方便觀察腸下血管網絡,盡量吸干載玻片上的固定液。因為斑馬魚的卵黃球是一個充滿液體的圓形結構,不同局部對光的反射程度不一樣,所以在觀察過程在卵黃球里的血管網會出現部分不清晰的情況,為了能夠全面地觀察和拍攝到腸清晰的下血管網絡,可以從斑馬魚與載玻片接觸的這一面進行觀察和拍照,由于卵黃球受到載玻片的擠壓,呈扁平狀,有利于觀察拍照。
選擇20×20倍數對斑馬魚腸下血管進行拍照,使用NIH Image圖像處理軟件 (由美國國家衛生研究院(US National Institutes of Health)研發,http://rsb.info.nih.gov/nih-image/)對血管長度進行定量計算;使用Image-pro-plus 6.0對血管面積進行定量分析。通過使用這兩款軟件的點對點計算方法,可以實現血管總長度計算、血管網的延伸長度計算以及血管面積計算[5]。
2 結果
麝香保心丸組對雞胚血管生成有明顯促進作用。如圖1所示,在顯微鏡下可觀察到實驗組(圖1.B,D)比空白對照組(圖1.C)和陽性對照組(圖1.A)的血管明顯增多,分支增多,血管面積和直徑增大。實驗組和陽性對照組均可見釘凸樣血管新生現象(圖1.A,B的箭頭處)空白組的血管保持正常生長,整體分布均勻。陽性對照組的血管面積較實驗組大,但比陰性對照組要小。對血管面積和血管整體長度進行計算后作圖實驗組與陰性對照組比較差異有統計學意義(**WTBX?P<0.01,*P<0.05),其中麝香保心丸50 g/L組整體血管長度為1132.70 μm,血管面積為16089.50像素;陽性對照組血管長度為869.02 μm,血管面積為12164.5像素。見圖2。
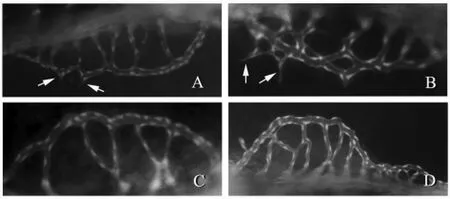
圖1 麝香保心丸對斑馬魚腸下血管新生的影響
將藥物加入到斑馬魚胚胎培養基中,72 h pf時期觀察拍照,與對照組(A和C)相比,實驗組(B和D)表現出了明顯的血管新生作用,分支明顯增多(B),血管整體面積增大(D),有釘凸樣生成(箭頭處)。
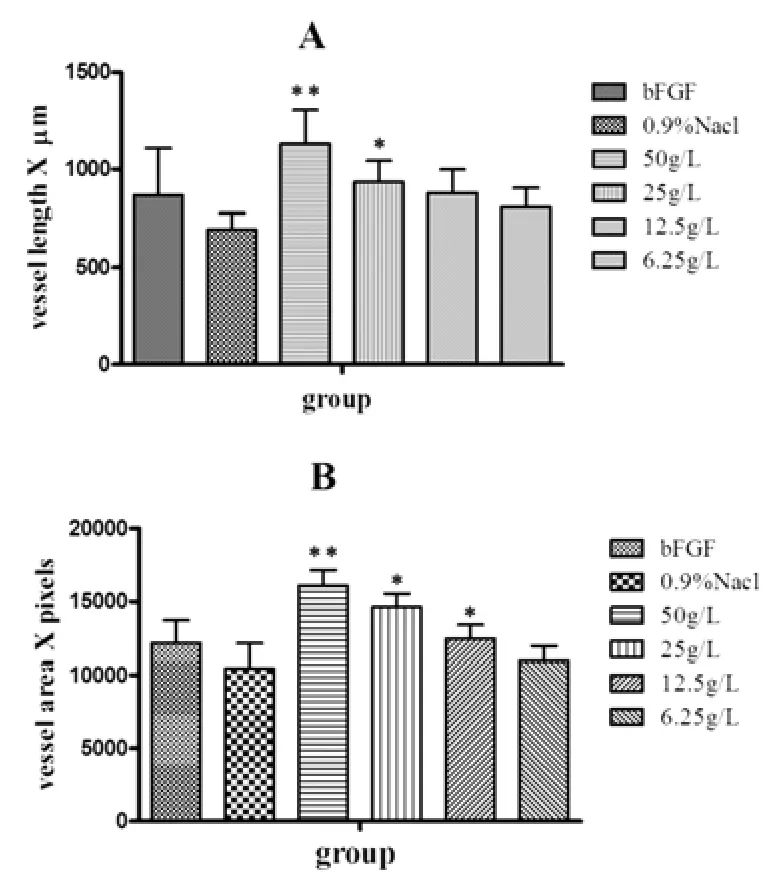
圖2 麝香保心丸對斑馬魚腸下血管整體長度和面積的影響
將藥物加入到斑馬魚胚胎培養基中,72 h pf時期觀察拍照,使用NIH image軟件對血管長度進行點對點計算(A),使用image-pro plus對血管面積進行定量分析(B)。
實驗組與陽性對照組相比較,**P<0.01,*P<0.05。
3 討論
最近20年,由于腫瘤疾病和缺血性疾病患者的死亡率在不斷升高,對血管新生機制的研究成為了熱點,催生了很多用于血管新生研究的動物模型,包括常用的SD大鼠、雞胚絨毛尿囊膜和斑馬魚。由于斑馬魚和人類在血管發育過程中的基因、信號通路有高度同源性,結構、生理、分子水平等方面也都很接近。而且與大鼠、雞胚動物模型相比,斑馬魚具有成本低、飼養條件要求低、個體小適合高通量化學篩選、幼魚身體透明易于觀察血管發育的特點,所以我們選擇斑馬魚作為血管新生的動物模型。
斑馬魚發育到15個體節時,側板中胚層的成血管細胞遷移到中線聚集形成軸向血管(axial vessels,AV)、背動脈(dorsal aorta,DA)和后主靜脈(posterior cardinal vein,PCV)。24 h pf心臟開始跳動,動靜脈相互融合形成一個單一的閉合循環回路,血液越過卵黃囊通過居維葉管(ducts of cuvier,DC)開始循環,即血液循環開始[6]。斑馬魚胚胎發育到72 h pf時,功能性血管開始形成,包括主干血管(major trunk vessels)和新生血管,比如腸下血管網(subintestinal vessels,SIVs)。血管的發育包括兩過主要過程,一個是血管發生(vasculogenesis),第一個過程是血管充無到有的一個過程;第二個是血管生成,也稱血管新生(angiogenesis),這是從原有血管上新生出毛細血管的過程,在這個過程部分成血管血液祖細胞會特化成成血管細胞[7]。常常在血管發生的階段完成的時候進行血管新生的干預,在20 h pf這個時期,主干血管已經形成,新生血管還未出現,第21個體節還未發育,斑馬魚胚胎還未能活動,這一個發育階段和外觀形態通常作為干預時刻的標準。所以我們選擇在20 h pf對斑馬魚的血管新生進行干預,
對血管新生的干預方法有很多,根據藥物的不同性質和作用途徑來選擇。常用的方法主要有:①利用顯微注射技術,將藥物注射到卵黃球(yolk ball)或者卵黃和周皮(periderm)之間,又稱卵周間隙(perivitelline space)。通常藥物的劑量選擇在1~5 μL之間。②直接加入到斑馬魚胚胎的培養基中。該方法直接將干預藥物加入斑馬魚的培養容器中,或者使用斑馬魚胚胎培養基來稀釋藥物,然后加入到斑馬魚的容器中與斑馬魚共培養。這種方法簡單易行,定量準確,對斑馬魚胚胎損傷較小,基于此,我們選擇直接將麝香保心丸加入到斑馬魚胚胎的培養基中。
為了能夠獲得較為清晰的腸下血管照片,要求斑馬魚在拍照過程中能夠固定不動,然而對斑馬魚的固定方法有很多種,其中Leclair等[8]將2%的凝膠溶解后,放到37℃水浴鍋中保持液體狀態,然后用該液態凝膠將斑馬魚固定在某個透明的小槽里面,可以避免斑馬魚在載玻片里游動。很多研究里使用了Zamboni固定液(40 g多聚甲醛溶解在1000 ml含500 ml 0.02 M PBS和150 ml飽和苦味酸水溶液的蒸餾水中)[9,10]。使用Zamboni固定液時,通常需要提前 24 h 加入固定液,即是在72 h pf時加入,24 h后再對斑馬魚進行觀察和拍照。由于使用低熔點瓊脂糖會增加較多的工作量,使用Zamboni固定液需要的時間較長,而單純使用4%的多聚甲醛PBS(pH=7.4)溶液做固定液時,只需要提前6~10 min進行固定,較為方便[11]。因此我們選擇多聚甲醛作為斑馬魚的固定液。
斑馬魚的血管新生的形態學特征主要從腸下血管網去判斷,腸下血管一般呈籃子(basket)形狀,從體節的腹部邊緣往卵黃方向延伸,一般長50~100 μm,斑馬魚的血管新生主要從以下四個方面去定義[5]:①腸下血管網長度超過150 μm。②血管網的整體面積增大。③腸下血管的直徑增大。④血管籃子底部有倒釘突樣血管生成(圖1 A,B箭頭處)。其中每一個新生特征都可以使用NIH Image和Image-pro-plus圖像處理軟件進行定量分析[12-15]。
麝香保心丸是治療冠心病的代表性中藥之一,具有較明顯的促血管生成活性,汪姍姍等[16]將麝香保心丸用于體內能促進CAM血管生成的研究和在體外微血管內皮細胞(microvascularendothelialcells)的增殖研究,麝香保心丸明顯地促進CAM血管的生成,并且在體外能夠促進微血管內皮細胞的增值并形成管腔結構。麝香保心丸也曾用于犬、大鼠和家兔的心梗治療研究,實驗結果表明麝香保心丸縮小了實驗動物的心肌梗死范圍,改善了由心肌缺血引起的心梗癥狀[17]。麝香保心丸促血管生成的機理可能與其促進內皮細胞表達bFGF和VEGF mRNA并釋放bFGF和GFP有關。這一結果是對其以往藥理研究成果的重要補充,為它用于冠心病的治療提供了有利依據[16]。從我們的實驗結果也可以看出,麝香保心丸在斑馬魚模型中表現出了明顯的促血管生成作用,并且促進作用與藥物的濃度有關。從實驗結果看出,斑馬魚腸下血管的分支增多,釘突樣血管明顯,這能夠說明麝香保心丸增加了斑馬魚腸下血管的側枝循環,但是這個離我們的臨床應用還有很大距離,為了闡明麝香保心丸在動物心梗模型中的作用機理,我們計劃做心梗模型實驗和臨床研究做進一步的機理探討。
總之,在本實驗研究中,我們使用斑馬魚模型初步證實了麝香保心丸有明顯的促血管生成作用。從另一個層面闡明了麝香保心丸作為一種冠心病治療藥物具有較高的臨床應用價值。
[1] Kimmel CB.Genetics and early development of zebrafish.Trends Genet,1989,5(8):283-88.
[2] 戴瑞鴻.麝香保心丸的作用機制研究進展與臨床評價.中國醫院用藥評價與分析,2006,6(1):15-16.
[3] Westerfield M.The zebrafish book:a guide for the laboratory use of zebrafish(Danio rerio).[Eugene,OR]:M.Westerfield,1995.
[4] Westerfield M.The zebrafish book:a guide for the laboratory use of zebrafish(Brachydanio rerio).[Eugene,OR]:M.Westerfield,1993:1.
[5] Serbedzija GN,Flynn E,Willett CE.Zebrafish angiogenesis:a new model for drug screening.Angiogenesis,1999,3(4):353-59.
[6] Torres-Vazquez J,Kamei M,Weinstein BM.Molecular distinction between arteries and veins.Cell Tissue Res,2003,314(1):43-59.
[7] 楊婧,王志堅.斑馬魚胚胎早期血管系統的形成.生命的化學,2009(2):268-71.
[8] Leclair EE,Topczewski J.Methods for the study of the zebrafish maxillary barbel.J Vis Exp,2009(33).
[9] Holmberg A,Olsson C,Holmgren S.The effects of endogenous and exogenous nitric oxide on gut motility in zebrafish Danio rerio embryos and larvae.J Exp Biol,2006,209(Pt 13):2472-79.
[10] Olsson C,Holbrook JD,Bompadre Get al.Identification of genes for the ghrelin and motilin receptors and a novel related gene in fish,and stimulation of intestinal motility in zebrafish(Danio rerio)by ghrelin and motilin.Gen Comp Endocrinol,2008,155(1):217-26.
[11] Zhang L,Gao X,Wen Jet al.Dapper 1 antagonizes Wnt signaling by promoting dishevelled degradation.J Biol Chem,2006,281(13):8607-12.
[12] Doughty MJ.On the use of NIH image J for objective assessment of conjunctival cell and nucleus dimensions of impression cytology samples.Eye Contact Lens,2011,37(2):50-56.
[13] Girish V,Vijayalakshmi A.Affordable image analysis using NIH Image/ImageJ.Indian J Cancer,2004,41(1):47.
[14] Nakamura Y,Endo C,Sato Met al.A new technique for endobronchial ultrasonography and comparison of two ultrasonic probes:analysis with a plot profile of the image analysis software NIH Image.Chest,2004,126(1):192-97.
[15] Blatt RJ,Clark AN,Courtney Jet al.Automated quantitative analysis of angiogenesis in the rat aorta model using Image-Pro Plus 4.1.Comput Methods Programs Biomed,2004,75(1):75-79.
[16] 汪姍姍,李勇,等.麝香保心丸對雞胚絨毛尿囊膜及培養的血管內皮細胞的促血管生成作用.中國中西醫結合雜志,2003,23(2):128-31.
[17] 于榕,盛美萍,等.麝香保心丸對家兔急性心肌梗死的影響.中國新藥與臨床雜志,2001,20(1):1-03.

