布魯氏菌減毒活疫苗株的比較基因組學研究*
鐘志軍,徐 杰,于 爽,王玉飛,周冬生,喬 鳳,曲 勍,汪舟佳,杜昕穎,陳燕芬,黃克和,馬曉平,陳澤良,彭廣能
布魯氏菌病(Brucellosis,簡稱布病)是一種危害嚴重的人獸共患傳染病,在我國被列為法定報告的疾病之一。布魯氏菌是布病的病原體,能感染包括人在內的多種動物,動物感染后主要表現為流產或不育,而人感染后主要表現為波浪熱,嚴重者喪失勞動力。布魯氏菌疫苗的研究和應用,對于人類和動物布病的預防和最終消滅布病具有重要作用。
布魯氏菌減毒活疫苗是通過毒力變異、人工選擇或從自然界直接篩選而獲得的減毒或無毒菌株。由于減毒活疫苗菌株能在宿主體內短暫生長和增殖,延長了免疫系統對抗原識別時間,有利于提高免疫能力和記憶型免疫細胞生成,所以減毒活疫苗疫苗具有免疫效果好,免疫力持久等優點[1]。由于減毒活疫苗致弱的遺傳基礎不清楚,對減毒活疫苗安全性沒有一個科學的評價,因此減毒活疫苗也有毒力回復的潛在危險。因此,了解減毒活疫苗菌株DNA水平上的變化,將有助于了解其致弱機理和評價其毒力特性。當前國際上廣泛用于動物布魯氏菌病預防的減毒活疫苗包括S19、RB51和 Rev.1[2]。在我國,除了國際上通用的疫苗株S19外,廣泛使用的疫苗株還包括104M、M5和S2,其中S19、M5和S2分別用于預防牛、羊和豬的布魯氏菌病的預防,而104M被廣泛用于人群布病預防[3]。本研究將布魯氏菌全基因組芯片應用于減毒活疫苗株比較基因組分析,鑒定疫苗株中缺失的基因,獲得它們的基因缺失譜,了解減毒活疫苗基因構成,從而為了解減毒活疫苗株的致弱機理以及改造布魯氏菌減毒活疫苗株和研發新的減毒活疫苗奠定基礎。
1 材料與方法
1.1 試驗菌株和試劑 4株減毒活疫苗株(104M,M5,S19和S2)為本室保存。大豆胰蛋白胨瓊脂(TSA)和大豆胰蛋白胨肉湯(TSB)購自生物梅里埃公司,用于培養布魯氏菌。
1.2 試驗菌株DNA提取 采用Promega的Wizard?Genomic DNA Purification Kit進行提取。操作嚴格按照試劑盒說明進行。用紫外分光光度計(Beckman DU 600)測定獲得的基因組DNA吸光度值,確定DNA濃度,-20℃保存備用。
1.3 比較基因組雜交和芯片數據分析 布魯氏菌全基因組DNA芯片由本室構建,芯片雜交和數據分析參考文獻進行[4]。
1.4 基因缺失和拷貝增多鑒定 首先將芯片中各樣點信號比值(待測DNA歸一化強度/參照DNA歸一化強度)轉換成log2值后,以-1為Cutoff值鑒定基因缺失,即如果某個基因熒光比值小于-1,那么該基因在相應菌株基因組中缺失。以0.65為Cutoff值鑒定基因拷貝數增多事件,即如果某個基因熒光比值大于0.65,那么該基因在相應菌株基因組中拷貝數增多。確定Cutoff值依據來源于16M菌DNA+參照DNA、544A菌DNA+參照DNA、參照DNA+參照DNA的芯片雜交結果。與16M菌相比,牛型544A菌的基因組中多出了2個染色體基因組簇(BruAb1_0609-BruAb1_0613和BruAb2_0590-BruAb2_0596)。在芯片雜交過程中,參照DNA是16M菌和牛544A菌基因組DNA的等量混合物。因此這2個染色體基因組簇,在牛型544A菌DNA中含量是參照DNA的兩倍,這恰恰就是基因拷貝數增多的依據。我們根據2個染色體基因組簇在上述三種雜交組合中的熒光信號比值,確定了0.65作為鑒定基因拷貝增多的Cutoff值。最終根據芯片雜交結果,鑒定各個菌株中出現的基因缺失和基因拷貝數增多的分子事件。
1.5 芯片結果PCR驗證 針對芯片中顯示缺失的基因,利用芯片研制過程中每個基因的特異性引物進行PCR擴增,驗證芯片中顯示缺失的基因是否真實。缺失基因中單個基因缺失,采用單個基因引物驗證,缺失片段驗證則在片段中挑出2個具代表性的基因進行驗證(具體基因略)。PCR反應體系為25μL,PCR體系如下:50mmol/L 的 KCl,10 mmol/L 的 Tris-HCl(pH 8.0),2.5mmol/L MgCl2,0.001%明膠,0.1%BSA,150μmol/L dATP、dCTP、dGTP、dTTP,0.6μmol/L引物,1U Taq DNA聚合酶 (MBI Fermentas)和10ng模板DNA。PCR反應于96孔板中進行,DNA熱循環儀運行參數:預變性95℃ 5min,94℃ 1min、58℃1min、72℃ 1.5min共30個循環,最后72℃10 min。然后取10μL PCR產物進行1%瓊脂糖膠電泳檢測,判定芯片中顯示缺失基因的真實性。
1.6 缺失基因功能分析 調用布魯氏菌基因庫中基因的功能信息,將缺失基因功能根據COG進行分 類 (http://www.phidias.us/bbp/data/index.php),分析這些差異基因的功能信息。
2 結 果
2.1 菌株104M差異基因分析 我們利用研制的布魯氏菌全基因組DNA芯片對104M進行了雜交分析。結果表明,104M菌株中共缺失27個基因,主要包括 BMEI1661-1662,BMEII0717,BMEII0827-0849,BMEII1016。這些缺失的基因和在牛種發現的缺失基本一致,表明和其親本株在基因組構成上基本一致。同時我們也對該菌株中多拷貝基因的情況進行了分析,多拷貝的基因主要包括BruAb1_0610-0612,BruAb1_1831-1832,BruAb2_0591-596等。
2.2 疫苗株M5差異基因分析芯片結果顯示,僅有6個基因在M5菌株中發生了缺失,它們是BruAb2_0595,BruAb1_0414,BruAb2_068,BruAb2_0326和BMEI1661-1662。鑒定到的多拷貝基因主要包括 BMEI0926-929,BMEII0717,BMEII0827-849,BMEII1016,BruAb1_0609-613,BruAb1_1831-1832,BruAb2_0593-596等大片段,提示疫苗株在選育過程中,很多基因發生了多拷貝變化。

表1 COG分類原則代碼表Tab.1 Information of COG codes
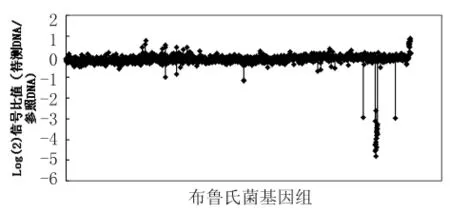
圖1 疫苗株104M菌株雜交的信號比值Fig.1 The hybridization signal with reference and vaccine 104MDNA samples
2.3 疫苗株S2差異基因分析芯片結果表明,S2菌株中缺失基因共21個,分別為BMEI0801,BMEI0900,BMEI1128,BMEI1661-1662,BMEI1674-1667和BMEI1686-1702。這些缺失基因中,有部分同犬種菌中缺失基因一致,說明其與犬種菌在基因組構成上有一定相似性。多拷貝基因主要包括BMEI0929, BMEII0717, BMEII0827-849,BMEII1016,BruAb1_0609-613,BruAb1_1831-1832,BruAb2_0593-596。
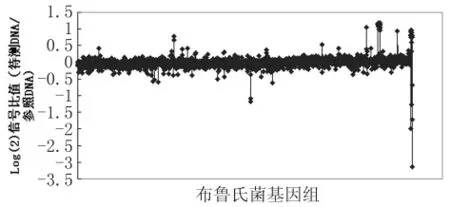
圖2 疫苗株M5菌株雜交的信號比值Fig.2 The hybridization signal with reference and vaccine M5DNA samples
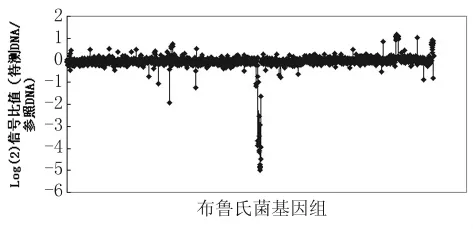
圖3 疫苗株S2菌株雜交信號比值Fig.3 The hybridization signal with reference and vaccine S2 DNA samples
2.4 疫苗株S19差異基因分析 S19菌株中鑒定到的缺失基因共有33個,它們主要包括BMEI0762,BMEI0926,BMEI0929,BMEI1128,BMEI1661-1662,BMEI1934-1935, BMEII0717,BMEII0827-0849,BMEII1016。鑒定到的一些多拷貝的基因包括 BruAb1_0609-613,BruAb1_1831-1832,BruAb2_0593-596等。
2.5 芯片結果PCR驗證 為了減少芯片結果中的假陽性,保證芯片結果中相應缺失基因真實可靠,我們采用PCR進行缺失基因驗證。如圖5所示,對這些缺失基因的驗證過程中,我們發現部分缺失基因在相應菌株中并沒有缺失。4株疫苗株中共發現有4個基因在芯片中顯示為缺失,但PCR驗證卻沒有發現缺失。說明芯片結果中存在部分假陽性,因此對缺失基因的驗證是必要的步驟。
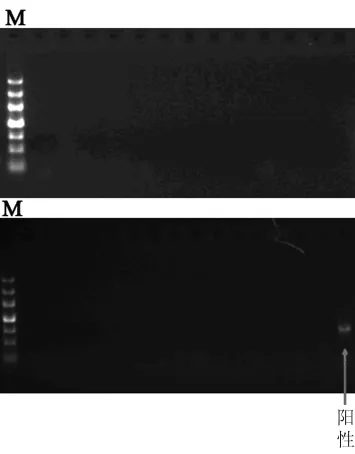
圖5 PCR驗證相應疫苗菌株中缺失基因擴增圖Fig.5 Verification on results of deletion genes in the vaccine strains by PCR
2.6 疫苗株缺失基因數目分布情況分析 芯片結果進行PCR驗證后,我們分析了4株疫苗菌株中缺失基因的數目。結果發現S19缺失的基因數目最多,其次是104M和S2,而 M5中缺失基因數目最少。
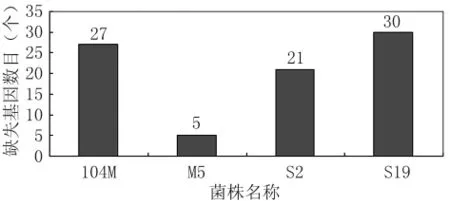
圖6 4株疫苗菌株中缺失基因數目分布Fig.6 Total number of deletion genes for each of these four vaccine strains
2.7 缺失基因功能分類 我們根據COG分類原則,對芯片結果中顯示為缺失的基因進行了更細致的歸類,深入分析這些缺失基因。
如圖7所示,4株減毒活疫苗株缺失基因功能主要為胞內活動有關基因和功能未知基因(分別為31和45個)。其中104株減毒活疫苗株的缺失基因功能主要分布在胞內活動有關的基因和功能未知基因中(分別為14和12個),而M5和S2減毒活疫苗株缺失基因主要是一些功能未知的基因(3個和15個)。S19減毒活疫苗株缺失的基因功能類型較其他3株的功能較復雜,胞內活動有關的基因有14個,代謝有關的基因有6個,功能未知基因有14個。

圖7 依據COG原則對4株減毒活疫苗株的缺失基因功能分類圖Fig.7 Function of the deletion genes in these four vaccine strains
3 討 論
目前我國國內主要應用的疫苗株包括104M、M5、S2以及S19。104M由前蘇聯分離,具典型牛種1型布魯氏菌特性,有一定殘余毒力。我國引進該菌種后進行了系統研究,證明對人群預防布病感染安全有效[5]。但本疫苗在多次接種后能使機體產生強烈過敏反應,表現為局部皮試敏感性增高及出現某些臨床癥狀,且隨接種次數的增加而增加,說明其作為人用疫苗仍存在風險。羊種布魯氏菌五號菌種(簡稱M5),由中國農業科學院哈爾濱獸醫研究所用羊種強毒株傳代培育出的弱毒疫苗。特點是免疫性好,殘余毒力低,被接種動物的血清凝集消失快。對非懷孕牛,羊,鹿注射均很安全,給泌乳牛接種,產奶量略有下降,給孕畜注射可引起部分流產,對非孕畜毒力穩定[6]。豬種布魯氏菌二號菌種(簡稱S2菌)由中國獸藥監察所選育,具有作用范圍廣和使用方便等特點,可作為皮下注射,肌肉注射或氣霧和口服等多種形式接種,但最適宜做口服免疫接種。S19由美國Buck自奶牛中分離[7]。剛分離時毒力很強,在實驗室保存多年后毒力自行變弱,成為一株毒力穩定的弱毒疫苗。S19菌苗對犢牛和綿羊是安全的,對山羊的反應較重,給乳牛注射后產奶量下降,一周左右恢復正常,給孕畜注射可引起流產。
在布魯氏菌減毒活疫苗研制過程中,一般采用在人工培養基中連續傳代,人工培養基提供的條件將大大緩解細菌在宿主體內面對的代謝壓力。根據細菌基因組簡約進化理論,對細菌生存非必須基因就可能在適應環境中丟失而造成基因缺失。到目前為止,我們對疫苗株致弱的分子機制還不清楚。目前研究相對較多的是S19疫苗株。S19是第一株測序的疫苗株[8]。通過比較S19株基因序列和野生毒株中的兩條染色體發現,只有45個ORF與毒株存在差異。這些差異包括了4個大于60bp的基因差異。我們的芯片雜交結果表明,S19疫苗株和16M相比,缺失了30個基因。這些缺失基因和牛種布魯氏菌中發現的缺失基因一致,說明S19疫苗株在基因構成上基本和親本株一致。已有研究通過突變和動物模型來鑒定這些差異基因,幫助解釋S19致弱的基因構成成因[9]。芯片結果中還發現疫苗株S19缺失2個獨特的 ORFs(BMEI1934-1935),這兩個基因在其他菌株中沒有缺失,說明這兩個基因有可能在疫苗株S19致弱中起關鍵作用,可以通過對野毒株缺失該基因進行進一步驗證。我們還發現了一些基因 (BruAb1_0609-613,BruAb1_1831-1832,BruAb2_0593-596)在S19中以多拷貝形式存在,這些缺失和多拷貝基因差異都可能是其致弱的原因。這些差異中包含了一個蛋白基因的缺失,這個基因的結構與小腸結腸炎耶爾森(氏)菌YadA和Hia毒力基因以及流感嗜血桿菌中缺失的eryC和eryD相似[10]。然而eryC和eryD在小鼠模型中發現并不是毒力必須基因[9]。除了這些差異外,我們還發現一些可能與減毒有關,包括脂質運輸,代謝,轉錄調節,傳遞蛋白,外膜蛋白和其他假想蛋白。通過突變和動物模型來鑒定這些差異基因能幫助解釋S19致弱的基因遺傳成因。同時其它活疫苗株基因組測序的完成,將有助于進一步分析疫苗株致弱的分子機制。此外,已有研究表明S2對豚鼠毒力比S19略高,比104M弱[11]。對試驗動物的毒力因動物種類而不同。對豚鼠和恒河猴毒力羊種強毒株比S2高。S2以500億活菌量給懷孕母豬皮下注射不引起流產,以大于常規50倍量給懷孕綿羊飲水也不引起流產,而且在分娩后不能從羊羔,胎盤,初乳和母羊體內實質臟器和淋巴結分離出S2菌。
本課題組除了對4株疫苗株進行了比較基因組學分析,還對19株標準菌株進行了分析。根據芯片雜交結果,鑒定出25個差異片段,其中有4個差異片段在4株減毒活疫苗株中缺失。4株減毒活疫苗株中共同缺失了 DFR06(BMEI1661-1662),這個區段可以作為分子靶標進行疫苗株和自然感染株的區分。104M和S19共同缺失了DFR19(BMEII0827-0849),而S19還缺失了 DFR10(BMEI1934-1935),S2缺失了DFR08(BMEI1674-1702)。同時S2還缺失了BMEI1128,這個基因在其他種中都沒有發現缺失。DFRs的缺失或獲得是自然選擇壓力下的分子進化事件,構成了布魯氏菌自然種群在自然疫源地中適應性演化的遺傳基礎。我們通過對4株疫苗株進行比較基因組分析時還發現有基因拷貝增多的情況。4株疫苗株在BruAb1_0609-BruAb1_0613,BruAb1_1831-1832,BruAb2_0591-0596等大片段以多拷貝形式存在于基因組中。而S2和M5中還發現BMEII0827-0849以多拷貝形式存在于基因組中,這個片段在豬種和羊種中也發現,說明這些多拷貝事件的發生可能是其功能改變的動因。此外,在分析這4株疫苗株缺失基因數量時,發現缺失基因數目的多少并不能反映其毒力差異,S2菌株對豚鼠毒力比S19略高,但卻比104M菌株弱,就很好地說明了這一觀點。另一方面,M5是通過人工連續傳代獲得。我們知道,通過體外連續傳代獲得的致弱菌株,主要通過點突變積累而發生致弱。因此可以推測M5疫苗株致弱機理主要由點突變引起,而點突變在芯片中并不能反映出來,所以芯片結果中發現M5中缺失基因數相對較少。
布魯氏菌活疫苗株的使用大大降低人間布病的發病率,但目前應用的幾株動物疫苗株仍存在副作用大和免疫原性不穩定等問題。即便是同一系列活菌苗,只要來源、保種和生產方法不同,在表型和使用效果上就存在很大差異。不同疫苗株基因組中鑒定了基因缺失和基因多拷貝的分子事件,揭示了不同來源的疫苗株在基因組組成上的差異,構成了不同疫苗株表型與使用效果具有差異性的遺傳基礎。基因組中大量功能基因的缺失能夠降低活疫苗株的致病性風險,但必然造成疫苗株對宿主動物和人體適應力降低,甚至會降低其保護力(尤其是缺失一些編碼毒力因子相關的基因)[12]。本研究通過布魯氏菌全基因組DNA芯片的比較基因組學技術,檢測了4株疫苗株的基因缺失和基因多拷貝分子事件,較深入地認識了布魯氏菌減毒活疫苗株免疫原性和保護力的遺傳基礎。另外,利用布魯氏菌全基因組DNA芯片進行比較基因組雜交,可以高通量檢測分析活疫苗的毒力基因和抗原蛋白基因,從而可以對任何一株新的布魯氏菌減毒活疫苗株進行預評價。目前已有13株布魯氏菌全基因組序列可用[13]。本課題組正在利用生物信息學分析它們之間的基因序列差異,希望通過已測序菌株找到一些分子靶標和我們發現的差異基因片段,構建囊括13株菌序列的主要差異基因,更深入地研究布魯氏菌活疫苗株以及各亞種內的遺傳差異,分析它們在毒力和宿主特異性的遺傳基礎。
[1]Schurig GG,Sriranganathan N,Corbel MJ.Brucellosis vaccines:past,present and future[J].Vet Microbiol,2002,90(1-4):479-496.DOI:10.1016/S0378-1135(02)00255-9
[2]Fugier E,Pappas G,Gorvel JP.Virulence factors in brucellosis:implications for aetiopathogenesis and treatment[J].Expert Rev Mol Med, 2007, 9 (35): 1-10. DOI: 10.1017/S1462399407000543
[3]Shang D,Xiao D,Ying J.Epidemiology and control of brucellosis in China[J].Vet Microbiol,2002,90(1-4):165-182.DOI:10.1016/S0378-1135(02)00252-3
[4]Zhong ZJ,Xu J,Yu S,et al.Whole genome DNA microarray construction and comparative genomic analysis ofBrucella[J].Chin Vet Sci,2011,41(12):1215-1222.(in Chinese)鐘志軍,徐杰,于爽,等.布魯氏菌全基因組DNA芯片研制及比較基因組雜交方法建立[J].中國獸醫科學,2011,41(12):1215-1222.
[5]Si R,Xu ZK.Research progress on brucellosis in China[J].Endi Dis Bull,2006,21(5):80-82.(in Chinese)司瑞,徐志凱.布魯氏菌病國內研究進展[J].地方病通報,2006,21(5):80-82.
[6]Yin HP,Chen Y.Investigations of abortion in ewes caused by inoculatingBrucellaM5[J].Chin J Vet Med,1998,24(11):20.(in Chinese)殷紅萍,陳泳.布魯氏桿菌M5號疫苗引起母羊大批流產的情況調查[J].中國獸醫雜志,1998,24(11):20.
[7]Stevens MG,Olsen SC,Pugh GW Jr.Comparison of spleen cell proliferation in response toBrucella abortus2308lipopolysaccharide or proteins in mice vaccinated with strain 19or RB51[J].Infect Immun,1995,63(8):3199-3205.
[8]Crasta OR,Folkerts O,Fei Z,et al.Genome sequence ofBrucella abortusvaccine strain S19compared to virulent strains yields candidate virulence genes[J].PLoS One,2008,3(5):e2193.DOI:10.1371/journal.pone.0002193
[9]Sangari FJ,Grillo MJ,Jimenez De Bagues MP,et al.The defect in the metabolism of erythritol of theBrucella abortusB19vaccine strain is unrelated with its attenuated virulence in mice[J].Vaccine,1998,16(17):1640-1645.
[10]Sangari FJ,Aguero J.Identification ofBrucella abortusB19 vaccine strain by the detection of DNA polymorphism at the ery locus[J].Vaccine,1994,12(5):435-438.DOI:10.1016/0264-410X(94)90121-X
[11]Blasco JM,Marin C,Jimenez de Bagues MP,et al.Efficacy ofBrucella suisstrains 2vaccine againstBrucella ovisin rams[J].Vaccine,1993,11(13):1291-1294.DOI:10.1016/0264-410X(93)90097-H
[12]Zhong ZJ,Yu S,Xu J,et al.Research progress on evolution and classification of brucellosis[J].Chin J Vet Sci,2011,31(8):1228-1235.(in Chinese)鐘志軍,于爽,徐杰,等.布魯菌進化和分類學研究進展[J].中國獸醫學報,2011,31(8):1228-1235.
[13]Zhong ZJ,Yu S,Xu J,et al.Research progress on comparative genomics of brucellosis[J],Chin J Zoonoses,2011,27(4):346-350.(in Chinese)鐘志軍,于爽,徐杰,等.布魯氏菌比較基因組學研究進展[J].中國人獸共患病學報,2011,27(4):346-350.

