不同品種紅棗中三萜酸及環核苷酸的測定
高 婭, 楊 潔, 楊迎春, 蘇力坦·阿巴白克力
(新疆大學生命科學與技術學院,新疆烏魯木齊830046)
紅棗Zizyphus Jujube Date為鼠李科棗屬植物棗樹Zizyphus Jujube Mill的成熟果實,是衛生部批準的藥食兼用品種之一[1]。紅棗中含有的三萜酸類物質所表現出的細胞毒性,具有對腫瘤細胞高度選擇性的特點,成為近年來抗腫瘤藥物研究的熱點。現代藥理學研究表明,白樺脂酸 (betulinic acid,BA)、齊墩果酸 (oleanolic acid,OA)和熊果酸(ursolic acid,UA)為紅棗中最具代表性且含有量較高的五環三萜類化合物,九十年代中期經研究發現白樺脂酸可以選擇性地殺死人類黑色素瘤細胞而不殺傷健康細胞,白樺脂酸對HIV-1型感染有抑制作用,另外近期的研究表明白樺脂酸對腦瘤、神經外胚層瘤、白血病等惡性腫瘤細胞也有抑制作用;齊墩果酸具有較強的抗菌消炎作用及保護肝臟、利水滲濕等功效;熊果酸有抑制多種惡性腫瘤細胞生長的作用,對誘癌、致癌物也有一定的抵抗作用,毒副作用小,安全性高[2]。
環核苷酸及其衍生物有10多種,其中具重要生物活性的主要為環磷酸腺苷 (adenosine 3',5'-cyclic monophos-phate,cAMP)和環磷酸鳥苷(guanosine-3',5'-cyclic phosohate,cGMP)。在人與哺乳動物體內,環磷酸腺苷和環磷酸鳥苷已被公認為兩種具有反向調節作用的第二信使物質,共同參與多種生理生化過程的調節,并可用于基因轉錄,影響蛋白質合成。醫學研究證明至少40多種疾病 (包括癌癥、高血壓、冠心病、心肌梗塞和心源性休克等重大疾病)與環核苷酸的代謝有關。據報道,棗成熟果肉中環磷酸腺苷含有量是所有已測動植物材料中最高的,頗具開發價值[3]。
單獨測定白樺脂酸、齊墩果酸、熊果酸、環磷酸腺苷和環磷酸鳥苷的文獻已有不少,檢測方法過去多采用紙層析法、薄層層析法、紫外分光光度法、競爭蛋白法等,這些方法存在著所需時間長、操作繁瑣、重現性差、靈敏度低、人為誤差比較大等問題,現在多采用高效液相色譜法 (HPLC法)進行定量測定。現代研究表明,不同品種、不同產地的藥材,其所含化學成分的種類及量均有較大差異,因此有必要開展不同品種、不同產地紅棗中三萜類化合物和環核苷酸含有量的考察,建立快速、準確、高效的檢測方法,有助于指導白樺脂酸、齊墩果酸、熊果酸和環核苷酸加工時選擇合適的原料,這對紅棗進行深加工,帶動當地經濟,增加農民收入將起到積極的作用。
1 儀器與試劑
LC—10Atvp高效液相色譜儀 (紫外檢測器)(日本島津公司);AL104型電子天平 (梅特勒-托利多國際股份有限公司);NW Ultra-pure Water System超純水儀 (力康生物醫療科技控股有限公司);KQ—250DE型數控超聲波儀 (昆山市超聲儀器有限公司)。
對照品:白樺脂酸 (上海源葉生物科技有限公司,批號:YY90277),齊墩果酸 (中國藥品生物制品檢定所,批號 110709-200505),熊果酸(中國藥品生物制品檢定所,批號110742-200516),環磷酸腺苷 (中國藥品生物制品檢定所,批號140709-200401),環磷酸鳥苷 (美國Sigma公司)。
甲醇 (色譜純,美國 fisher scientific公司),實驗用水為超純水,磷酸、磷酸二氫鉀等其余試劑均為分析純。
新鄭紅棗、金絲小棗、狗頭棗、灘棗購自新疆烏魯木齊七一醬園超市,其它品種采自新疆和田、阿克蘇、喀什、若羌、哈密,樣品采集后,晾干,去核,粉碎后過40目篩,備用。
2 方法與結果
2.1 白樺脂酸、齊墩果酸和熊果酸的測定
2.1.1 色譜條件 Shim-pack VP-ODS C18色譜柱(150 mm×4.6 mm,5 μm);流動相為甲醇-0.2%磷酸水溶液 (90∶10,V/V);檢測波長210 nm;體積流量0.5 mL/min;柱溫為室溫;進樣量20 μL。
2.1.2 三萜酸標準貯備液的制備 分別準確稱取白樺脂酸、齊墩果酸、熊果酸各5.00 mg,加少量甲醇溶解,移入50 mL量瓶中,用甲醇定容至50 mL,分別得到質量濃度為0.1 mg/mL的白樺脂酸、齊墩果酸和熊果酸的標準貯備溶液。
2.1.3 樣品前處理 準確稱取5.0 g紅棗粉,加入25 mL甲醇,70℃超聲提取20 min,過濾,濾渣再加入20 mL甲醇重復提取1次,過濾,合并兩次濾液并定容至50 mL,4000 r/min離心10 min,上清液經0.22 μm微孔濾膜過濾后備用。
2.1.4 標準曲線與線性范圍 分別量取2.1.2項白樺脂酸、齊墩果酸和熊果酸標準貯備液2.0、5.0、10.0、25.0、50.0、100.0 mL至 100 mL量瓶,用甲醇定容,分別得到質量濃度為2.0、5.0、10.0、25.0、50.0、100.0 μg/mL 的系列標準溶液,分別進樣20 μL,按2.1.1項色譜條件進行測定。以峰面積Y對質量濃度C進行線性回歸,得回歸方程,結果見表1。

表1 回歸方程和相關系數Tab.1 Linear equations and their correlation coefficients
2.1.5 系統適用性實驗 取對照品溶液、供試品溶液,按2.1.1項色譜條件測定,記錄色譜圖 (圖1)。結果對照品和供試品溶液的色譜圖中,白樺脂酸、齊墩果酸和熊果酸的保留時間一致。經計算,理論塔板數、分離度、拖尾因子等各項指標均符合《中國藥典》2005年版一部附錄VID關于系統適用性的規定。
2.2 環磷酸腺苷和環磷酸鳥苷的測定
2.2.1 色譜條件 Shim-pack VP-ODS C18色譜柱(150 mm ×4.6 mm,5 μm);流動相為甲醇-0.05 mol/L磷酸二氫鉀 (10∶90,V/V);檢測波長254 nm;體積流量0.8 mL/min;柱溫為室溫;進樣量 20 μL。
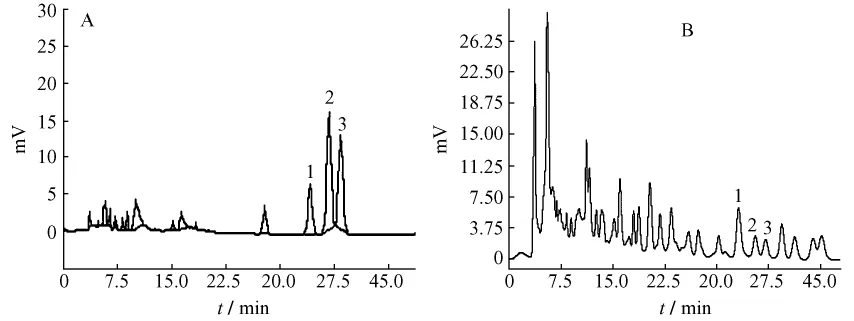
圖1 對照品 (A)和樣品溶液 (B)的HPLC色譜圖Fig.1 HPLC chromatograms of mixed reference substance solution(A)and sample solution(B)
2.2.2 cAMP和cGMP標準貯備液的制備 分別準確稱取 cAMP、cGMP各5.00 mg,加入2 mL超純水溶解,搖勻,定容于5 mL量瓶中,即得質量濃度均為1.0 mg/mL的cAMP、cGMP標準貯備液。
2.2.3 樣品前處理 準確稱取5.0 g紅棗粉,加入25 mL超純水,70℃超聲提取30 min,過濾,濾渣再加入20 mL超純水重復提取1次,過濾,合并兩次濾液并定容至50 mL,8000 r/min離心15 min,上清液經0.22 μm微孔濾膜過濾后備用。
2.2.4 標準曲線與線性范圍 分別精密量取2.2.2項的cAMP、cGMP標準貯備液0.05、0.10、0.20、0.50、1.0、5.0、10.0 mL至100 mL量瓶,用甲醇定容,分別得到質量濃度為 0.5、1.0、2.0、5.0、10.0、50.0、100.0 μg/mL的系列標準溶液,分別進樣20 μL,按2.2.1項色譜條件進行測定。以峰面積Y對質量濃度C進行線性回歸,回歸方程和線性范圍見表1。
2.2.5 系統適用性實驗 取對照品溶液、供試品溶液,按2.2.1項色譜條件測定,記錄色譜圖 (圖2)。結果對照品和供試品溶液的色譜圖中,環磷酸腺苷和環磷酸鳥苷的保留時間一致。經計算,理論塔板數、分離度、拖尾因子等各項指標均符合《中國藥典》2010年版一部附錄VID關于系統適用性的規定。
2.3 精密度實驗 分別吸取白樺脂酸、齊墩果酸和熊果酸及環磷酸腺苷和環磷酸鳥苷混合標準貯備液各20 μL,按2.1.1項和2.2.1項色譜條件連續進樣5次,分別以白樺脂酸、齊墩果酸、熊果酸、環磷酸腺苷和環磷酸鳥苷的峰面積計算,相對標準偏差 (RSD)依次為 1.41%、1.24%、1.08%、0.94%和1.43%(n=5),表明儀器進樣精密度良好。
2.4 重復性實驗 準確稱取5份同一批紅棗粉5.0 g,按2.1.3項和2.2.3項方法制備樣品溶液并進行測定,分別計算白樺脂酸、齊墩果酸、熊果酸、環磷酸腺苷和環磷酸鳥苷,RSD分別為1.9%、1.8%、1.9%、1.8%和 0.9% (n=5),表明方法的重現性良好。

圖2 混合對照品 (C)和樣品溶液 (D)的HPLC色譜圖Fig.2 HPLC chromatograms of mixed reference substancs solution(C)and sample solution(D)
2.5 穩定性實驗 取同一批紅棗樣品溶液,每隔1 h進樣1次,共進樣8次,測定各時間點下白樺脂酸、齊墩果酸、熊果酸、環磷酸腺苷和環磷酸鳥苷峰面積及RSD值。結果,白樺脂酸、齊墩果酸、熊果酸、環磷酸腺苷和環磷酸鳥苷峰面積的RSD分別為 2.1%、2.3%、2.1%、1.5%和 2.0%(n=8),表明樣品溶液至少在8 h內穩定。
2.6 回收率實驗 準確稱取紅棗粉5.0 g,按2.1.3項和2.2.3項處理樣品,分別加入不同濃度的白樺脂酸、齊墩果酸、熊果酸、環磷酸腺苷和環磷酸鳥苷標準貯備液,按2.1.1項和2.2.1項色譜條件分別進樣測定,計算回收率。結果見表2。
2.7 樣品測定 取不同產地的紅棗粉,按2.1.3項和2.2.3項制備方法和2.1.1項和2.2.1項色譜條件分別進樣測定,以外標法計算,結果見表3。
3 結論
通過SPSS 17.0軟件對所得數據進行均值方差分析,從所測定的15個樣品紅棗中可以看出,不同品種、不同產地紅棗中白樺脂酸、齊墩果酸、熊果酸、環磷酸腺苷和環磷酸鳥苷的含有量均存在顯著性差異 (P<0.05),以開發棗三萜酸和環核苷酸為目的的功能性食品和保健品應該注意棗品種的選擇。在所測定的15個樣品中,河南新鄭紅棗中白樺脂酸和齊墩果酸含有量最高,為632.83 μg/g和202.10 μg/g;山東金絲小棗和和田駿棗中齊墩果酸的含有量之間差異不顯著 (P<0.05),但與其它品種間均存在顯著性差異;河北滄州金絲小棗中熊果酸含有量最高,為374.23 μg/g;阿克蘇駿棗中環磷酸腺苷含有量最高,為285.44 μg/g;和田駿棗中環磷酸鳥苷含有量最高,為56.63 μg/g。
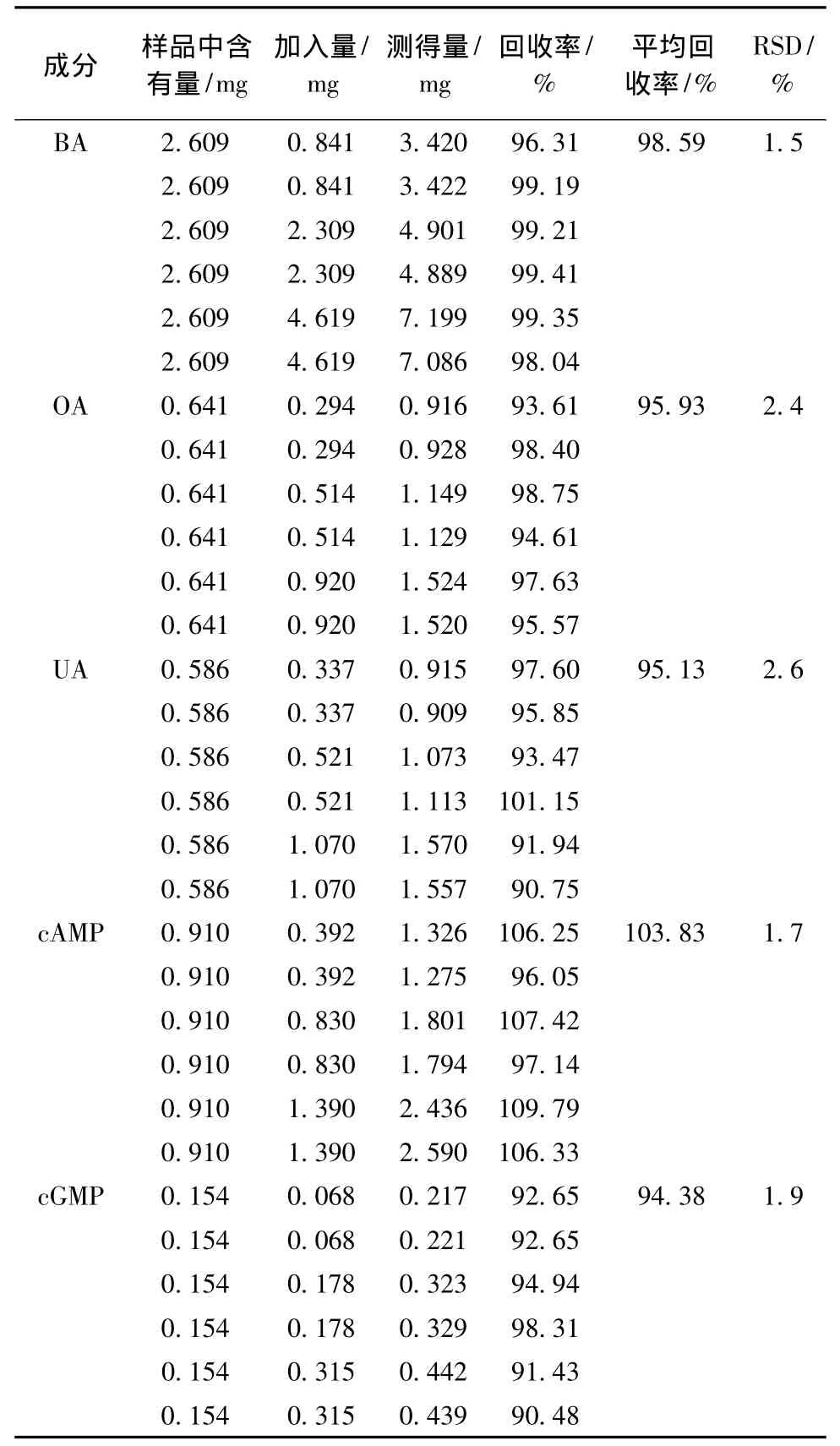
表2 加樣回收率試驗結果(n=6)Tab.2 Results of recovery experiments(n=6)
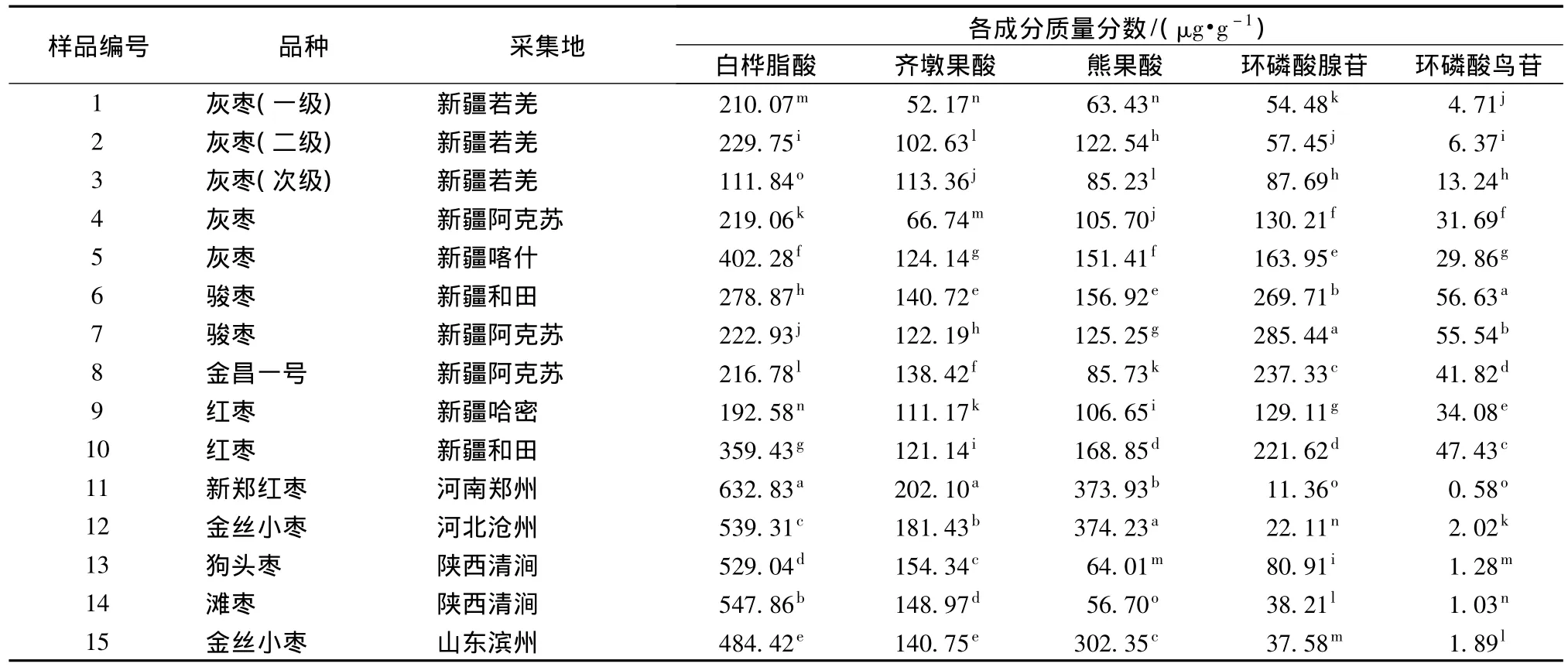
表3 不同產地紅棗粉中白樺脂酸、齊墩果酸、熊果酸、環磷酸腺苷和環磷酸鳥苷的測定結果Tab.3 Contents of BA、OA、UA、cAMP and cGMP in Jujube of different cultivars
同一產地不同品種間5種成分的含有量也存在顯著性差異,如阿克蘇駿棗中5種成分的含有量均高于灰棗和金昌一號;即使是同一品種,由于地域的不同,受環境影響,5種成分的含有量也有明顯差異,如灰棗中,喀什澤普縣的含有量均高于阿克蘇和若羌地區,為阿克蘇灰棗含有量的2.23倍。同一品種不同等級之間也存在顯著性差異,如若羌紅棗,且次級棗中環磷酸腺苷和環磷酸鳥苷的含有量均高于優級棗,此結論與文獻 [3]報道一致。
所測3種三萜酸在各品種之間的基本規律是白樺脂酸含有量最高,其次為熊果酸,再次為齊墩果酸。環磷酸腺苷的含有量明顯高于環磷酸鳥苷。
4 討論
目前,關于HPLC法測定白樺脂酸、齊墩果酸、熊果酸、環磷酸腺苷和環磷酸鳥苷已有報道,根據已有資料表明檢測三萜酸的流動相多數為甲醇-水-酸或者乙腈-水-酸。由于三萜酸類化合物呈弱酸性,在中性或堿性條件下易電離,因此分別采用磷酸鹽體系、磷酸、冰醋酸調整流動相的酸堿性。通過對流動相分離條件進行選擇后發現,等度洗脫的分離效果并不亞于梯度洗脫方式,冰醋酸本身具有洗脫能力,磷酸廉價易得且分離效果較好,考慮到實驗成本等因素,最終選擇甲醇-水體系,并用磷酸調節流動相的酸堿性,恒梯度洗脫方式。
王向紅[3]等從阜平大棗不同等級樣品分析結果來看,齊墩果酸和熊果酸的含有量似乎與品質之間不存在明顯相關性,本研究通過對新疆若羌灰棗不同等級樣品中白樺脂酸、齊墩果酸和熊果酸含有量進行分析,其結論與本研究結果一致。
郜文等[6]測定陜西省紅棗中 cAMP含有量為62.9 μg/g,與本次測得陜西狗頭棗 (80.91 μg/g)的結果差異不大;王向紅[3]等曾對10余個棗品種中cAMP和cGMP含有量進行測定,結果表明駿棗中cAMP的含有量明顯高于其它品種,與本研究結果一致,其中三變紅棗中cGMP含有量最高,為17.2 μg/g,其次為婆婆棗,其它棗品種的含有量約在0.63 μg/g~3.44 μg/g之間,本研究幾個其它省區棗品種的含有量均符合此范圍,但新疆棗品種cGMP的含有量明顯高于其它幾個省區,和田駿棗含有量最高,為56.63 μg/g;蘇豫梅等[5]測定新疆阿克蘇灰棗和駿棗中cAMP含有量分別為170 μg/g與260 μg/g,與本實驗結果有差異,初步分析其原因可能與不同的采樣時間、采樣地點、提取方法等有關,對于這些影響因素還有待于進一步的研究。
本研究對15種紅棗中3種三萜酸及環核苷酸活性成分進行了測定,對于提高棗及棗類產品的附加值、選育高三萜酸含有量和高環核苷酸含有量棗品種以及開發棗的功能食品和保健品都具有重要意義。
[1]曹艷萍,楊秀利,薛成虎.紅棗中齊墩果酸提取工藝的研究[J].食品科學,2007,28(10):165-167.
[2]盛靈慧,高運華,趙正宜.固相萃取-HPLC測定棗中熊果酸和齊墩果酸[J].化學分析計量,2008,17(4):18-20.
[3]王向紅,桑亞新,劉孟軍.高效液相色譜法測定棗果中的環核苷酸[J].中國食品學報,2005,5(3):108-112.
[4]李 明,楊國林,李明潤,等.大棗環磷酸腺苷提取工藝的研究[J].中藥材,2007,30(9):1143-1145.
[5] 蘇豫梅,許 玲,孫振榮,等.用HPLC法測定紅棗中cAMPA含量的研究[J].農產品加工,2011,7:76-78.
[6]郜 文,丁兆毅,徐 菲,等.HPLC法測定大棗環磷酸腺苷的含量[J].首都醫科大學學報,2011,32(3):375-378
[7]王立霞,陳錦屏,段玉峰,等.和田玉棗中環磷酸腺苷的分離純化工藝研究[J].食品科學,2008,29(12):250-254.
[8]Subbaramaish k.UrsoLic acid ingibits cycLooxygenase-2 transcroption in human mammary epitheLiaL ceLLs[J].Cancer Res,2000,60(9):2399.
[9]Liu Jie.Pharmacology of oleanolic and ursolic acid[J].Ethnophannacol,1995,49:57.
[10]李 東,何 伶.高效液相色譜-蒸發光散射檢測法同時測定木瓜中齊墩果酸和熊果酸含量[J].中國醫藥學院雜志,2005,25(3):259-261.
[11]樊 君,高續春,郭 璞,等.大孔吸附樹脂分離純化棗渣中三萜酸的研究[J].離子交換與吸附,2008,24(5):426-433.
[12]Hanabasa K,Cyong J,Takahashi M.High-level of Cyclic AMP in the jujube plum[J].Planla med,1981,42(8):380-384.
[13]DanieL P B,Wallker W H,Habener J F.Cyclic AMP signaling and gene regulation[J].Annu Rev Nutr,1998,18:353-383.
[14]Cyong J C,Takahashi M.Identification of guanosine 3',5'-monophosphate in the fruit of Zizyphus Jujube[J].Phytochemistry,1982,21:1871-1874.
[15]王向紅,崔 同,齊小菊,等.HPLC法測定不同品種棗及酸棗中的齊墩果酸和熊果酸[J].食品科學,2002,23(6):137-138.
[16]謝 樂,馬曉黎,劉麗芳,等.HPLC測定不同產地威靈仙中齊墩果酸的含量[J].中成藥,2009,31(1):100-103.
[17]張 巖,呂 品,劉敬澤,等.高效液相色譜法同時測定濃縮棗汁中環磷酸腺苷和環磷酸鳥苷的含量[J].食品科學,2009,30(18):321-322.
[18]于明明,周富強,劉軍海.熊果酸提取工藝的研究進展[J].氨基酸和生物資源,2009,31(1):33-36.

