靶向舌癌Tca8113細胞血管內皮細胞生長因子基因的siRNA表達載體構建及體外抑制作用
姚志文 劉 唯 程由勇 李紅玖 李春華 于大海
1.廣州醫學院附屬深圳沙井醫院口腔科,廣東 深圳 518104;2.廣西醫科大學口腔醫學院,廣西 南寧 530021021
血管內皮細胞生長因子(vascular endothelial growth factor,VEGF)能促進舌癌(carcinoma of tongue)中血管的生成,與舌癌的生長與轉移密切相關[1-2],抑制VEGF基因的表達可望抑制舌癌血管的生成,從而抑制舌癌細胞的增殖和轉移。本研究以VEGF基因為靶點,構建VEGF-siRNA表達載體,轉染舌癌Tca8113細胞,研究其對Tca8113細胞VEGF基因表達的抑制作用。
1 材料與方法
1.1 材料
Tca8113細胞株(四川大學口腔疾病研究國家重點實驗室),Psilencer 2.1-U6-neo真核表達載體(美國 Ambion公司),脂質體 Lipofectamine 2000(美國 Invitrogen 公司),質粒小劑量提取試劑盒(美國Omega公司),大腸桿菌DH5α(武漢晶賽生物公司),G418試劑(美國Gbico公司),人VEGFELISA試劑盒 (上海森雄科技實業有限公司),限制性內切酶、T4 DNA連接酶 (美國NEB公司),HRP標記兔抗人的IgG抗體(美國Gbico公司),鼠抗人VEGF的單克隆抗體(美國Santa Cruz公司)。
1.2 方法
1.2.1 血管內皮細胞生長因子基因特異的siRNA表達載體構建 根據基因數據庫已知VEGF mRNA序列,參考siRNA的設計有關文獻[3],設計針對VEGF基因不同剪切子的公共靶點,根據所選靶點人工合成VEGF基因RNAi靶序列(5′-GATAGAGCAAGACAAGAAA-3′)及其互補的反義鏈。以及一條實驗對照序列(即無關序列HK:5′-GACTTCATAAGGCGCATGC-3')及其互補的反義鏈。靶序列和實驗對照序列各自的互補兩條寡核苷酸片段經退火連接形成雙鏈DNA模板鏈。用Bam HI+HindⅢ對質粒Psilencer 2.1-U6-neo進行雙酶切。T4 DNA連接酶將線性化Psilencer 2.1-U6-neo和模板鏈連接成重組載體,靶序列與實驗對照序列重組載體分別命名為Pu-VEGF-siRNA載體和Pu-HK載體。
1.2.2 重組載體的酶切和測序 重組的Pu-VEGF-siRNA和Pu-HK載體轉化感受態 DH5α 細菌,50μg/mL的 Ampr抗性LB培養皿篩選陽性克隆,質粒提取試劑盒按說明提取重組載體。SalⅠ酶切重組載體,測序鑒定。
1.2.3 重組載體的轉染 10%小牛血清的RPMI-1640培養基培養Tca8113細胞,于37℃、5%CO2孵箱中培養至對數生長期。以每孔1×106/mL細胞接種24孔培養板并培養過夜。按說明書使用Lipofectamine 2000將含有重組Pu-VEGF-siRNA和Pu-HK載體分別轉染Tca8113細胞。實驗分為三組,轉染Pu-VEGF-siRNA為實驗組,轉染Pu–HK載體組作實驗對照組,未轉染組作空白對照組。實驗組和實驗對照組G418篩選1周后得到穩定轉染細胞克隆。
1.2.4 免疫組織化學染色分析Tca8113細胞血管內皮細胞生長因子蛋白表達 常規SABC法檢測Tca8113細胞VEGF的蛋白表達,各組隨機選取100個Tca8113染色細胞,使用MIAS-2000醫用彩色病理圖像免疫組化測量系統對其灰度值進行測定。
1.2.5 酶聯免疫吸附法(enzyme linked immunosorbentassay,ELISA)測定Tca8113細胞上清液的血管內皮細胞生長因子蛋白表達 按照ELISA試劑盒操作說明進行操作,收集各組Tca8113細胞培養上清液,使用OD值作縱坐標,標準品濃度作橫坐標,進行標準曲線繪制。根據Tca8113細胞上清OD值在標準曲線中可以查出對應濃度。
1.3 統計學方法
采用SPSS 13.0統計學軟件進行處理。計量資料數據以均數±標準差()表示,多組間的比較采用方差分析,兩兩比較采用LSD-t檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 重組載體酶切鑒定
質粒Psilence 2.1-U6-neo基因序列里沒有SalⅠ酶切位點,本研究插入的序列里設計有SalⅠ酶切位點,Pu-VEGF-siRNA和Pu-HK質粒均能被SalⅠ酶切,即均為插入正確的質粒(圖 1)。
2.2 重組載體基因測序
經酶切鑒定的重組質粒送往上海生工公司進行DNA全長測序。所得結果如圖2~3。經Blaster對比,測序結果與GenBank的VEGF基因序列完全一致,證實重組載體構建成功。
2.3 免疫組織化學染色SABC法分析Tca8113細胞血管內皮細胞生長因子蛋白表達

圖1 重組載體的酶切鑒定

圖2 Pu-VEGF-siRNA DNA測序

圖3 Pu-HK DNA測序
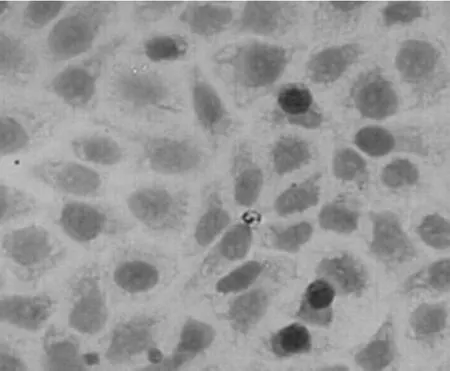
圖4 空白對照組Tca8113細胞胞漿染色明顯(×400)
結果如圖4~6所示,實驗組細胞與實驗對照組及空白對照組比較,細胞著色顆粒明顯減少,而且著色變淺。對照組灰度值比實驗組的明顯降低(P<0.05)。實驗對照組與空白對照組比較差異無統計學意義(P>0.05)。
2.4 酶聯免疫吸附法測定Tca8113細胞上清液血管內皮細胞生長因子蛋白表達
實驗組細胞與實驗對照組及空白對照組比較,VEGF蛋白濃度有所降低(P<0.05)。以實驗對照組VEGF相對水平作參照,實驗組濃度下降34.64%。與空白對照組比較,蛋白質量濃度相似,差異無統計學意義(P>0.05)。見圖7。
3 討論
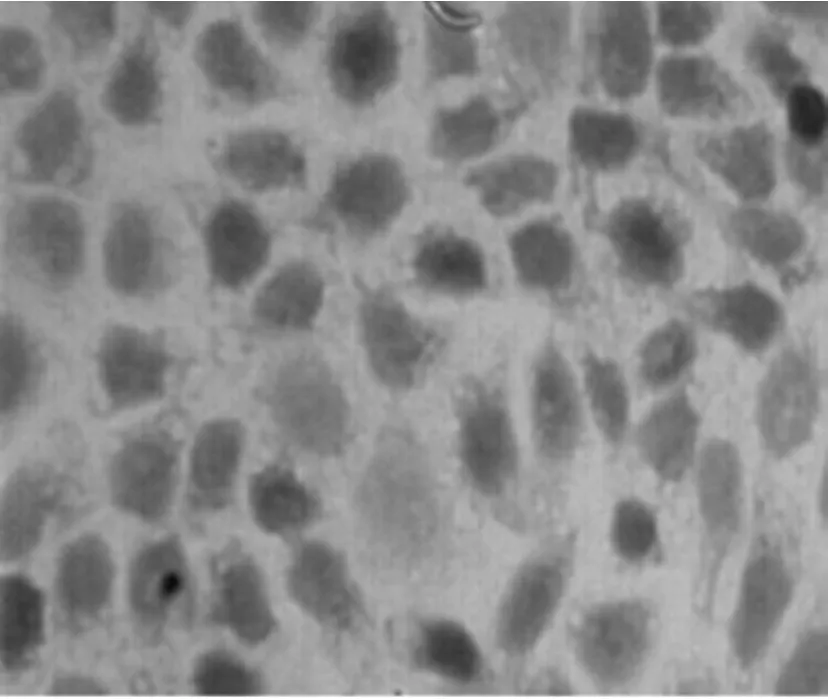
圖5 實驗對照組Tca8113細胞胞漿染色明顯(×400)
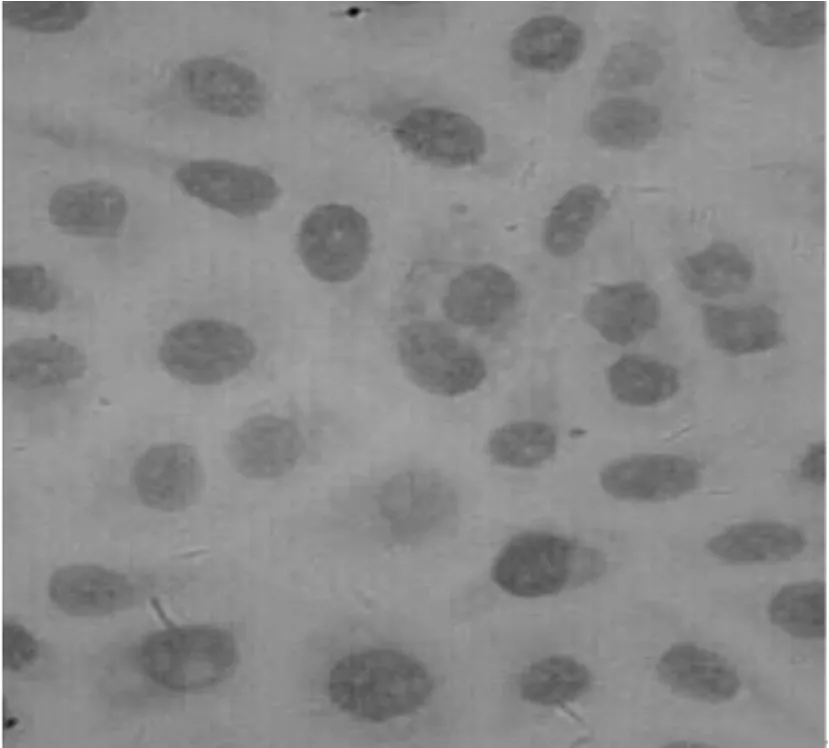
圖6 實驗組TCA8113細胞胞漿染色減少(×400)
RNAi(RNA interference)是指由小分子雙鏈RNA誘發的基因沉默現象,其機制是通過阻礙特定基因的翻譯或轉錄來抑制基因表達。當細胞中導入與內源性mRNA編碼區同源的雙鏈RNA時,相應mRNA發生降解而導致基因表達沉默,它具有高穩定性、靶向性和高效率性等特點[4],目前已經成為篩選新基因、基因功能研究、基因疾病治療和尋找藥物靶點的重要工具[5-7]。
本實驗以人VEGF基因作為RNAi的靶基因,目的通過VEGF siRNA靶向阻斷或抑制VEGF的表達,達到阻斷或抑制VEGF促舌癌血管形成,進而抑制舌癌細胞增殖和轉移的目的。VEGF mRNA的剪切方式的不同可產生5種不同形式蛋白分子:VEGF206、VEGF189、VEGF165、VEGF145、VEGF121。不同的VEGF分子協同作用促進腫瘤血管形成[8]。本實驗利用基因重組技術,根據基因數據庫已知VEGF mRNA序列,參考siRNA的設計有關文獻,設計針對VEGF mRNA公共序列的靶點,體外構建Pu-VEGF-siRNA重組載體,然后利用轉染技術將其轉染Tca8113細胞并使其在細胞中穩定表達。常規SABC法和ELISA檢測Tca8113細胞VEGF的蛋白表達結果表明:轉染Pu-VEGF-siRNA重組載體后,實驗組Tca8113細胞的VEGF蛋白表達較空白對照組和實驗對照組有所減弱,而且空白對照組和實驗對照組的VEGF蛋白表達無明顯差異;說明所構建的真核表達載體Pu-VEGF-siRNA對人舌癌細胞株Tca8113中VEGF有較強的特異性抑制效果。這與其他學者[8]構建針對VEGFmRNA公共序列靶點,體外構建重組載體,轉染相應癌細胞后有效抑制VEGF表達結果一致。
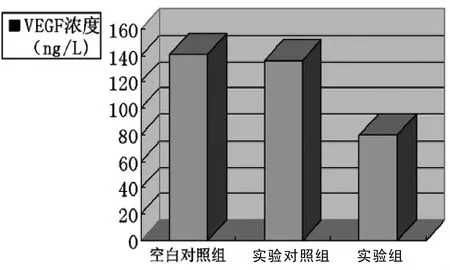
圖7 三組細胞上清液血管內皮細胞生長因子蛋白濃度
筆者通過構建Pu-VEGF-siRNA重組載體并體外轉染舌癌Tca8113細胞,實驗結果表明能夠特異和有效地抑制癌細胞VEGF的表達。這為應用RNA干擾技術對舌癌進行基因治療提供了實驗基礎和理論依據,為舌癌的治療選擇開辟了新的途徑。
[1]Castro-Rivera E,Ran S,Thorpe P,et al.Semaphorin 3B(SEMA3B) induces apoptosis in lung and breast cancer,whereas VEGF165 antagonizes this effect[J].Proc Natl Acad Sci USA,2004,101(31):11432-11437.
[2]Chen J,Wen YM,Li LJ,et al.Expression of vascular endothelial growth factor in oral squamous cell carcinoma [J].West China J Stomatol,2001,19(5):303-305,308.
[3]Takei Y,Kadomatsu K,Yuzawa Y,et al.A small interfering RNA targeting vascular endothelial growth factor as cancer therapeutics[J].Cancer Res,2004,64(10):3365-3370.
[4]Hannon GJ.RNA interference[J].Nature,2002,418(6894):244-251.
[5]Davis ME,Zuckerman JE,Choi CH,et al.Evidence of RNAi in humans from systemically administered siRNA via targeted nanoparticles[J].Nature,2010,464(7291):1067-1070.
[6]Eguchi A,Dowdy SF.Efficient siRNA delivery by novel PTD-DRBD fusion proteins[J].Cell Cycle,2010,9(3):424-425.
[7]Brosnan CA,Voinnet O.Cell-to-cell and long-distance siRNA movement in plants:Mechanisms and biological implications [J].Curr Opin Plant Biol,2011,14(5):580-587.
[8]Zhang L,Yang N,Mohamed-Hadley A,et al.Vector-based RNAi,a novel tool for isoform-specific knock-down of VEGF and anti-angiogenesis gene therapy of cancer[J].Biochem Biophys Res Commun,2003,303(4):1169-1178.

