Cu2+/Zn2+對牛血清白蛋白-鹽酸小檗堿結合過程的變構效應
李 磊,徐列兵,陳世云,趙英杰
(1.中國石油集團石油職業衛生技術服務中心,河北 廊坊 065000;2.中國石油管道公司濟南輸油分公司,山東 濟南 250014;3.廊坊師范學院管理學院,河北 廊坊 065000)
多種小分子(離子)物質同時與生物大分子結合及彼此間的影響已經引起研究者的關注[1~5]。Chen等[6]利用生物作用色譜(Biointeraction chromatography)技術以血清白蛋白為固定相考察了一種藥物(變構劑)對另一種藥物與蛋白質結合所產生的變構效應(Allosteric effect)[6~8],報道了蛋白質-藥物結合的定量變構系數,為探討多種藥物分子在結合蛋白質過程中的競爭作用提供了新的思路。目前,大部分報道僅局限于金屬離子對蛋白質-藥物分子結合過程的影響研究[1~5],而關于金屬離子對蛋白質-藥物分子結合過程的變構效應少有報道。
考慮到在色譜技術中蛋白質作為固定相其原有性質可能改變以及蛋白質隨流動相的洗脫損失,采用光譜技術研究藥物分子對牛血清白蛋白(Bovine serum albumin,BSA)-金屬離子結合過程的變構效應已有報道[9]。作者選取金屬離子Cu2+、Zn2+作為變構劑,分別采用熒光光譜(FS)、紫外可見吸收光譜(UV-Vis)以及圓二色譜(CD)考察了Cu2+/Zn2+對中藥有效成分鹽酸小檗堿(Berberine chloride,BC)與BSA結合過程的變構效應,并從BSA分子構象轉變角度對變構效應產生的可能機制進行了探討,以期為金屬離子對血漿中外源藥物的儲存和分布的影響以及后續生物效應的研究提供有用信息。
1 實驗
1.1 試劑與儀器
牛血清白蛋白(>98%,BSA Fraction Ⅴ),上海華美生物工程公司;鹽酸小檗堿,自制[10];Tris(生化試劑)、ZnCl2(分析純)、CuCl2·2H2O(分析純),國藥集團化學試劑有限公司;其它試劑均為分析純。
RF-5301PC型熒光光度計,日本島津公司;TU-1901型紫外可見分光光度計,北京普析通用儀器有限責任公司;J-715型圓二色光譜儀,日本JASCO公司。
1.2 方法
分別以Cu2+/Zn2+濃度(×10-5mol·L-1)為0.2、0.4、0.6、0.8、1.0的Tris-HCl緩沖溶液(37 ℃下pH=7.4,內含0.15 mol·L-1NaCl以維持溶液離子強度)為溶劑配制1.0×10-5mol·L-1的BSA標準溶液,備用。在三角瓶中精確移入一定量1.5×10-2mol·L-1的BC甲醇標準溶液,迅速吹干溶劑,準確移入BSA標準溶液10 mL,超聲分散3 min,在(37±0.1) ℃下恒溫3 h至結合平衡。激發波長為295 nm,激發光柵和發射光柵狹縫寬度均為3 nm,恒溫測定上述樣品在300~500 nm的熒光發射光譜。
分別以Cu2+/Zn2+濃度(×10-5mol·L-1)為0.2、0.4、0.6、0.8、1.0的Tris-HCl緩沖溶液為溶劑配制1.0×10-5mol·L-1的BC溶液,測定其在300~500 nm的紫外可見吸收光譜,以相應的Tris-HCl緩沖溶液為參比。
以2.0×10-6mol·L-1的BSA的Tris-HCl溶液為溶劑配制BC與Cu2+/Zn2+成一定濃度比的Cu2+/Zn2+-BSA-BC溶液,測定其在190~250 nm 的圓二色譜(色譜條件參照文獻[11,12])。
2 結果與討論
2.1 Cu2+/Zn2+對BC猝滅BSA內源性熒光的變構效應
BSA分子中含有熒光性氨基酸殘基(色氨酸、酪氨酸和苯丙氨酸),為內源性熒光物質。在Cu2+存在下,BC對BSA內源性熒光的猝滅作用見圖1。
由圖1可知,當激發波長為295 nm時,BSA的熒光發射峰在343 nm附近,與BSA-BC二元體系類似[10]。當BC濃度低于1.0×10-5mol·L-1時,BSA在343 nm處的熒光發射峰強度隨BC濃度的增大而降低,但峰形和出峰位置基本不變;當BC濃度超過1.0×10-5mol·L-1時,BSA的熒光發射峰強度不僅隨BC濃度的增大而降低,并且出現峰裂分[10]。
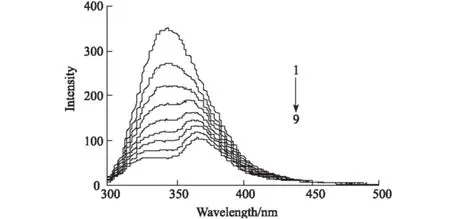
cCu2+=cBSA=1.0×10-5 mol·L-1 1~9,cBC(×10-5 mol·L-1):0,0.525,1.0,1.5,2.025,2.55,3.0,3.525,4.05
考慮到峰裂分,以熒光發射峰峰面積S代替熒光發射峰強度,按照Stern-Volmer方程和Perrin方程[即式S0/S=1+KSVcBC和式ln(S0/S)=KPcBC,式中:S和S0分別為有、無BC時BSA的熒光發射峰面積;KSV、KP為熒光猝滅常數;cBC為BC濃度][10]對0.2×10-5mol·L-1Cu2+/Zn2+存在下BC對BSA的熒光猝滅數據進行處理,結果見圖2。
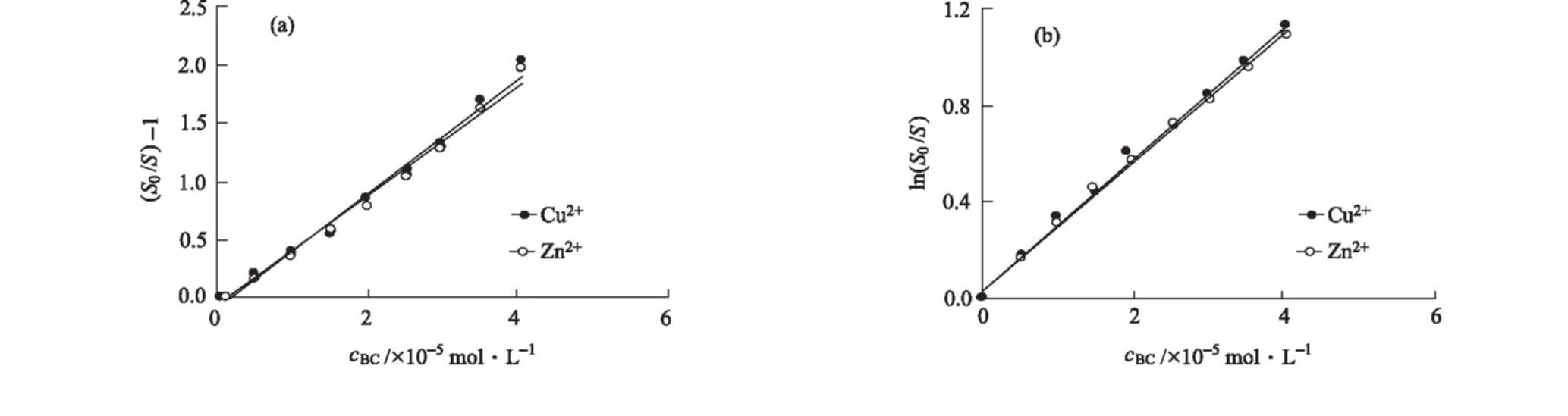
圖2 Cu2+/Zn2+存在下,BSA-BC體系的Stern-Volmer(a)和Perrin(b)曲線
線性擬合得到BSA-BC體系的Stern-Volmer方程和Perrin方程,計算猝滅常數KSV、KP,結果見表1。
由表1可見,在BSA-BC體系中分別加入Cu2+、Zn2+后,各體系線性擬合后所得KSV為104數量級,由KSV=kqτ0[13][kq為擴散過程控制的雙分子動態猝滅速率常數(L·mol-1·s-1),τ0為生物大分子內源性熒光壽命,對于BSA一般取6.3 ns[14]]求得雙分子kq大于各種猝滅體對生物大分子的最大擴散猝滅速率常數2×1010L·mol-1·s-1 [15],可以初步判定Cu2+/Zn2+存在下,BC對BSA的熒光猝滅并非由于分子擴散和動態碰撞引起的動態猝滅,而是由于BC與BSA形成復合物而引起的靜態猝滅。
參照文獻[9],定義猝滅變構系數βQ=KP/KP,0,其中KP和KP,0分別為有、無Cu2+/Zn2+時BC對BSA熒光的猝滅常數,結果見表1。以βQ對金屬離子濃度作圖,如圖3所示。
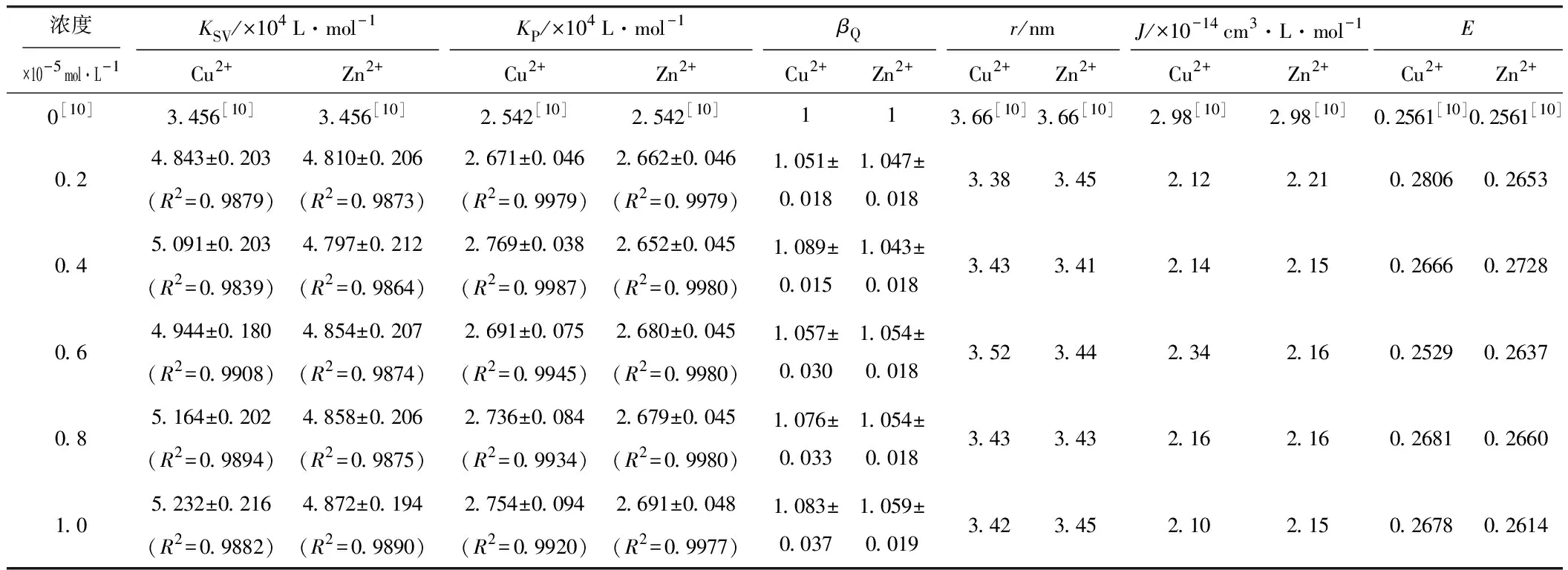
表1 Cu2+/Zn2+存在下,BSA-BC體系的KSV、KP、βQ、r、J、E
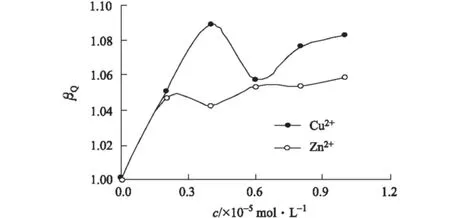
圖3 βQ隨金屬離子濃度的變化關系
由圖3可知,與BSA-BC二元體系比較,金屬離子存在下BSA-BC體系的KP有所增大(即βQ>1),變構劑Cu2+/Zn2+對BC猝滅BSA內源性熒光的過程產生正變構效應,且在低濃度(<0.2×10-5mol·L-1)情況下,變構效應比較明顯;隨著金屬離子濃度的增大,變構效應趨于平緩。與BC作為變構劑不同[9],Cu2+/Zn2+作為變構劑時,其變構效率存在飽和性,即趨于一定值,其原因可能為Cu2+對BSA內源性熒光猝滅效率遠小于BC[10,16],BC一定程度“掩蓋”了Cu2+的變構效應,而Zn2+本身對BSA的內源性熒光不產生猝滅效應[16]。
根據F?rster無輻射的能量轉移理論[17]和變構劑Cu2+/Zn2+存在下BC的紫外可見吸收光譜與BSA的熒光光譜的重疊(圖4),計算變構劑Cu2+/Zn2+存在下BC與BSA熒光性氨基酸殘基之間的空間距離r(K2=2/3,N=1.336,Φ=0.15[10]),結果見表1。
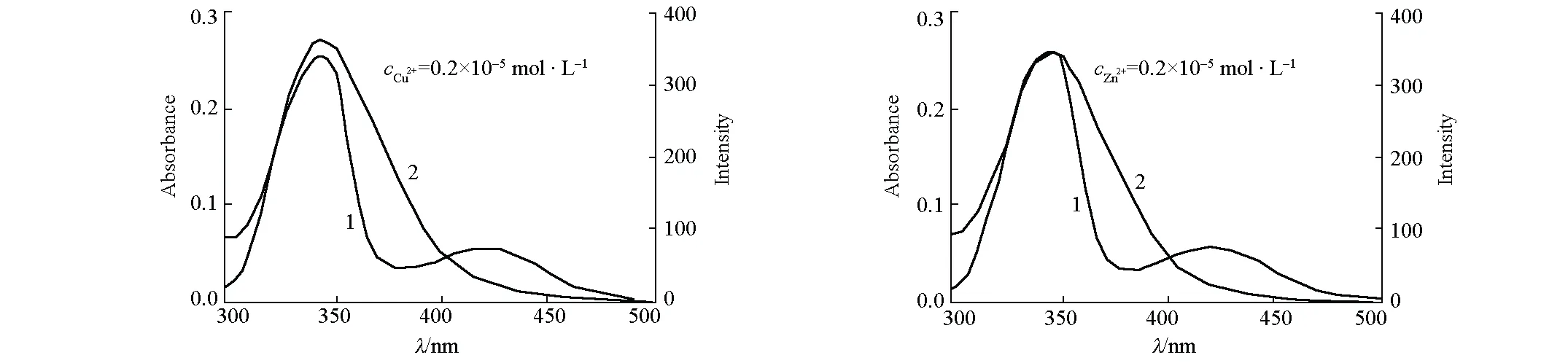
1.UV-Vis of BC 2.FS of BSA cBC=1.0×10-5 mol·L-1 cBSA=1.0×10-5 mol·L-1
由表1可知,有、無Cu2+/Zn2+存在時,r都小于7 nm,表明BC與BSA之間存在非輻射能量轉移,這是發生熒光猝滅的原因之一[17]。與BSA-BC二元體系比較,Cu2+/Zn2+使BSA-BC分子間空間距離r減小,必然導致BC對BSA內源性熒光猝滅能力增強,這可能是Cu2+/Zn2+對BC猝滅BSA內源性熒光過程具有正變構效應的直接原因。此外,與BSA-BC二元體系比較,Cu2+/Zn2+存在下BSA熒光發射光譜與BC紫外可見吸收光譜的重疊積分J有所下降、能量轉移效率E略有上升(表1),說明Cu2+/Zn2+對BC與BSA之間的能量轉移產生了影響。
2.2 Cu2+/Zn2+對BSA-BC復合物穩定性和結合位點數的變構效應
按照式S0/S=KAcBCS0/(S0-S)-nKAcBSA[10],對0.2×10-5mol·L-1Cu2+/Zn2+存在下BSA-BC體系的實驗數據進行處理,得到圖5。
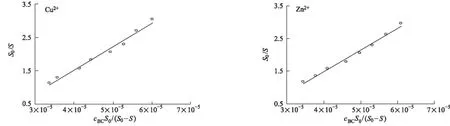
圖5 Cu2+/Zn2+存在下,BSA-BC體系cBCS0/(S0-S)~S0/S的關系曲線
擬合得到線性方程,再由方程的斜率和截距得到表觀結合常數KA和結合位點數n,并定義結合變構系數βA=KA/KA,0、βn=n/n0(其中KA,0、KA和n0、n分別為加入Cu2+/Zn2+前后BSA-BC結合的表觀結合常數和結合位點數)[9],結果見表2。
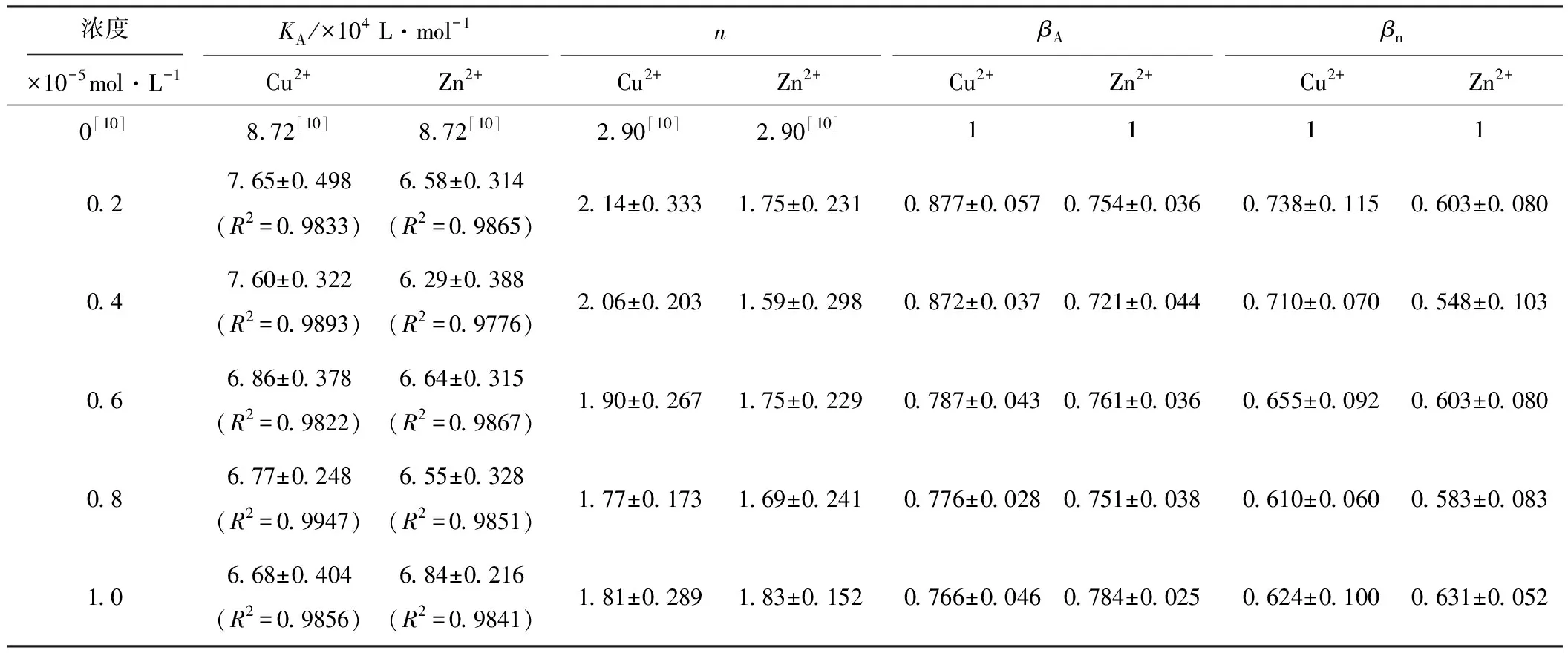
表2 Cu2+/Zn2+存在下,BSA-BC結合過程的表觀結合常數KA、結合位點數n、變構系數βA和βn
由表2可知,0<βA<1和0<βn<1表明Cu2+/Zn2+對BSA-BC復合物穩定性和結合位點數都具有負變構效應,說明Cu2+/Zn2+存在時使BSA-BC復合物穩定性下降,進而使BC在血液中的存儲時間縮短,釋放速度加快,同時其游離濃度增大。KA較BSA-BC二元體系減小,說明加入Cu2+/Zn2+后BC、BSA與金屬離子所形成的三元復合物比BC與BSA形成的二元復合物的穩定性低。
以變構系數βA和βn的數值對所加入Cu2+/Zn2+的濃度作圖,結果見圖6。
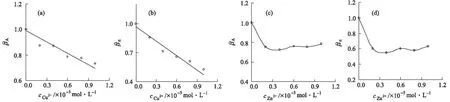
圖6 βA~cCu2+(a)、βn~cCu2+(b)、βA~cZn2+(c)、βn~cZn2+(d)的關系曲線
由圖6可知,變構效應隨兩種變構劑Cu2+、Zn2+濃度的增大呈現不同的變化趨勢:變構劑Cu2+的結合變構系數βA和βn與其濃度總體呈線性關系;而變構劑Zn2+的變構效應呈現飽和性。這可能與兩者在BSA分子上的結合部位不同有關,Cu2+的結合位點為BSA分子中含N、O的氨基酸殘基[18],而Zn2+的結合位點位于BSA分子domain Ⅰ和domain Ⅱ的交界處[19],這可能導致BC的進一步結合受到不同的影響。
通過擬合方程βA=-2.96×104cCu2++0.99(R2=0.9602)、βn=-4.96×104cCu2++0.97(R2=0.9318),計算變構劑Cu2+的變構效率系數[9]γA=(-2.96±0.426)×104L·mol-1、γn=(-4.96±0.950)×104L·mol-1。
可見,γA和γn均為104數量級,且|γn|>|γA|,說明Cu2+對BSA-BC復合物穩定性的變構效率低于其對結合位點數的變構效率;總體呈線性關系說明BSA-BC復合物穩定程度隨Cu2+濃度增大而減弱,此結果與BC作為變構劑時相反[9]。
2.3 變構效應的可能機制
Cu2+/Zn2+存在下,BSA-BC的CD圖譜見圖7,由圖7計算得到的BSA-BC二級結構含量見表3。

cBSA=2.0×10-6 mol·L-1 1~5,nCu2+∶nBSA∶nBC:0∶1∶0,0∶1∶1,1∶1∶1,0.4∶1∶1,0.8∶1∶1 6~10,nZn2+∶nBSA∶nBC:0∶1∶0,0∶1∶1,0.8∶1∶1,0.4∶1∶1,1∶1∶1
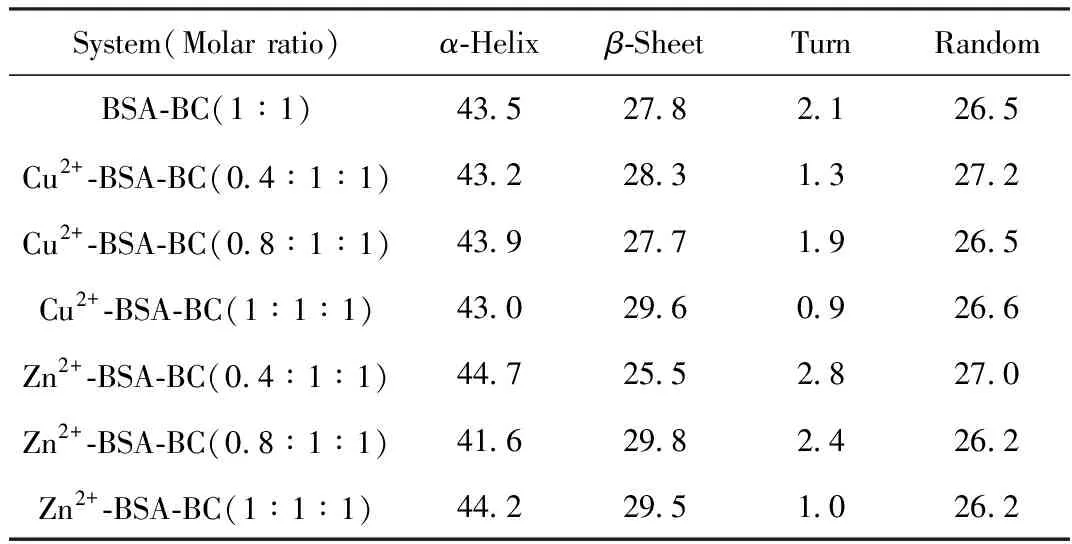
表3 Cu2+/Zn2+存在下,BSA-BC體系二級結構的含量/%
由表3可知,變構劑Cu2+/Zn2+使BSA-BC分子構象中4種二級結構(α-Helix、β-Sheet、Turn和Random)含量均有不同程度的改變,說明與BC類似,Cu2+/Zn2+的變構效應同樣是通過Cu2+/Zn2+與BSA結合進而使BSA構象改變得以實現的。
與BC為變構劑時有所不同,Cu2+-BSA-BC三元體系中BSA分子的β-Sheet含量隨Cu2+濃度增大呈現不規律變化,而Turn結構減少,BSA分子結構一定程度趨于松散,這種構象改變可能是導致BC與BSA分子中熒光性氨基酸殘基間的空間距離r縮小的主要原因,進而使直接熒光猝滅和非輻射能量轉移過程變得相對容易,導致Cu2+對BSA-BC熒光猝滅過程呈正變構效應。而Zn2+-BSA-BC三元體系中,BSA分子構象中4種二級結構含量同樣有不同程度的改變,當Zn2+濃度小于1×10-5mol·L-1時,Turn含量較BSA-BC二元體系略有增加,α-Helix、β-Sheet和Random含量呈現不規律變化;當Zn2+濃度為1×10-5mol·L-1時,Turn含量較BSA-BC二元體系明顯減少,α-Helix、β-Sheet含量增加,這種不規律變化可能是由于Zn2+和BC在BSA分子中的結合位置比較接近(位于domain Ⅰ和domain Ⅱ的交界處)[19],而Zn2+結合后對BSA構象的改變同樣可能導致BC對BSA的直接熒光猝滅和非輻射能量轉移過程變得相對容易,呈現正變構效應。
Cu2+/Zn2+對KA和n呈負變構效應的原因可能也源于BSA分子構象的轉變。因為Cu2+/Zn2+與BSA分子結合后,BSA分子構象發生局部應激改變,使BSA分子中容易與BC結合的疏水空腔受到一定程度的破壞,導致BC與BSA分子的結合變得困難(0<βA<1)、可結合的位點數也有所減少(0<βn<1)。
3 結論
Cu2+/Zn2+對BC猝滅BSA內源熒光呈正變構效應(βQ>1),Cu2+/Zn2+存在下,BC與BSA分子空間距離r的縮小可能是產生正變構效應的直接原因,變構效應隨Cu2+/Zn2+濃度的增大呈現一定的飽和性。Cu2+/Zn2+對BSA-BC復合物穩定性以及BC在BSA分子上的結合位點數呈負變構效應(0<βA<1,0<βn<1),變構效應隨Cu2+/Zn2+濃度的增大呈現不同變化趨勢:其中Zn2+對BSA-BC復合物穩定性以及BC在BSA分子上的結合位點數的變構效應隨Zn2+濃度的增大呈現飽和性,而Cu2+的兩種變構效應總體呈線性關系,且對BSA-BC復合物穩定性的變構效率低于其對結合位點數的變構效率。BSA分子構象轉變可能是產生變構效應的主要原因。
參考文獻:
[1] Chen T T,Cao H,Zhu S J,et al.Investigation of the binding of Salvianolic acid B to human serum albumin and the effect of metal ions on the binding[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2011,81(1):645-652.
[2] Peng M J,Shi S Y,Zhang Y P.The influence of Cd2+,Hg2+and Pb2+on taxifolin binding to bovine serum albumin by spectroscopic methods:With the viewpoint of toxic ions/drug interference[J].Environmental Toxicology and Pharmacology,2012,33(2):327-333.
[3] Shaikh S M T,Seetharamappa J,Kandagal P B,et al.Invitrostudy on the binding of anti-coagulant vitamin to bovine serum albumin and the influence of toxic ions and common ions on binding[J].International Journal of Biological Macromolecules,2007,41(1):81-86.
[4] 余燕敏,馮金朝,劉穎.Fe3+存在下磺胺甲惡唑與牛血清白蛋白相互作用的光譜學研究[J].化學學報,2011,69(2):190-198.
[5] 王騰,何曉囡,董穎,等.布南色林與人血清白蛋白相互作用的光譜學研究[J].分析試驗室,2012,31(1):105-109.
[6] Chen J Z,Hage D S.Quantitative analysis of allosteric drug-protein binding by biointeraction chromatography[J].Nature Biotechnology,2004,22(11):1445-1448.
[7] Wainer I W.Finding time for allosteric interactions[J].Nature Biotechnology,2004,22(11):1376-1377.
[8] Chen J Z,Fitos I,Hage D S.Chromatographic analysis of allosteric effects between ibuprofen and benzodiazepines on human serum albumin[J].Chirality,2006,18(1):24-36.
[9] 劉雪鋒,李磊,方云.牛血清白蛋白-Cu2+結合過程中鹽酸小檗堿的變構效應[J].化學學報,2008,66(17):1967-1973.
[10] Liu X F,Xia Y M,Fang Y.Effect of metal ions on the interaction between bovine serum albumin and berberine chloride extracted from a traditional Chinese Herb coptis chinensis franch[J].Journal of Inorganic Biochemistry,2005,99(7):1449-1457.
[11] Kandagal P B,Ashoka S,Seetharamappa J,et al.Study of the interaction of an anticancer drug with human and bovine serum albumin:Spectroscopic approach[J].Journal of Pharmaceutical and Biomedical Analysis,2006,41(2):393-399.
[12] Kandagal P B,Seetharamappa J,Shaikh S M T,et al.Binding of trazodone hydrochloride with human serum albumin:A spectroscopic study[J].Journal of Photochemistry and Photobiology A:Chemistry,2007,185(2-3):239-244.
[13] 王洋,陳艷萍,張業中.2,4-二氯苯酚與人血清白蛋白相互作用的研究[J].化學與生物工程,2011,28(5):28-33.
[14] Gelamo E L,Tabak M.Spectroscopic studies on the interaction of bovine(BSA) and human serum albumins(HSA) with ionic surfactants[J].Spectrochimica Acta Part A,2000,56(11):2255-2271.
[15] Jiang C Q,Gao M X,Meng X Z.Study of the interaction between daunorubicin and human serum albumin,and the determination of daunorubicin in blood serum samples[J].Spectrochimica Acta Part A,2003,59(7):1605-1610.
[16] 宋琤,梁宏.熒光猝滅法研究Cu(Ⅱ)和Zn(Ⅱ)離子與牛血清白蛋白結合競爭[J].光譜學與光譜分析,2003,23(5):892-894.
[17] Messina P V,Prieto G,Ruso J M,et al.Conformational changes in human serum albumin induced by sodium perfluorooctanoate in aqueous solutions[J].Journal of Physical Chemistry B,2005,109(32):15566-15573.
[18] Bal W,Christodoulou J,Sadler P J,et al.Multi-metal binding site of serum albumin[J].Journal of Inorganic Biochemistry,1998,70(1):33-39.
[19] Stewart A J,Blindauer C A,Berezenko S,et al.Interdomain zinc site on human albumin[J].Proceedings of the National Academy of Sciences of the United States of America,2003,100(7):3701-3706.

