孕酮調(diào)節(jié)乳腺癌耐藥蛋白的機(jī)制研究*
張玉華,李 光,俞 進(jìn),徐妙生,李洪利
(首都醫(yī)科大學(xué)附屬北京天壇醫(yī)院病理科,北京 100050)
乳腺癌耐藥蛋白(breast cancer resistance protein,BCRP/ABCG2/MXP)是一種近來新發(fā)現(xiàn)的多藥耐藥蛋白,屬于ATP結(jié)合盒(adenosine triphosphate-binding cassette,ABC)膜轉(zhuǎn)運(yùn)蛋白超家族[1-2]。作為細(xì)胞膜上的藥物排出泵,可將細(xì)胞毒性藥物轉(zhuǎn)運(yùn)至胞外,BCRP的過表達(dá)可以導(dǎo)致腫瘤細(xì)胞對(duì)多種化療藥物產(chǎn)生耐藥[3-5]。而新近對(duì)BCRP基因啟動(dòng)子的研究發(fā)現(xiàn),在BCRP啟動(dòng)子的上游5'端的區(qū)域具有正性和負(fù)性調(diào)控區(qū)域,并發(fā)現(xiàn)存在一個(gè)孕激素反應(yīng)元件(progesterone response element,PRE)[6-8]。該反應(yīng)元件與乳腺癌細(xì)胞中BCRP的表達(dá)密切相關(guān),因此孕激素可能通過與BCRP啟動(dòng)子上游的PRE結(jié)合,調(diào)控BCRP基因的表達(dá)。近期的研究也顯示了一些能夠調(diào)節(jié)BCRP表達(dá)的藥物,其中包括雌激素的類似物和拮抗劑,但目前對(duì)孕激素調(diào)控BCRP的具體機(jī)制及作用效應(yīng)尚不明確。因此,本實(shí)驗(yàn)選擇孕激素和BCRP基因?yàn)檠芯繉?duì)象,通過藥物誘導(dǎo)或基因轉(zhuǎn)染的方法,建立由BCRP啟動(dòng)子或巨細(xì)胞病毒(cytomegalovirus,CMV)啟動(dòng)子啟動(dòng)表達(dá)BCRP的4種耐藥細(xì)胞系。將孕酮(progesterone,P4)加入耐藥細(xì)胞系的培養(yǎng)液中,觀察其對(duì)不同細(xì)胞系BCRP表達(dá)的影響,并深入探討孕酮對(duì)BCRP基因的效應(yīng)和可能的分子調(diào)控機(jī)制。
材料和方法
1 材料
1.1 細(xì)胞株 人乳腺癌細(xì)胞株P(guān)R陽性的T47D和PR陰性的MDA-MB-231由中國(guó)醫(yī)學(xué)科學(xué)院提供,均來源于美國(guó)國(guó)立癌癥研究所(National Cancer Institute)。
1.2 主要試劑 Progesterone、RU486、G418及四甲基偶氮唑鹽[3-(4,5-dimethythiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]均購自Sigma;pcDNA3載體由本實(shí)驗(yàn)室保存;質(zhì)粒提取試劑盒為Qiagen產(chǎn)品;LipofectamineTM2000試劑盒購自Invitrogen;Trizol reagent和RT-PCR kit為TaKaRa產(chǎn)品;BCRP抗體(BXP-53)購自Abcam;辣根過氧化物酶標(biāo)記的羊抗鼠IgGⅡ抗購自北京中杉生物技術(shù)公司;DMEM和胎牛血清為Gibco產(chǎn)品;引物由上海生工生物公司合成;米托蒽醌(mitoxantrone,MX)購自江蘇恒瑞制藥股份有限公司;二甲基亞砜(dimethyl sulfoxide,DMSO)為啟光試劑公司產(chǎn)品。
2 方法
2.1 細(xì)胞培養(yǎng) 人乳腺癌細(xì)胞株孕酮受體(progesterone receptor,PR)陽性的T47D和PR陰性的MDA-MB-231在含有10%胎牛血清及青霉素、鏈霉素各105U/L的DMEM培養(yǎng)液中常規(guī)培養(yǎng)(37℃、5%CO2)。0.25%胰酶(含0.02%EDTA)混合液消化,每2~3 d傳代1次,取對(duì)數(shù)生長(zhǎng)期細(xì)胞進(jìn)行實(shí)驗(yàn)。
2.2 米托蒽醌誘導(dǎo)耐藥細(xì)胞系T47D/MX和MDA-MB-231/MX的建立 米托蒽醌誘導(dǎo)篩選乳腺癌細(xì)胞T47D和MDA-MB-231,在含有10%胎牛血清的DMEM培養(yǎng)液中加入米托蒽醌,首先起始濃度為8 μg/L,細(xì)胞傳3代后,逐漸增加米托蒽醌的篩選濃度至 20 μg/L、40 μg/L、80 μg/L 和 100 μg/L[9],最終建立由BCRP啟動(dòng)子啟動(dòng)表達(dá)BCRP的2種耐藥細(xì)胞系:PR陽性的T47D/MX和PR陰性的MDA-MB-231/MX。
2.3 脂質(zhì)體Lipofectamine 2000介導(dǎo)質(zhì)粒轉(zhuǎn)染乳腺癌細(xì)胞建立T47D/CMV-BCRP和MDA-MB-231/CMV-BCRP耐藥細(xì)胞系 重組質(zhì)粒pcDNA3-CMV-BCRP含有CMV啟動(dòng)子和野生型BCRP基因,由美國(guó)Marryland大學(xué)的Douglas Ross教授惠贈(zèng),本實(shí)驗(yàn)室保存。將質(zhì)粒pcDNA3-CMV-BCRP轉(zhuǎn)染PR陽性的T47D和PR陰性的MDA-MB-231乳腺癌細(xì)胞系,并經(jīng)350 mg/L G418篩選后,建立由CMV啟動(dòng)子啟動(dòng)表達(dá)BCRP的2種耐藥細(xì)胞系:PR陽性的T47D/CMVBCRP和PR陰性的MDA-MB-231/CMV-BCRP。這2種細(xì)胞作為對(duì)照。
2.4 不同藥物處理細(xì)胞 T47D/MX、T47D/CMV-BCRP、MDA-MB-231/MX和MDA-MB-231/CMV-BCRP 4種細(xì)胞株按常規(guī)方法培養(yǎng)。選對(duì)數(shù)生長(zhǎng)期細(xì)胞用于實(shí)驗(yàn),每株調(diào)整細(xì)胞數(shù)為2×105接種于24孔板,每組設(shè)3個(gè)平行復(fù)孔。實(shí)驗(yàn)分組:(1)空白組:只加細(xì)胞不加藥物;(2)孕酮單獨(dú)作用組:細(xì)胞接種 24 h后,加入不同濃度(10-7mol/L 、10-6mol/L、10-5mol/L)的孕酮繼續(xù)培養(yǎng)96 h;(3)孕酮和RU486聯(lián)合作用組:細(xì)胞接種24 h后,加入10-5mol/L孕酮,48 h后再加入10-5mol/L RU486,繼續(xù)培養(yǎng)48 h。藥物和培養(yǎng)基每24 h更換1次,72 h后收集細(xì)胞進(jìn)行檢測(cè)。
2.5 RT-PCR檢測(cè)BCRP mRNA的表達(dá)水平 UNIQ-10柱式總RNA抽提試劑盒提取實(shí)驗(yàn)組和對(duì)照組細(xì)胞的總RNA,紫外分光光度儀測(cè)定260 nm和280 nm波長(zhǎng)的吸光度值(A),計(jì)算 RNA純度(A260/A280=1.8~2.0)及 RNA 含量。根據(jù)引物分析軟件自行設(shè)計(jì):BCRP引物正義鏈5'-TGGCTGTCATGGCTTCAGTA -3',反義鏈5'-GCCACGTGAT TCTTCCACAA-3',擴(kuò)增片段為235 bp;內(nèi)參照GAPDH引物正義鏈5'-CGGAGTCAACGGATTTGGTCGTAT -3',反義鏈 5'-AGCCTTCTCCATGGTGGTGAAGAC -3',擴(kuò)增片段為 307 bp。逆轉(zhuǎn)錄體系為20 μL,其中含4 μg RNA 樣本,1 μL 隨機(jī)引物,2 μL dNTP混合物,1 μL逆轉(zhuǎn)錄酶,反應(yīng)條件為30℃ 10 min,45℃ 30 min,99℃ 5 min。隨后產(chǎn)物進(jìn)行PCR擴(kuò)增,反應(yīng)體系為 100 μL,其中逆轉(zhuǎn)錄產(chǎn)物5 μL,Tap 酶0.5 μL(5 ×106U/L),BCRP上、下游引物各 10 μL,GAPDH 上、下游引物各 10 μL。95 ℃預(yù)變性3 min,94 ℃ 5 min,95 ℃ 50 s,52 ℃ 30 s,72℃ 1 min,循環(huán)32次,72℃5 min。取PCR產(chǎn)物20 μL進(jìn)行2%瓊脂糖凝膠電泳,凝膠成像系統(tǒng)分析,BCRP指數(shù)=BCRP灰度值/GAPDH灰度值,該指數(shù)與BCRP mRNA的量成正比,進(jìn)行BCRP mRNA表達(dá)水平的半定量分析。
2.6 Western blotting檢測(cè)BCRP蛋白的表達(dá)變化 各組細(xì)胞加入細(xì)胞裂解液,按常規(guī)方法提取細(xì)胞總蛋白,考馬斯亮藍(lán)法測(cè)定蛋白濃度。取50 μg蛋白變性、電泳、轉(zhuǎn)至硝酸纖維素膜,麗春紅染色,5%脫脂牛奶封閉,洗膜后加Ⅰ抗BCRP(1∶1000)或GAPDH(1∶5000)4℃孵育過夜,辣根過氧化物酶(HRP)標(biāo)記的Ⅱ抗IgG(1∶4000)孵育2 h,ECL化學(xué)發(fā)光試劑盒于暗室自顯影。實(shí)驗(yàn)以GAPDH為參照,采用BandScan 5.0軟件測(cè)量特異條帶的灰度值,以目的條帶的灰度值與對(duì)應(yīng)GAPDH灰度值之比表示BCRP蛋白的含量。
2.7 米托蒽醌外排實(shí)驗(yàn)檢測(cè)BCRP的轉(zhuǎn)運(yùn)功能 米托蒽醌是BCRP特異性轉(zhuǎn)運(yùn)的熒光物質(zhì),當(dāng)實(shí)驗(yàn)細(xì)胞的BCRP轉(zhuǎn)運(yùn)功能降低時(shí),米托蒽醌在細(xì)胞內(nèi)聚集,熒光強(qiáng)度高于耐藥細(xì)胞[9]。常規(guī)胰酶、EDTA消化各組細(xì)胞,制備細(xì)胞懸液并轉(zhuǎn)移至24孔板。細(xì)胞培養(yǎng)在含10%胎牛血清的完全培養(yǎng)基DMEM或含有20 μmol/L米托蒽醌和10%胎牛血清的DMEM培養(yǎng)基中,37℃、5%CO2培養(yǎng)箱中孵育30 min。收集實(shí)驗(yàn)組和對(duì)照組細(xì)胞,流式細(xì)胞儀檢測(cè)細(xì)胞內(nèi)米托蒽醌的熒光強(qiáng)度。
3 統(tǒng)計(jì)學(xué)處理
數(shù)據(jù)采用SPSS 16.0統(tǒng)計(jì)軟件進(jìn)行分析處理。每次實(shí)驗(yàn)相同條件重復(fù)3次,實(shí)驗(yàn)數(shù)據(jù)以均數(shù)±標(biāo)準(zhǔn)差()表示。多樣本均數(shù)之間的比較采用方差分析,以P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
結(jié) 果
1 孕酮對(duì)不同細(xì)胞組BCRP基因mRNA表達(dá)的影響
RT-PCR結(jié)果顯示,與未處理組相比,孕酮以劑量依賴方式增強(qiáng)BCRP mRNA的表達(dá),孕酮處理組在濃度10-7、10-6和10-5mol/L時(shí),T47D/MX細(xì)胞中BCRP mRNA的條帶明顯增強(qiáng),表達(dá)水平上調(diào),分別是未處理組的2.64倍(P<0.05)、4.71倍(P <0.05)和 7.95倍(P <0.01)倍,見圖 1A;10-5mol/L孕酮和10-5mol/L RU486聯(lián)合處理組,T47D/MX細(xì)胞中BCRP mRNA的表達(dá)水平顯著低于10-5mol/L孕酮單獨(dú)處理組(處理前后相對(duì)BCRP mRNA表達(dá)率:231.8% ±2.4%vs 74.9% ±1.3%,P<0.01),見圖1A。這提示孕酮對(duì) BCRP mRNA表達(dá)的增強(qiáng)效應(yīng),可被其拮抗劑RU486阻斷,兩藥之間存在拮抗作用。而對(duì)照組T47D/CMV-BCRP細(xì)胞,處理前后細(xì)胞中BCRP mRNA的表達(dá)水平無明顯差異(P>0.05),見圖1B;且對(duì)照組MDA-MB-231/MX和MDA-MB-231/CMV-BCRP細(xì)胞,各組處理前后相比,BCRP mRNA表達(dá)量無明顯變化,差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。
2 孕酮對(duì)不同細(xì)胞組BCRP蛋白表達(dá)的影響
Western blotting結(jié)果顯示,與未處理組相比,10-7、10-6和10-5mol/L孕酮以劑量依賴方式增強(qiáng)T47D/MX細(xì)胞中BCRP蛋白的表達(dá),增加倍數(shù)分別為1.94(P<0.05)、4.65(P<0.05)和7.02(P <0.01),見圖 2A;10-5mol/L 孕酮和 10-5mol/L RU486聯(lián)合處理組,T47D/MX細(xì)胞中BCRP蛋白的相對(duì)表達(dá)水平為46.2% ±1.3%,明顯低于10-5mol/L孕酮單獨(dú)處理組(相對(duì) BCRP蛋白表達(dá)率:147.9% ±3.2%,P<0.01),見圖2A,兩藥之間存在拮抗作用。而對(duì)照組T47D/CMV-BCRP細(xì)胞,處理前后細(xì)胞中BCRP蛋白的相對(duì)表達(dá)水平無明顯差異(P>0.05),見圖2B;且對(duì)照組MDA-MB-231/MX和MDA-MB-231/CMV-BCRP細(xì)胞,處理方法同前,各組處理前后相比,BCRP蛋白的含量無明顯改變,差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。
3 孕酮對(duì)不同細(xì)胞組BCRP轉(zhuǎn)運(yùn)功能的影響
米托蒽醌是BCRP的特異性轉(zhuǎn)運(yùn)底物,常用于檢測(cè)BCRP的外排功能。米托蒽醌外排實(shí)驗(yàn)結(jié)果顯示,與未處理組相比,10-5mol/L孕酮單獨(dú)處理組,T47D/MX細(xì)胞內(nèi)米托蒽醌熒光強(qiáng)度顯著降低,峰值左移,見圖3A,外排米托蒽醌的能力升高了41.7%(處理前后相對(duì)米托蒽醌熒光強(qiáng)度:100.0%,141.7% ±6.4%,P <0.05),見圖 3A、表1;10-5mol/L 孕酮和10-5mol/L RU486聯(lián)合處理后,T47D/MX細(xì)胞內(nèi)的米托蒽醌熒光強(qiáng)度明顯高于孕酮單獨(dú)處理組,峰值右移,見圖3A,外排米托蒽醌的能力降低了20.3%(處理前后相對(duì)米托蒽醌熒光強(qiáng)度:141.7% ±6.4%vs 112.9% ±5.2%,P <0.05),見圖3A、表1,兩藥之間存在拮抗作用;而對(duì)照組T47D/CMV-BCRP、MDA-MB-231/MX和MDA-MB-231/CMV-BCRP細(xì)胞,各組處理前后相比,細(xì)胞中米托蒽醌熒光強(qiáng)度無明顯改變(P>0.05),見圖3B、表1。
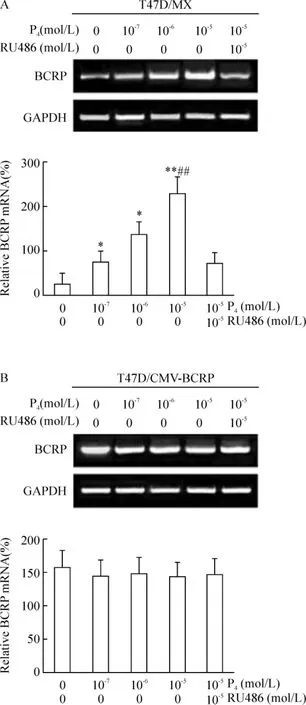
Figure 1.Effects of progesterone on BCRP mRNA expression in T47D/MX and T47D/CMV-BCRP cells..n=3.*P <0.05,**P <0.01 vs control(0 mol/L P4+0 mol/L RU486);##P<0.01 vs 10-5mol/L P4+10-5 mol/L RU486.圖1 孕酮對(duì)T47D/MX和T47D/CMV-BCRP細(xì)胞BCRP mRNA表達(dá)的影響
討 論
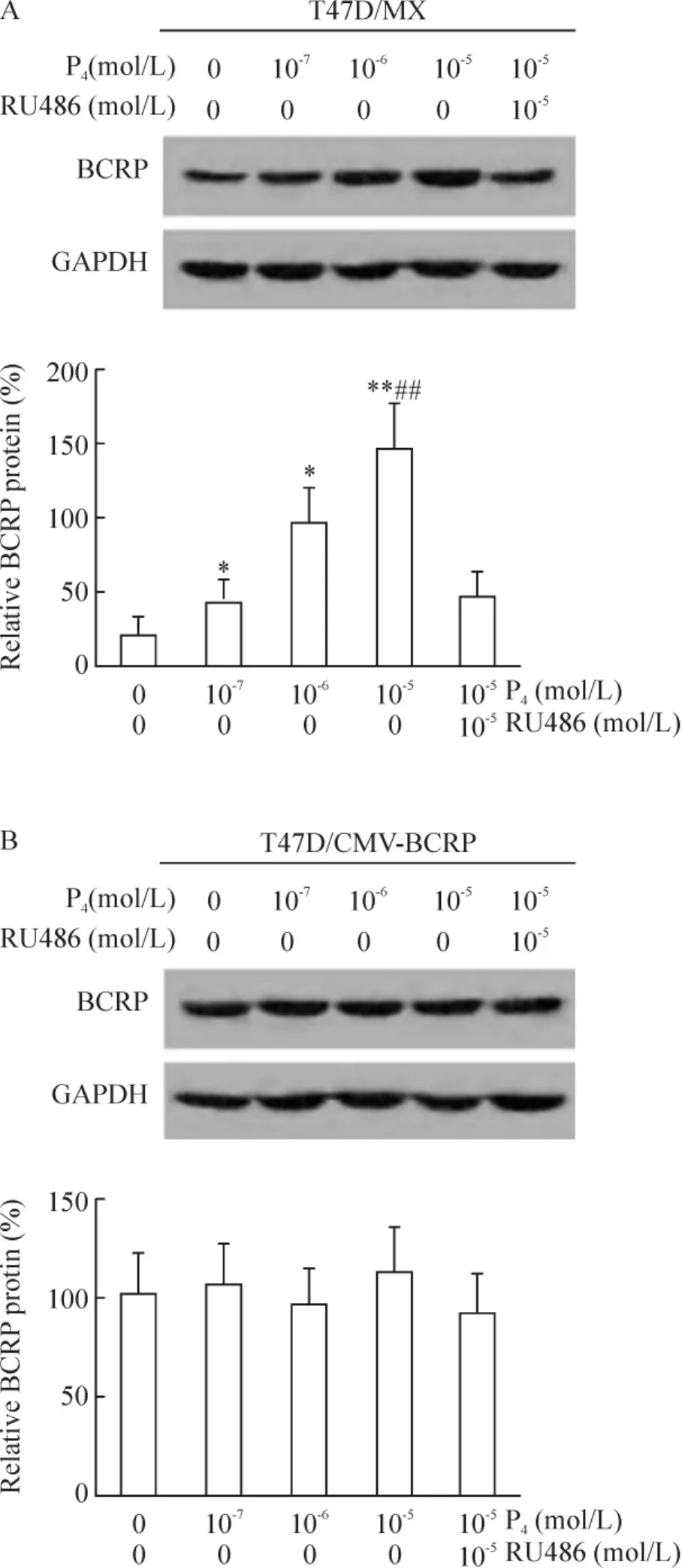
Figure 2.Effects of progesterone on BCRP protein expression in T47D/MX and T47D/CMV-BCRP cells..n=3.*P <0.05,**P <0.01 vs control(0 mol/L P4+0 mol/L RU486);##P<0.01 vs 10-5mol/L P4+10-5 mol/L RU486.圖2 孕酮對(duì)T47D/MX和T47D/CMV-BCRP細(xì)胞BCRP蛋白表達(dá)的影響
BCRP是新近發(fā)現(xiàn)的與腫瘤多藥耐藥相關(guān)的一種跨膜轉(zhuǎn)運(yùn)蛋白,與P-糖蛋白(P-glycoprotein,P-gp)同屬于ABC轉(zhuǎn)運(yùn)蛋白超家族。ABC轉(zhuǎn)運(yùn)蛋白是一種能量依賴性藥物排出泵,消耗ATP將細(xì)胞內(nèi)的藥物泵出,減少細(xì)胞內(nèi)藥物濃度,降低藥物對(duì)腫瘤的殺傷作用。高表達(dá)BCRP的腫瘤細(xì)胞株對(duì)米托蒽醌、阿霉素、柔紅霉素等多種化療藥物可產(chǎn)生交叉耐藥[3-5],該蛋白在多藥耐藥方面逐漸引人關(guān)注。人類的BCRP基因首次在乳腺癌耐藥細(xì)胞株MCF-7/AdrVp的DNA文庫中發(fā)現(xiàn)而命名,定位于染色體4q22區(qū)域,含有1個(gè)開放閱讀框架。BCRP基因的轉(zhuǎn)錄產(chǎn)物mRNA長(zhǎng)約2.4 kb,編碼655個(gè)氨基酸殘基、72.6 kD的蛋白質(zhì)。BCRP蛋白僅含有1個(gè)跨膜區(qū)域和1個(gè)ATP結(jié)合位點(diǎn),在空間結(jié)構(gòu)上僅相當(dāng)于完全轉(zhuǎn)運(yùn)蛋白P-gp分子的一半,故稱為半轉(zhuǎn)運(yùn)蛋白[10]。因此,有學(xué)者認(rèn)為BCRP是耐藥蛋白的基本結(jié)構(gòu),了解BCRP的作用機(jī)制對(duì)于研究其它耐藥蛋白大有幫助。
近來有研究報(bào)道,孕激素、雌激素的類似物或拮抗劑可以逆轉(zhuǎn)K562/BCRP細(xì)胞中BCRP介導(dǎo)的多藥耐藥,如孕酮、雌二醇、三苯氧胺[11-12],其機(jī)制可能是作為BCRP的底物,競(jìng)爭(zhēng)性抑制BCRP與其它抗腫瘤藥物結(jié)合。2004年,Ee等[7]發(fā)現(xiàn)在BCRP基因啟動(dòng)子區(qū)的5'端側(cè)翼序列的-243至-115之間含有1個(gè)雌激素反應(yīng)元件(estrogen response element,ERE)結(jié)構(gòu),該反應(yīng)元件與乳腺癌細(xì)胞中BCRP的表達(dá)密切相關(guān)。而最新分析認(rèn)為[8],胎盤絨毛膜細(xì)胞癌中BCRP啟動(dòng)子區(qū)的ERE同時(shí)也是一個(gè)PRE,孕酮可能通過PR與BCRP啟動(dòng)子區(qū)的PRE相結(jié)合,增強(qiáng)BCRP的表達(dá)。關(guān)于孕激素對(duì)BCRP基因的具體作用機(jī)制及影響,以往的研究報(bào)道缺乏一致性結(jié)果。因此,孕激素及其受體在BCRP表達(dá)調(diào)控中的作用過程、影響因素及綜合效應(yīng)目前尚不十分清楚。
我們前期實(shí)驗(yàn)顯示,托瑞米芬可通過ERα介導(dǎo)抑制BCRP基因的啟動(dòng)子而減弱BCRP轉(zhuǎn)錄活性,降低ERα陽性乳腺癌細(xì)胞中BCRP mRNA和蛋白的表達(dá)水平,進(jìn)而逆轉(zhuǎn)BCRP 介導(dǎo)的多藥耐藥[13]。
本實(shí)驗(yàn)通過藥物誘導(dǎo)和基因轉(zhuǎn)染的方法,作用于孕激素受體陽性的T47D和PR陰性的MDA-MB-231乳腺癌細(xì)胞系,成功建立了分別由含PRE的BCRP啟動(dòng)子和不含PRE的CMV啟動(dòng)子啟動(dòng)表達(dá)BCRP的4種耐藥細(xì)胞系T47D/MX、T47D/CMV-BCRP、MDA-MB-231/MX和MDA-MB-231/CMV-BCRP,觀察孕酮對(duì)不同的乳腺癌耐藥細(xì)胞系BCRP表達(dá)的影響,尚未見相關(guān)報(bào)道。
本研究結(jié)果發(fā)現(xiàn),孕酮能夠在轉(zhuǎn)錄水平明顯增強(qiáng)T47D/MX細(xì)胞中BCRP mRNA的表達(dá),但卻不能抑制T47D/CMVBCRP、MDA-MB-231/MX和MDA-MB-231/CMVBCRP細(xì)胞中BCRP mRNA的表達(dá)水平。分析存在差異的原因:前者T47D/MX細(xì)胞中BCRP的表達(dá)是由含PRE的BCRP啟動(dòng)子啟動(dòng)表達(dá),且細(xì)胞是PR陽性的;而后者T47D/CMVBCRP細(xì)胞中BCRP表達(dá)是由不含PRE的CMV啟動(dòng)子啟動(dòng)表達(dá);且 MDA-MB-231/MX和 MDA-MB-231/CMVBCRP細(xì)胞是PR陰性的。這提示,孕酮不是作為BCRP的底物調(diào)節(jié)其功能,而可能是通過PR的介導(dǎo)與BCRP啟動(dòng)子區(qū)的PRE序列結(jié)合,激活BCRP基因啟動(dòng)子而增強(qiáng)BCRP基因mRNA的轉(zhuǎn)錄。本研究通過Western blotting測(cè)定了BCRP蛋白的表達(dá)水平,米托蒽醌外排實(shí)驗(yàn)檢測(cè)了BCRP的轉(zhuǎn)運(yùn)功能。結(jié)果顯示,孕酮顯著上調(diào)PR陽性乳腺癌細(xì)胞中BCRP蛋白的表達(dá),明顯升高細(xì)胞外排米托蒽醌的能力。
然而,由于PR亞型PRA和PRB受體的存在,并可通過PRE與AP1位點(diǎn)2種方式介導(dǎo)信號(hào)轉(zhuǎn)導(dǎo),使得PR介導(dǎo)的信號(hào)轉(zhuǎn)導(dǎo)過程更為復(fù)雜。在孕酮調(diào)控BCRP的過程中,是以某一種信號(hào)轉(zhuǎn)導(dǎo)通路為主還是幾種信號(hào)轉(zhuǎn)導(dǎo)通路共同發(fā)揮作用?幾種信號(hào)轉(zhuǎn)導(dǎo)通路之間是否存在相互影響?尚未見報(bào)道,將成為今后深入研究的方向。
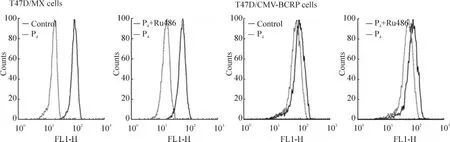
Figure 3.Effects of progesterone on the intracellular accumulation of mitoxantrone in T47D/MX and T47D/CMV -BCRP cells.圖3 孕酮對(duì)T47D/MX和T47D/CMV-BCRP細(xì)胞BCRP轉(zhuǎn)運(yùn)功能的影響
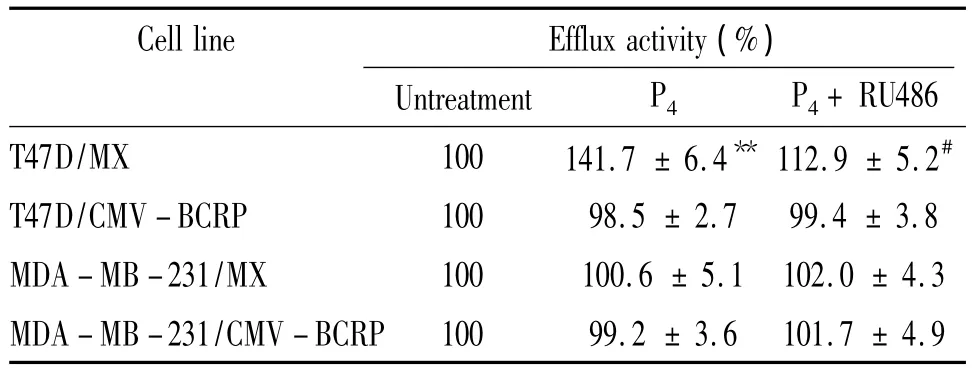
表1 孕酮對(duì)各組細(xì)胞BCRP外排米托蒽醌的影響Table 1.Effects of progesterone on BCRP-mediated mitoxantrone efflux activity
[1]Ejendal KF,Hrycyna CA.Multidrug resistance and cancer:the role of the human ABC transporter ABCG2[J].Curr Protein Pept Sci,2002,3(5):503 -511.
[2]Rocchi E,Khodjakov A,Volk EL,et al.The product of the ABC half-transporter gene ABCG2(BCRP/MXR/ABCP)is expressed in the plasma membrane[J].Biochem Biophys Res Commun,2000,271(1):42-46.
[3]Volk EL,Schneider E.Wild-type breast cancer resistance protein(BCRP/ABCG2)is a methotrexate polyglutamate transporter[J].Cancer Res,2003,63(17):5538 -5543.
[4]Kawabata S,Oka M,Shiozawa K,et al.Breast cancer resistance protein directly confers SN-38 resistance of lung cancer cells[J].Biochem Biophys Res Commun,2001,280(5):1216-1223.
[5]Allen JD,Brinkhuis RF,Wijnholds J,et al.The mouse Bcrp1/Mxr/Abcp gene:amplification and overexpression in cell lines selected for resistance to topotecan,mitoxantrone,or doxorubicin[J].Cancer Res,1999,59(17):4237-4241.
[6]Bailey - Dell KJ,Hassel B,Doyle LA,et al.Promoter characterization and genomic organization of the human breast cancer resistance protein(ATP-binding cassette transporter G2)gene[J].Biochi Biophys Acta,2001,1520(3):234-241.
[7]Ee PL,Kamalakaran S,Tonetti D,et al.Identification of a novel estrogen response element in the breast cancer resistance protein(ABCG2)gene[J].Cancer Res,2004,64(4):1247-1251.
[8]Wang H,Lee EW,Zhou L,et al.Progesterone receptor(PR)isoforms PRA and PRB differentially regulate expression of the breast cancer resistance protein in human placental choriocarcinoma BeWo cells[J].Mol Pharmacol,2008,73(3):845 -854.
[9]Robey RW,Honjo Y,van de Laar A ,et al.A functional assay for detection of the mitoxantrone resistance protein,MXR(ABCG2)[J].Biochim Biophys Acta,2001,1512(2):171-182.
[10]Allikmets R,Schriml LM,Hutchinson A,et al.A human placenta-specific ATP-binding cassette gene(ABCG)on chromosome 4q22 that is involved in multidrug resistance[J].Cancer Res,1998,58(23):5337 - 5339.
[11]Imai Y,Tsukahara S,Ishikawa E,et al.Estrone and 17β-estradiol reverse breast cancer resistance protein-mediated multidrug resistance[J].Jpn J Cancer Res,2002,93(3):231-235.
[12]Sugimoto Y,Tsukahara S,Imai Y,et al.Reversal of breast cancer resistance protein-mediated drug resistance by estrogen antagonists and agonists[J].Mol Cancer T-her,2003,2(1):105 -112.
[13]Zhang YH,Wang HP,Wei LJ,et al.Transcriptional modulation of BCRP gene to reverse multidrug resistance by toremifene in breast carcinoma cells[J].Breast Cancer Res Treat,2010,123(3):679 -689.
- 中國(guó)病理生理雜志的其它文章
- 神經(jīng)生長(zhǎng)因子通過TrkANGFR信號(hào)途徑促進(jìn)肝細(xì)胞增殖*
- 中國(guó)病理生理學(xué)會(huì)2011年度工作總結(jié)
- 小鼠早期完整胚胎誘導(dǎo)子宮內(nèi)膜白血病抑制因子和整合素β3表達(dá)并提高子宮容受性*
- 干擾素誘導(dǎo)蛋白p204表達(dá)變化對(duì)大鼠血管平滑肌細(xì)胞增殖及p21表達(dá)的影響*
- 孕酮對(duì)氧糖剝奪損傷的PC12細(xì)胞的保護(hù)作用*
- 炎癥對(duì)脂肪酸負(fù)荷的腎細(xì)胞FAT/CD36表達(dá)的影響*

