Survivin-siRNA真核重組質粒對前列腺癌移植瘤的抑制作用*
郭 鵬, 沈維高, 趙麗晶, 閆喜惠, 劉艷波, 趙雪儉△
(北華大學1附屬醫院腎病風濕病科,2基礎醫學院病理生理學教研室,吉林 吉林 132013;3吉林大學前列腺疾病防治研究中心,吉林 長春 132001)
凋亡抑制基因survivin是1997年分選出來的一個新基因。人類survivin基因定位于染色體17q25,長約75~130 kb,含3個內含子和4個外顯子,無TATA啟動子結構,其編碼鏈包含1個開放閱讀框架,產生由142個氨基酸組成的分子量約16.6 kD的胞質蛋白[1]。Survivin在大多數人類腫瘤中均有高表達,前列腺癌也不例外,且與前列腺癌的發生、發展關系密切[2],其表達強度和前列腺癌細胞凋亡呈負相關[3]。RNA干擾可作為引物使mRNA轉變成dsRNA,新生的dsRNA被降解,在消除靶mRNA同時又產生更多的siRNA,如此循環[4]。因此siRNA具有特異性、作用效率較高和干擾作用可擴散等特點,具有很強的抑制目的基因表達的作用。本課題組前期工作表明,針對survivin靶點的siRNA重組質粒體外明顯抑制激素非依賴性前列腺癌DU145細胞生長并促進其凋亡[5],本實驗主要研究survivin-siRNA是否具有體內抑瘤效應,并簡要探討其作用機制。
材料和方法
1 材料
人激素非依賴性前列腺癌DU145細胞株,由吉林大學前列腺疾病防治研究中心饋贈;大腸桿菌JM109為該中心保存;survivin-siRNA及對照質粒構建及鑒定按本課題組以前方法[5];DNA純化試劑盒、DNA提取試劑盒為上海華舜生物工程有限公司產品;IMDM培養基為HyClone生產,新生牛血清購自北京鼎國公司;兔抗人survivin抗體及羊抗兔Ⅱ抗購自 Santa Cruz,臺盼藍購自 Sigma,K-PBS溶液(NaCl 30.8 mmol/L、KCl 20.7 mmol/L、Na2HPO48.1 mmol/L、KH2PO41.46 mmol/L、MgCl210 mmol/L 溶解于雙蒸水)為自制;TUNEL染色試劑盒購自南京建成生物試劑公司;其它試劑為進口或國產分析純;ECM830電轉染儀購自BTX。
2 動物
裸鼠購自中國醫學科學院實驗動物研究所。BALB/c nu/nu雄性裸鼠,15只,4~6周齡,體重18~20 g,飼養于恒定溫度(22~25℃)、恒定濕度(40% ~50%)的SPF層流室中,經高壓滅菌的標準飼料和水供動物自由食用。
3 方法
3.1 裸鼠動物模型的建立及處理 將DU145細胞用胰蛋白酶消化成細胞懸液,離心,細胞團塊在IMDM培養液中吹散,經臺盼藍實驗證實細胞活力≥95%,最終細胞濃度為2.5×1010cells/L,取5×106個細胞(0.2 mL)接種于裸鼠左側背部皮下。待移植瘤長至直徑8 mm時將瘤無菌條件下取出,分成直徑約2 mm的瘤塊植入另取的15只裸鼠皮下。質粒溶解于K-PBS溶液中,定量,調節質粒濃度為1 g/L。待移植瘤長至直徑約8 mm時將裸鼠隨機分為3組,每組5只動物,mock組注射20 μL K-PBS;scrambled siRNA及survivin-siRNA進行質粒治療(每只20 μg);在注射結束后于注射局部實行電轉染。電脈沖治療儀的參數設定:電場強度500 V/cm,脈沖時值5 μs,次數2次,頻率1 Hz。兩排銀電極插入腫瘤組織兩側,使腫瘤位于電極中央。10 d后重復注射質粒1次。
3.2 腫瘤觀察及測量 每天觀察裸鼠各種生活變化,每隔5 d測量腫瘤的長徑(length,L)和短徑(width,W),根據公式 V=L×W2×0.52計算腫瘤的體積,繪制腫瘤的生長曲線并計算抑瘤率(inhibitory rate,IR),IR(%)=(1-治療組瘤重/對照組瘤重)×100%。
3.3 腫瘤標本處理 在初次電轉染25 d后頸椎脫臼處死裸鼠,迅速剪開皮膚,完整剝離腫塊,稱重,部分組織甲醛溶液固定。
3.4 病理學檢查 取10%甲醛固定后的組織,石蠟包埋,4 μm連續切片分別行HE染色和survivin免疫組織化學染色。每張切片觀察3個視野,每個視野連續數300個細胞,計算陽性細胞百分比。陽性細胞百分比=陽性細胞數/總細胞數×100%。結果判定:survivin在腫瘤細胞胞漿或細胞間質內出現棕黃色顆粒,且著色強度高于背景非特異性染色者判定為陽性。
3.5 TUNEL法檢測腫瘤細胞凋亡 切片常規脫蠟入水,新鮮配制的3%H2O2室溫處理10 min,蒸餾水洗2 min×3次。標本用proteinase K 37℃消化15 min,加標記緩沖液,每片20 μL;然后加稀釋的 TdT和DIG-dUTP混合液,37℃孵育2 h。TBS洗2 min×3次。加封閉液每片 50 μL,室溫 30 min,不洗。再加入生物素化抗地高辛抗體于標本片上,37℃反應30 min。TBS洗2 min×3次。加稀釋的SABC染色60 min,TBS洗5 min×3次。DAB顯色,蘇木素輕度復染,脫水,透明,封片,顯微鏡觀察。
細胞核染為棕黃色者即為凋亡細胞,每張切片觀察3個視野,每個視野連續數300個細胞,計數凋亡細胞百分比即為凋亡指數(apoptotic index,AI)。AI(%)=凋亡細胞數/總細胞數×100%。
4 統計學處理
結 果
1 腫瘤體積監測
裸鼠背部皮下注射DU145細胞后可成功復制出荷瘤動物模型,然后將腫瘤組織取下,分成約2 mm×2 mm×2 mm小塊接種背部,待移植瘤長至直徑約8 mm,平均體積約(161.5±14.4)mm3時,隨機分為3組,每組5只動物,并進行治療,10 d后重復給藥1次。從種植瘤塊當天開始連續觀察腫瘤的生長情況,并繪制各組裸鼠腫瘤的生長曲線圖,見圖1。與mock組及scrambled siRNA組相比,survivin-siRNA治療組動物移植瘤生長較緩慢,初次治療后15 d,腫瘤體積明顯縮小(P<0.05);且隨時間延長,治療組動物腫瘤生長顯著減慢(P<0.01)。于初次電轉染25 d(即瘤塊接種后35 d)處死動物取移植瘤稱重,與兩對照組相比,治療組移植瘤重量明顯減輕(P<0.01),見表 1。
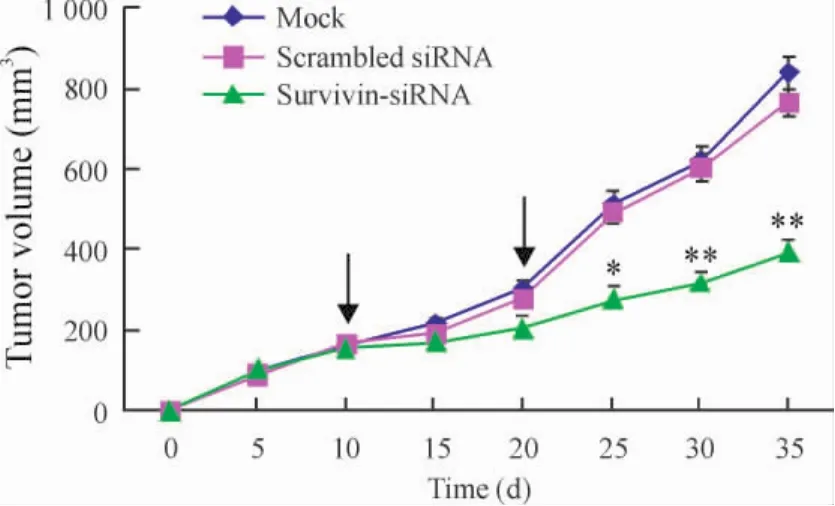
Figure1.Growth curves of DU145 xenografts treated with survivin-siRNA.Each treatment with the plasmid is shown using an arrow..n=5.*P<0.05,**P<0.01 vs mock or scrambled siRNA.圖1 Survivin-siRNA對裸鼠腫瘤生長曲線的影響
表1 Survivin-siRNA對前列腺癌移植瘤重量的影響Table1.The effect of survivin-siRNA on xenograft weight(g..n=5)

表1 Survivin-siRNA對前列腺癌移植瘤重量的影響Table1.The effect of survivin-siRNA on xenograft weight(g..n=5)
**P <0.01 vs mock or scrambled siRNA.
Group Weight Mock 1.64 ±0.46 Scrambled siRNA 1.67 ±0.33 Survivin-siRNA 0.62 ±0.14**
2 腫瘤組織形態學變化
HE染色顯示,兩對照組動物腫瘤生長旺盛,細胞核較大深染,而治療組與兩對照組相比,瘤組織內死亡細胞較多,細胞崩解為碎片,細胞核固縮碎裂,正常組織結構消失,呈現無結構嗜伊紅染色區等形態學改變,見圖2。
3 腫瘤組織survivin表達
由圖3可知,survivin表達的陽性顆粒主要位于腫瘤細胞的胞漿內,少數位于細胞核和間質中。Mock組陽性細胞為(67.2±11.3)%,scrambled siRNA組陽性細胞為(71.2±8.91)%,而survivin-siRNA組其表達明顯降低,陽性率為(31.2±8.3)%,與兩對照組比較差異顯著(P<0.01)。
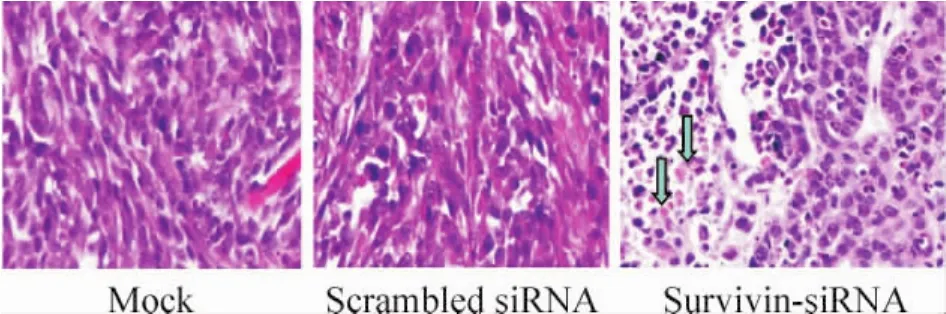
Figure2.HE staning for DU145 xenografts treated with survivin-siRNA(×200).Blue arrows represent death cells.圖2 前列腺癌移植瘤HE染色結果
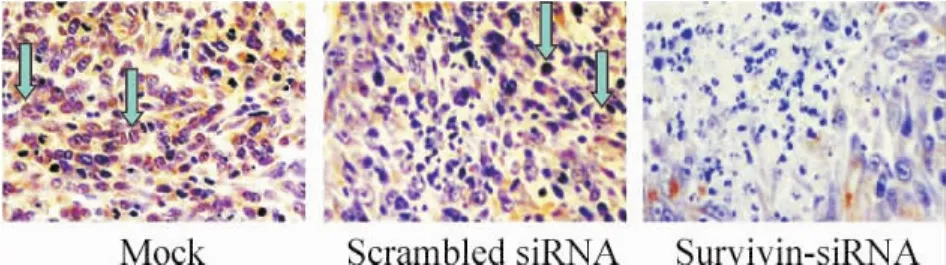
Figure3.Immunohistochemical analysis of survivin expression inDU145 xenografts treated with survivin-siRNA( × 200) . Blue arrows represent survivin - positivecells.圖3 前列腺癌移植瘤survivin免疫組織化學染色結果
4 腫瘤細胞凋亡檢測
治療組腫瘤組織內見大量細胞核染為棕黃色的凋亡細胞,而兩對照組僅見少許凋亡細胞,見圖4。如表2所示,治療組細胞凋亡指數明顯高于對照組(P <0.01)。
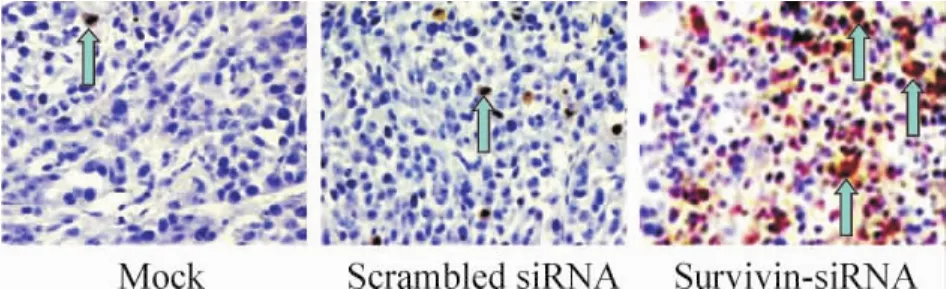
Figure4.Apoptosis of DU145 xenografts treated with survivinsi RNA detedcted by TUNEL assay(×200).Blue arrows represent apoptotic cells.圖4 TUNEL染色檢測前列腺癌移植瘤細胞凋亡情況
表2 Survivin-siRNA對DU145細胞移植瘤凋亡指數的影響Table2.Apoptotic index(AI)of DU145 xenografts treated with survivin-siRNA(%..n=5)

表2 Survivin-siRNA對DU145細胞移植瘤凋亡指數的影響Table2.Apoptotic index(AI)of DU145 xenografts treated with survivin-siRNA(%..n=5)
**P <0.01 vs mock or scrambled siRNA.
Group AI Mock 4.13 ±1.71 Scrambled siRNA 5.64 ±1.32 Survivin -siRNA 27.90 ±5.91**
討 論
Survivin作為新的凋亡抑制因子,其獨特的組織表達特異性及促進增殖、抑制凋亡等生物學功能受到國內外學者廣泛關注。圍繞survivin的分子生物學特點、生物學功能,特別是在細胞凋亡中的作用進行了一系列研究,證實survivin是一個多功能的分子[6]。其功能主要包括:(1)在染色體過客蛋白復合物中定位和有絲分裂中起關鍵作用;(2)survivin通過caspase和非caspase途徑對腫瘤細胞凋亡進行調控;(3)survivin在腫瘤細胞中的表達情況與腫瘤的放、化療抵抗關系密切,某些藥物可通過抑制survivin的表達發揮抗癌效應。根據現有的研究,其抗凋亡作用及在腫瘤發生、發展中的作用已經逐步得到肯定[7]。此外,腫瘤細胞中survivin過表達會幫助腫瘤細胞逃避細胞周期檢驗點,從而使腫瘤細胞逃避凋亡,實現異常增殖。Zhang等[8]研究發現,用雄激素刺激激素依賴性前列腺癌細胞(LNCaP)能夠增加survivin的表達,相反,抗激素治療會降低其表達。通過轉染增加survivin的表達還會降低抗雄激素藥物的治療效果。進一步研究發現[9],在LNCaP和激素非依賴性前列腺癌細胞(PC-3和DU145)過表達survivin會增加對紫杉醇(抗腫瘤藥)的抗性等。
本課題組應用真核細胞轉染技術將特異性survivin-siRNA表達質粒轉染前列腺癌DU145細胞株,發現該質粒可促進細胞凋亡并抑制細胞內survivin基因及蛋白表達[10],為體內研究奠定了堅實基礎。本實驗復制裸鼠前列腺癌皮下移植瘤模型,并在腫瘤內注射了DNA,但裸DNA轉染效率低,抑制靶蛋白表達作用不理想。其主要原因可能有:(1)DNA必須穿過細胞膜;(2)DNA到達細胞內后,需通過核膜進入細胞核。因而嚴重阻礙了該技術的進一步應用。如何提高siRNA的抑制效率,尋找更有效的體內基因轉染手段,日益受到重視。電脈沖介導的基因轉染方法,克服了病毒載體容量小、具有安全隱患等問題。所謂電脈沖法是將組織置于高壓脈沖電場內,在注射部位給予短時間的電脈沖,通過電刺激,使細胞膜產生可逆性穿孔,促使腫瘤周圍DNA滲進細胞內,易于獲得更多的DNA質粒到細胞質,但目前尚不清楚是否電刺激有利于質粒穿過細胞核屏障到達細胞核內[11]。但有研究表明,電脈沖基因轉染效率較單純注射質粒基因轉染效率提高近50倍,并可持續表達,最長可持續6個月以上[12]。本實驗利用電脈沖方法將治療質粒及對照質粒轉染腫瘤細胞內,結果證實:與兩對照組相比,survivin-siRNA組在初次治療后15 d腫瘤體積與對照組相比具有統計學意義(P<0.05),隨著治療時間的延長,平均瘤體積和瘤重量均明顯降低(P<0.01)。這說明電脈沖介導的基因體內治療方法可行,并具備安全、簡單、經濟等優點,具有實際應用前景。
通過HE染色和TUNEL染色發現,治療組腫瘤細胞發生明顯凋亡,凋亡指數明顯升高;免疫組織化學染色發現,survivin-siRNA重組質粒降低腫瘤組織內survivin蛋白表達,說明survivin-siRNA抑制腫瘤生長是通過促進細胞凋亡實現的,但具體的凋亡途徑還需進一步探討。
[1]Li F,Abmrosini G,Chu EY,et al.Control of apoptosis and mitotic spindle checkpoint by survivin[J].Nature,1998,396(6711):580 -584.
[2]劉艷波,沈維高,葛 賀.等.Survivin和GRIM-19在前列腺癌組織中的表達[J].中華男科學雜志,2011,17(12):21-26.
[3]Al-Maghrebi M,Kehinde EO,Anim JT,et al.The role of combined measurement of tissue mRNA levels of AMACR and survivin in the diagnosis and risk stratification of patients with suspected prostate cancer[J].Int Urol Nephrol,2012,44(6):1681-1689.
[4]孔祥平.核糖核酸干擾[J].中國病理生理雜志,2004,20(5):900-903.
[5]劉艷波,沈維高,蘆麗莉,等.Survivin-siRNA對前列腺癌DU145細胞的促凋亡作用[J].中國病理生理雜志,2010,26(8):1474-1478.
[6]Li F,Ling X.Survivin study:An update of“what is the next wave?”[J].J Cell Physiol,2006,208(3):476 -486.
[7]Liu YB,Zhang L,Guo YX,et al.Plasmid-based Survivin shRNA and GRIM-19 carried by attenuated Salmonella suppresses tumor cell growth[J].Asian J Androl,2012,14(4):536-545.
[8]Zhang M,Latham DE,Delaney MA,et al.Survivin mediates resistance to antiandrogen therapy in prostate cancer[J].Oncogene,2005,24(15):2474 -2482.
[9]Zhang M,Mukherjee N,Bermudez RS,et al.Adenovirus-mediated inhibition of survivin expression sensitizes human prostate cancer cells to paclitaxel in vitro and in vivo[J].Prostate,2005,64(3):293-302.
[10]劉艷波,葛 賀,蘆麗莉,等.Survivin-siRNA真核重組質粒的構建和鑒定及對前列腺癌DU145細胞的影響[J].中國老年學雜志,2010,30(5):642-645.
[11]Lucas ML,Heller R.Immunomodulation by electrically enhanced delivery of plasmid DNA encoding IL-12 to murine skeletal muscle[J].Mol Ther,2001,3(1):47 -53.
[12]Bureau MF,Scherman D.Plasmid DNA electrotransfer:a new non viral method for gene therapy in oncology[J].Technol Cancer Res Treat,2002,1(2):149 -152.

