氧化苦參堿對結腸炎模型大鼠結腸黏膜NOD2與TNF-α的影響*
唐慶,范恒,胡慧,壽折星,劉星星
(華中科技大學同濟醫學院附屬協和醫院中西醫結合科,武漢430022)
近年來,我國炎癥性腸病(inflammatory bowel disease,IBD)尤其是潰瘍性結腸炎(ulcerative colitis,UC)的發病率呈逐年上升趨勢[1]。該病治療難度大,愈后易復發,被世界衛生組織列為難治病之一。UC發病與環境、遺傳、腸道黏膜免疫功能失調等多種因素有關。NOD2蛋白是一種新發現的細胞內病原相關模式識別受體(PRRs),NOD2能識別細菌細胞膜酸二肽,介導核因子κB(neclear factor-κB,NF-κB)的激活與α腫瘤壞死因子(tumor necrosis factor α,TNF-α)等的表達[2-3]。已有研究表明,NOD2蛋白與UC發病密切相關[4-5]。筆者在本實驗中采用三硝基苯磺酸(trinitrobenzene-sulfonic acid,TNBS)制備大鼠UC模型,采用氧化苦參堿(oxymatrine,OMT)治療,檢測大鼠結腸黏膜NOD2和TNF-α表達情況。
1 材料與方法
1.1 材料雄性SPF級SD大鼠32只,體質量(250±20)g,購自華中科技大學同濟醫學院實驗動物中心,實驗動物生產許可證號:SCKY(鄂)2004-0007,實驗動物使用許可證號:SYXK(鄂)2004-0028。TNBS購自Sigma公司(批號:P2297)。NOD2山羊抗鼠多克隆抗體購自SANTA CRUZ公司。大鼠TNF-α酶聯免疫吸附測定(enzyme linked immunosorbent assay,ELISA)試劑盒購自上海西唐生物科技有限公司。美沙拉嗪由法國愛的發制藥集團生產。苦參素注射液(有效成分為OMT)由天津市生物化學制藥廠生產,OMT純度達98%。
1.2 動物分組將大鼠隨機分為對照組、模型組、OMT組、美沙拉嗪組,每組8只。對照組從實驗開始至實驗結束正常飲水、喂食,其他3組用TNBS造模。造模后24 h,模型組肌內注射等體積0.9%氯化鈉溶液;OMT組給予OMT肌內注射,63 mg·kg-1·d-1[6];美沙拉嗪組給予美沙拉嗪純化水溶液灌胃,0.42 g·kg-1·d-1,均給藥15 d。第16天開始,禁食24 h后處死大鼠。
1.3 造模方法大鼠適應性飼養1周,禁食不禁水24 h,10%水合氯醛按0.3 mL·(100 g)-1腹腔注射麻醉。將直徑2.0 mm橡膠輸液管由肛門輕緩插入8 cm,將5%TNBS液(TNBS溶于50%乙醇)0.6 mL用注射器緩慢推入橡膠導尿管,注入TNBS液后將大鼠尾巴提起,持續倒置30 s,然后使大鼠平躺,自然清醒后自由飲食。
1.4 結腸黏膜標本的制備將大鼠頸椎脫位處死,仰位固定于手術臺,切取肛門至回盲部結腸,取出結腸后沿縱軸切開,并用0.9%氯化鈉溶液沖洗干凈,觀察大鼠結腸黏膜的病變損傷程度,然后立即用4%多聚甲醛溶液固定,由本院病理室石蠟包埋切片,蘇木精-伊紅(HE)染色,光鏡下評估黏膜損傷程度。
1.5 結腸黏膜NOD2的檢測免疫組織化學法檢測結腸黏膜NOD2表達,組織切片脫蠟,修復抗原,切片放入3%過氧化氫溶液,室溫下孵育10 min,以阻斷內源性過氧化物酶,滴加正常山羊血清封閉液,室溫孵育15 min,按稀釋度1∶150滴加山羊抗鼠NOD2多克隆抗體50 μL,4℃孵育過夜,磷酸鹽緩沖液(phosphate buffered solution,PBS)沖洗3次,滴加復合生物素標記的二抗,室溫孵育20min,二氨基聯苯胺(diamionobenzidine,DAB)顯色,顯微鏡下控制顯色程度,純化水終止顯色反應,蘇木精復染30~60 s,脫水,透明,中性樹膠封片。顯微鏡下,細胞質和細胞核內出現棕黃色或褐色顆粒為陽性反應物,彌漫分布于黏膜固有層及部分上皮內,在40倍鏡下選取典型視野計數100個細胞,記數其中陽性細胞數,并以率表示。
1.6 結腸黏膜TNF-α的檢測取大鼠結腸黏膜標本,用載玻片輕刮腸黏膜表面黏液,再置于上清液中清洗,繼用載玻片用力刮取腸黏膜組織標本,將標本轉入勻漿器中,加入3倍0.9%氯化鈉溶液充分勻漿,4℃1 000×g離心10 min,取上清液檢測。嚴格按照ELISA試劑盒說明書進行操作,畫出標準曲線,計算出各標本TNF-α的濃度。
1.7 統計學方法采用SPSS16.0軟件進行統計學分析。實驗數據以均數±標準差(±s)表示,計量資料兩組間比較采用t檢驗,計數資料采用q檢驗,以P<0.05表示差異有統計學意義。
2 結果
2.1 一般情況對照組大鼠體質量、大便、飲食、活動正常,其余組大鼠于灌腸后第2,3天開始出現明顯稀便、黏液膿血便、體質量減輕及活動度明顯下降。OMT組大鼠治療4~5 d后腹瀉、膿血便明顯減輕,體質量及活動度較對照組略有下降,但明顯輕于模型組。模型組大鼠死亡1只,解剖尸體可見結腸黏連、狹窄。
2.2 結腸大體形態及組織病理評分對照組大鼠結腸黏膜基本正常,模型組大鼠結腸黏膜充血水腫、糜爛壞死,可見多發小潰瘍及腸壁黏連,腸腔擴張,腸壁增厚,病變部位以回盲部和結腸為主,部分可累及末端回腸,美沙拉嗪組和0MT組病變明顯減輕,可見充血、水腫、糜爛和紅色瘢痕[7]。將病變組織切片,HE染色,光鏡下觀察:模型組結腸黏膜高度水腫,上皮脫落、壞死,潰瘍形成,大量淋巴細胞和多核中性粒細胞浸潤至黏膜層、黏膜下層甚至肌層,肉芽腫形成,杯狀細胞減少;美沙拉嗪組結腸黏膜糜爛,黏膜下層水腫、充血,固有層大量中性粒細胞、漿細胞浸潤,黏膜下層水腫、充血;OMT組結腸黏膜杯狀細胞增多,黏膜固有層可見淋巴細胞、單核細胞浸潤。各組大鼠結腸損傷和組織病理評分[8]見表1。
2.3 結腸黏膜NOD2蛋白表達光學顯微鏡下,大鼠結腸黏膜組織免疫組織化學切片可見結腸黏膜NOD2蛋白主要表達于上皮細胞和單核細胞。對照組結腸黏膜內少量細胞的細胞質內可見淺黃色顆粒,模型組上皮細胞和單核細胞的細胞質內均可見大量深棕黃色或褐色顆粒,美沙拉嗪組和OMT組上皮細胞和淋巴細胞細胞質內可見少量黃色顆粒。陽性細胞數計數顯示,模型組大鼠結腸黏膜NOD2蛋白表達較對照組明顯升高(P<0.01),美沙拉嗪組、OMT組大鼠結腸黏膜NOD2蛋白表達較模型組顯著降低(P<0.05)(表1)。
2.4 結腸黏膜TNF-α表達模型組大鼠結腸黏膜TNF-α明顯升高(P<0.01),美沙拉嗪組、OMT組大鼠結腸黏膜TNF-α較模型組顯著降低(P<0.05)(表1)。
3 討論
該實驗結果表明,TNBS誘導的大鼠結腸炎模型中,大鼠結腸黏膜NOD2蛋白過度表達,結腸黏膜TNF-α增多,這是TNBS誘導的大鼠結腸炎的重要機制之一。宿主細胞對入侵病原體的識別依靠表達在細胞表面或活細胞內的能夠識別病原相關分子模式的受體介導。NOD2蛋白是一種新發現的細胞內病原相關模式識別受體。研究表明,NOD2能識別存在于革蘭陰性和革蘭陽性細菌細胞壁的胞壁酸二肽,調控NF-κB的激活,從而廣泛參與細胞內病原微生物的識別和炎癥應答的誘導,是聯系天然免疫與特異性免疫的重要橋梁[9-10]。NOD2蛋白是核苷酸結合寡聚化結構域蛋白家族中的一員,編碼NOD2的基因位于人類染色體16q12。NOD2蛋白分子主要由3個功能結構域構成:N端的胱冬酶募集域、位于中間的NOD域、C端的富亮氨酸重復序列域,其中NOD域包含P環和MgCl結合位點[11-12]。NOD2表達于單核細胞、樹突狀細胞、粒細胞和少量T細胞,腸道上皮細胞也有NOD2表達。研究表明,NOD2可以介導NF-κB活化,活化通路主要有受體相互作用蛋白-2和IκB激酶復合體參與。當NOD2蛋白LRR域識別細菌產物后,可誘導蛋白分子間通過NOD域相互聯系進行自身寡聚化反應形成受體復合體,隨后受體復合體通過同型CARD-CARD相互作用將RIP2分子募集到周圍。RIP2與IκKγ亞基相連接,激活IκK酶復合體,引起IκB磷酸化,產生一系列效應—降解磷酸化的IκB,NF-κB核易位、含κB位點的靶基因轉錄活化[13]。促進多種炎性細胞因子如TNF-α的基因轉錄,這些炎性細胞因子可促進NF-κB進一步活化,通過正反饋使炎性細胞因子分泌增加,產生瀑布級聯反應,使炎癥過程得到放大和持續[14]。目前,已有許多實驗證據表明NOD2蛋白與IBD發病密切相關[5,15],本實驗應用TNBS誘導大鼠結腸炎模型進一步驗證了這種觀點。
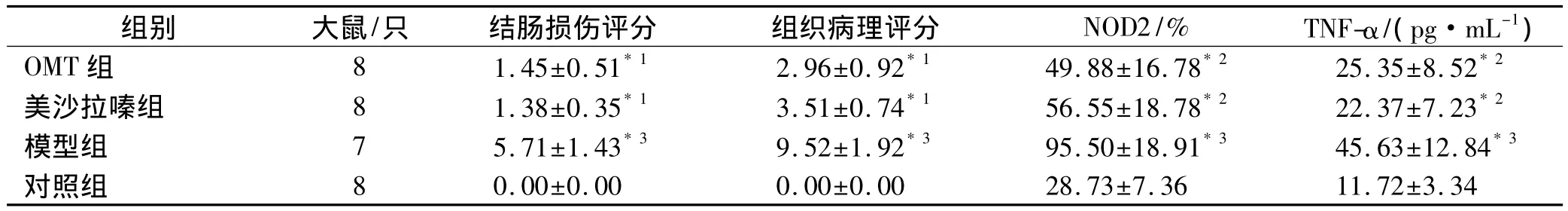
表1 4組大鼠結腸損傷、組織病理評分與結腸黏膜NOD2、TNF-α表達測定結果Tab.1Colon lesion scores,histological score and expression of NOD2 and TNF-α in colon mucosa of 4 groups of rats x±s
本實驗結果顯示,OMT對TNBS誘導的大鼠結腸炎有明顯的治療作用,可以減輕大鼠結腸黏膜損傷,改善結腸黏膜病理組織學評分,其機制與抑制結腸黏膜NOD2蛋白過度表達,降低大鼠結腸黏膜TNF-α有關。綜上所述,結腸黏膜NOD2蛋白過度表達、TNF-α分泌增多參與了UC的發生發展過程,而OMT可以通過抑制NOD2蛋白過度表達、降低TNF-α分泌,起到減輕結腸黏膜炎癥、保護腸黏膜的作用,可能是OMT治療UC的機制之一[16]。
[1]WANG Y F,ZHANG H,OUYANG Q.Clinical manifestations of inflammatory bowel disease: East and West differences[J].J Dig Dis,2007,8(3):121-127.
[2]KAMBE N,NISHIKOMORI R,KANAZAWA N.The cytosolic pattern-recognition receptor Nod2 and inflammatory granulomatous disorders[J].J Dermatol Sci,2005,39(2):71-80.
[3]LE B L,BENKO S,GIRARDIN S E.NOD1 and NOD2 in in-nate immunity and human inflammatory disorders[J].Biochem Soc Trans,2007,35(6):1479-1484.
[4]QUEIROZ D M,OLIVEIRA A G,SARAIVA I E,et al.Immune response and gene polymorphism profiles in Crohn's disease and ulcerative colitis[J].Inflamm Bowel Dis,2009,15(3):353-358.
[5]LI M,GAO X,GUO C C,et al.OCTN and CARD15 gene polymorphism in Chinese patients with inflammatory bowel disease[J].World J Gastroenterol,2008,14(31):4923-4927.
[6]苗明三.實驗動物和動物實驗技術[M].北京:中國中醫藥出版社,1997:142-150.
[7]JANDRA K,LE T,SWAIN M G.Experimental colitis attenuates development of toxin-induced cholangitis in rats[J].Dis Sci,2002,47(7):1216.
[8]GONZA'LEZ R,RODR I'GUEZ S,ROMAY C.Antiinflammatory activity of phycocyanin extract in acetic acidinduced colitis in rats[J].Parmacol Res,1999,39(1):55-59.
[9]KAMBE N,NISHIKOMORI R,KANAZAWA N.The cytosolic pattern-recognition receptor Nod2 and inflammatory granulomatous disorders[J].J Dermatol Sci,2005,39(2):71-80.
[10]LE B L,BENKO S,GIRARDIN S E.NOD1 and NOD2 in innate immunity and human inflammatory disorders[J].Biochem Soc Trans,2007,35(6):1479-1484.
[11]OGURA Y,INOHARA N,BENITO A,et al.NOD2,a NOD1/Apaf-1 family member that is restricted to monocytes and activates NF-kappa VB[J].J Biol Chem,2001,276(7):4812-4818.
[12]RIETDIJK S T,BURWELL T,BERTIN J,et al.Sensing intracellular pathogens-NOD-like receptors[J].Curr Opin Pharmacol,2008,8(3):261-266.
[13]BIELIG H,ZUREK B,KUTSCH A,et al.A function for AAMP in Nod2-mediated NF-kappaB activation[J].Mol Immunol,2009,46(13):2647-2654.
[14]VALLABHAPURAPU S,KARIN M.Regulation and function of NF-kappaB transcription factors in the immune system[J].Annu Rev Immunol,2009,27:693-733.
[15]QUEIROZ D M,OLIVEIRA A G,SARAIVA I E,et al.Immune response and gene polymorphism profiles in Crohn's disease and ulcerative colitis[J].Inflamm Bowel Dis,2009,15(3):353-358.
[16]張巖,姜挺,夏冰.潰瘍性結腸炎患者藥物保留灌腸效果的Meta分析[J].護理學雜志,2009,24(23):69-71.

