E2弱化雙酚A雌激素活性機制
張光明,郎 朗,李 鈺,馬 軍
(1.哈爾濱工業(yè)大學 市政環(huán)境工程學院,150090哈爾濱;2.中國人民大學 環(huán)境學院,100872北京;3.哈爾濱商業(yè)大學生命與環(huán)境科學研究中心,150028哈爾濱;4.哈爾濱工業(yè)大學理學院,150001哈爾濱)
內(nèi)分泌干擾物(EDCs)可致人體內(nèi)分泌失調(diào),引發(fā)多種疾病,還會對后代帶來不良影響.雙酚A是典型的雌激素類EDCs,可嚴重干擾內(nèi)分泌系統(tǒng),威脅著胎兒和兒童的健康.歐盟認為雙酚A會誘發(fā)性早熟,從2011年3月2日起,禁止生產(chǎn)含雙酚A的嬰兒奶瓶.在我國北京、上海、深圳、杭州等大中城市飲用水水源中均發(fā)現(xiàn)了一定濃度的雙酚A[1],其雌激素活性的有效控制引起廣泛關注.雌二醇(E2)是人體天然雌激素的代表物質(zhì).前期研究發(fā)現(xiàn)E2與雙酚A共存時可以弱化雙酚A的雌激素活性[2].這一現(xiàn)象對于控制雙酚A對人體尤其是女性的毒害作用具有重要意義.本文將深入研究這一現(xiàn)象發(fā)生的可能機制.
1 實驗
所用乳腺癌MCF-7細胞為實驗室自行培養(yǎng).雙酚A、E2、苯甲基磺酰氟(PMSF)、抑肽酶A、亮抑肽酶、色胺酸等購自美國Sigma公司.丙烯酰胺、甲叉雙丙烯酰胺、四甲基乙二胺(TEMED)購自美國Ameresco公司.其他材料為國產(chǎn)分析純試劑.實驗中雙酚A、E2濃度分別為10-8、10-12mol/L.所用主要設備包括GeneAmp?PCR System 9700(Applied Biosystems公司)、DYY-6B電泳儀(北京市六一儀器廠)、蛋白質(zhì)電泳及Western雜交轉(zhuǎn)膜系統(tǒng)(Bio-Rad)、LSM Meta510激光共聚焦儀(Zeiss公司)、IGO 150二氧化碳培養(yǎng)箱(Thermo公司).
采用流式細胞儀法測定細胞周期的變化[3].細胞增殖指數(shù)ⅠP=(nS+nG2)/(nG1+nS+nG2)×100%,nS為DNA合成期細胞數(shù);nG1為第1間隙期細胞數(shù);nG2為第2間隙期細胞數(shù).
采用WESTERN BLOT法測定乳腺癌MCF-7細胞內(nèi)雌激素受體α蛋白,以及絲裂原活化蛋白激酶(MAPK)信號轉(zhuǎn)導通路相關蛋白.該方法可檢測到低至10~100 pg的環(huán)境雌激素的干擾效應[4].蛋白樣品制備、SDS-PAGE電泳、Lowry法測定蛋白含量、免疫反應、化學發(fā)光、顯影、定影等均參照分子生物學蛋白檢測方法[5].以β-Tublin蛋白作為內(nèi)參照,對目的蛋白表達量進行校正.
采用RT-PCR法測定EDCs干擾效應相關的轉(zhuǎn)錄因子C-fos、C-jun.步驟如下:細胞培養(yǎng)、RNA抽提、分離、沉淀、洗脫、再溶解、定量、逆轉(zhuǎn)錄(RT)、聚合酶鏈式反應、電泳鑒定[5].
2 結(jié)果與討論
2.1 對細胞周期的影響
細胞分裂復制的過程稱為細胞周期.整個細胞周期被劃分為G1→S→G2→M→G1,其中最具特征性的階段是S期(DNA合成期),經(jīng)過短暫間隙(G2),進入有絲分裂期(M期),再經(jīng)過短暫間隙(G1),開始下一個周期.一旦調(diào)控系統(tǒng)發(fā)生故障,細胞就會過度增殖導致癌癥[6].
從表1可以看出,E2、雙酚A及混合物均可改變MCF-7細胞周期,提高增殖指數(shù)ⅠP.E2使S期細胞比例由25.1%增加到34.2%,提高了9.1%,由于細胞在S期發(fā)生DNA合成,S期比例提高說明DNA合成增加.雙酚A也可提高S期細胞比例,但效果較E2弱.而二者混合后,S期細胞提高比例進一步降低.此外,雙酚A還可誘導G2期細胞比例增加5.4%,而E2則降低了G2期細胞比例1.3%.上述差異表明,E2與雙酚A對MCF-7細胞的增殖機制不同.
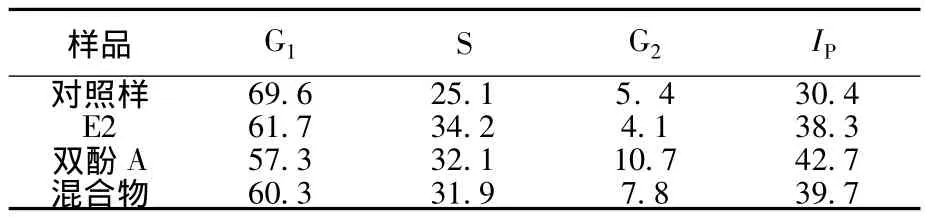
表1 E2與雙酚A聯(lián)合作用于MCF-7細胞的周期變化%
2.2 蛋白表達
蛋白表達如圖1所示.顯然,空白組ERα蛋白表達良好,ERK系列蛋白表達較低,JNK系列蛋白與p38表達極弱,C-myc幾乎不表達.各實驗組的蛋白表達詳細分析見下文.
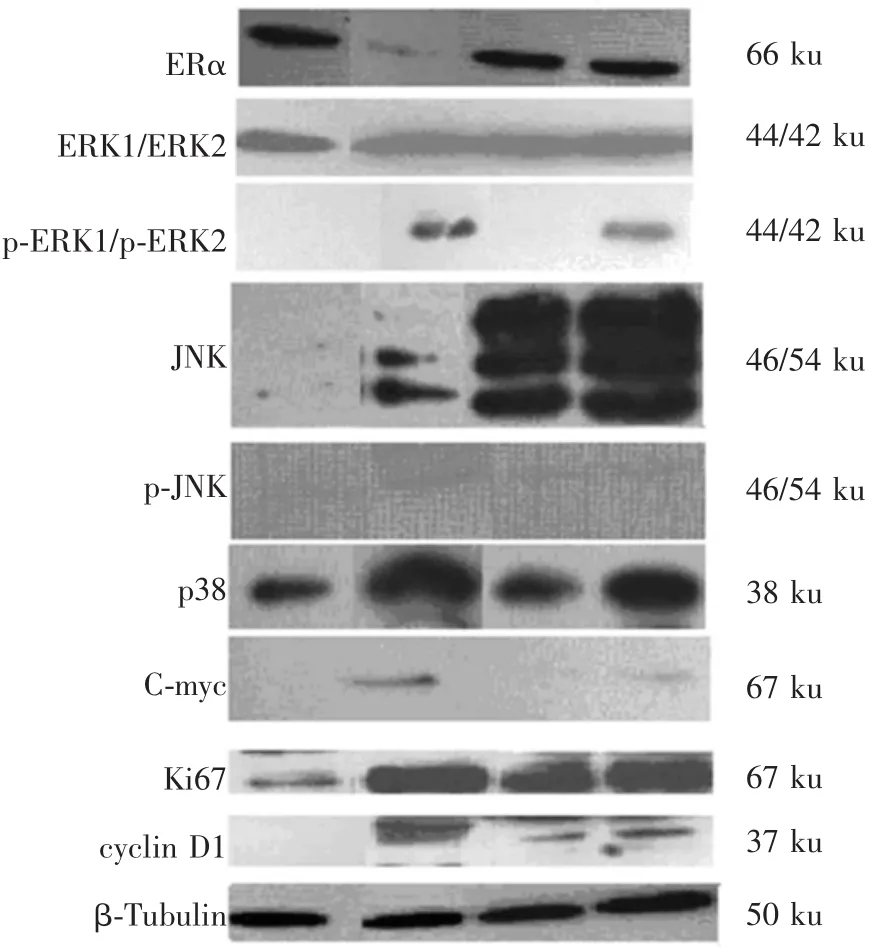
圖1 E2與雙酚A聯(lián)合對MCF-7細胞內(nèi)蛋白表達的影響
2.3 雌激素受體蛋白表達
EDCs干擾內(nèi)分泌系統(tǒng)的傳統(tǒng)途徑是與雌激素受體(ER)結(jié)合,從而使天然雌激素不能有效結(jié)合ER.在MCF-7細胞中最重要的ER是ERα蛋白[7],因此,EDCs發(fā)揮雌激素活性主要是與ERα蛋白結(jié)合,使其不能正常表達,這是雌激素作用的經(jīng)典路徑[8].圖2所示為E2、雙酚A、混合物對ERα蛋白的影響,E2對ERα蛋白的誘導能力最強、雙酚A最弱、混合物介于二者之間.圖2表明,E2、雙酚A、混合物均可通過經(jīng)典路徑——雌激素受體途徑發(fā)揮作用.
2.4MAPK信號轉(zhuǎn)導通路研究
除了經(jīng)典途徑外,EDCs起作用的另一個重要途徑是干擾MAPK信號轉(zhuǎn)導通路.MAPKs(絲裂原活化蛋白激酶)是重要的信號傳遞者[9],其種類眾多,最重要的有胞外信號調(diào)節(jié)蛋白激酶(ERK)、c-jun氨基末端激酶(JNK)、p38等[10].ERK1/2信號通路是經(jīng)典的MAPK信號轉(zhuǎn)導途徑.活化的ERK1/2可磷酸化多種核轉(zhuǎn)錄因子,并誘導C-fos基因活化,增加C-fos蛋白合成[11].
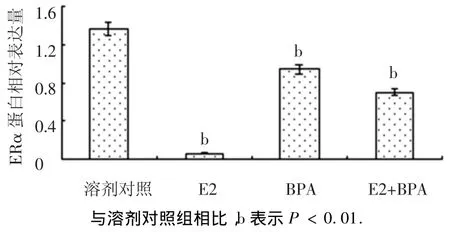
圖2 E2與雙酚A聯(lián)合對MCF-7細胞ERα蛋白的影響
圖3所示為E2、雙酚A、混合物對MCF-7細胞內(nèi)ERK蛋白表達的影響.E2顯著提高了ERK蛋白的表達,雙酚A基本沒有影響,混合物效果略低于E2.圖4所示為三者對活化后的ERK——p-ERK蛋白的影響.溶劑對照組p-ERK蛋白不表達,E2顯著提高了p-ERK蛋白的表達量,而雙酚A基本沒有作用,混合物效果與E2相當[12].圖3、4均表明,雙酚A對ERK信號通路沒有作用.
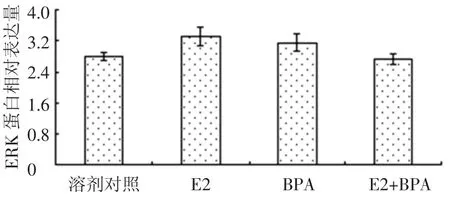
圖3 E2與雙酚A聯(lián)合對MCF-7細胞ERK蛋白的影響
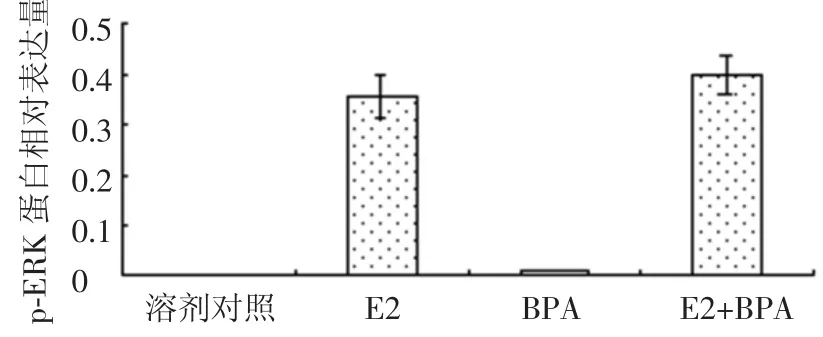
圖4 E2與雙酚A聯(lián)合對MCF-7細胞p-ERK蛋白的影響
圖5所示為E2、雙酚A、混合物對另一個重要MAPKs——JNK信號通路的影響.溶劑對照組JNK蛋白基本不表達,E2對其有一定增強作用,雙酚A使其大量表達,而混合物對JNK蛋白表達的促進明顯高于E2或雙酚A.但由圖1可以看出,JNK蛋白的活化形式——p-JNK蛋白在各種條件下表達量都較低,表明E2及BPA雖然刺激了JNK蛋白表達,但最終不能提高其活性,JNK通路并非其作用途徑.
p38絲裂原活化蛋白激酶是MAPKs家族中的一員,調(diào)控應激情況下的細胞增殖和凋亡[13].如圖6所示,E2能夠誘導p38蛋白的表達,而BPA使p38蛋白的表達量下降,兩者混合后對p38的誘導介于兩者之間.由于p-p38蛋白不表達,判斷p38在E2、BPA及聯(lián)合誘導增殖中不發(fā)揮作用.C-myc通過對靶基因的轉(zhuǎn)錄調(diào)節(jié)發(fā)揮其生物學效應[14].如圖7所示,溶劑組C-myc蛋白不表達,E2顯著誘導其表達,雙酚A對其沒有影響,而混合物的誘導效應遠遠低于E2(0.092vs.0.017).如此顯著的降低表明,E2與雙酚A混合后,雌激素效應降低的主要機制是C-myc蛋白表達受到了抑制.

圖5 E2與雙酚A聯(lián)合對MCF-7細胞JNK蛋白的影響

圖6 E2與雙酚A聯(lián)合對MCF-7細胞p38蛋白的影響

圖7 E2與雙酚A聯(lián)合對MCF-7細胞C-myc蛋白的影響
如圖8所示,E2能夠誘導C-fos基因的表達,雙酚A對C-fos基因基本沒有影響,兩者聯(lián)合后作用介于兩者之間.如圖9所示,E2、雙酚A、混合物均可減弱C-jun基因的表達,混合物效應略強,但差別不大.

圖8 E2與雙酚A聯(lián)合對MCF-7細胞C-fos基因的誘導

圖9 E2與雙酚A聯(lián)合對MCF-7細胞C-jun基因的影響
如圖10、11所示,E2、雙酚A、混合物均可誘導Ki67蛋白的表達且混合物表現(xiàn)出增強效應.E2顯著誘導cyclin D1蛋白表達,雙酚A較E2弱很多,聯(lián)合后E2使雙酚A對cyclin D1蛋白的誘導增強.
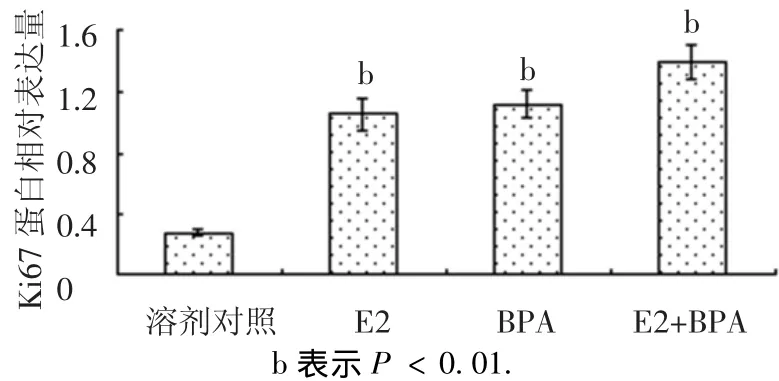
圖10 E2與雙酚A聯(lián)合對Ki67蛋白的影響

圖11 E2與雙酚A聯(lián)合對cyclin D1蛋白的影響
3 結(jié)論
1)E2、雙酚A、混合物都具有雌激素效應,可以促進MCF-7細胞的增殖.E2既可以通過經(jīng)典途徑(雌激素受體)起作用,又可以通過非經(jīng)典途徑(ERK信號通路)起作用.
2)E2可以促進C-myc基因與C-fos基因表達、誘導增殖蛋白Ki67與cyclin D1蛋白表達,增加DNA分裂期細胞比例,促進細胞增殖.而雙酚A只通過雌激素受體途徑起作用,激活cyclin D1蛋白.兩者混合后,可通過受體途徑及ERK途徑發(fā)揮作用,促進C-fos基因的轉(zhuǎn)錄表達,促進Ki67蛋白表達.然而,C-myc蛋白顯著下降,這可能是E2弱化雙酚A雌激素效應的主要機制.
[1]梁超,鄧慧萍.水中內(nèi)分泌干擾物質(zhì)的研究現(xiàn)狀及趨勢[J].城市給排水,2005,19(3):17-20.
[2]郎朗.水中典型環(huán)境雌激素共存對內(nèi)分泌系統(tǒng)的影響及機制研究[D].哈爾濱:哈爾濱工業(yè)大學市政環(huán)境工程學院,2011:23-27.
[3]VANPARYS C,MARAS M,LENJOU M,et al.Flow cytometric cell cycle analysis allows for rapid screening of estrogenicity in MCF-7 breast cancer cells[J].Toxicol in Vitro,2006,20(7):1238-1248.
[4]SADLER A J,PUGAZHENDHI D,DARBRE P D.Use of global gene expression patterns in mechanistic studies of oestrogen action in MCF7 human breast cancer cells[J].J Steroid Biochem Mol Biol,2009,114(1/2):21-32.
[5]劉志恒.現(xiàn)代微生物學[M].北京:科學出版社,2002.
[6]WESIERSKA-GADEK J,KRAMER M P,MAURER M.Resveratrol modulates roscovitine-mediated cell cycle arrest of human MCF-7 breast cancer cells[J].Food Chem Toxicol,2008,46(4):1327-1333.
[7]SUKOCHEVA O A,YANG Y,GIERTHY J F.Estrogen and progesterone interactive effects in postconfluent MCF-7 cell culture[J].Steroids,2009,74(4/5):410-418.
[8]SOTOCA A M,RATMAN D,SAAG van der P,et al.Phytoestrogen-mediated inhibition of proliferation of the human T47D breast cancer cells depends on the ERalpha/ERbeta ratio[J].J Steroid Biochem Mol Biol,2008,112(4/5):171-178.
[9]WATT H L,KHARMATE G D,KUMAR U.Somatostatin receptors 1 and 5 heterodimerize with epidermal growth factor receptor:agonist-dependent modulation of the downstream MAPK signalling pathway in breast cancer cells[J].Cell Signal,2009,21(3):428-439.
[10]DAVIS R J.Signal transduction by the JNK group of MAP kinases[J].Cell,2000,103(1):239-52.
[11]RAMOS J W.The regulation of extracellular signal-regulated kinase(ERK)in mammalian cells[J].Int J Biochem Cell Biol,2008,40(12):2707-2719.
[12]郎朗,張光明.E2與BPA聯(lián)合前后對ERK信號通路的誘導[J].哈爾濱商業(yè)大學學報,2011,27(2):162-164.
[13]RIGON A P,CORDOVA F M,OLIVEIRA C S,et al.Neurotoxicity of cadmium on immature hippocampus and a neuroprotective role for p38 MAPK[J].Neurotoxicology,2008,29(4):727-734.
[14]ANDREI L,KSENYA S.Mechanisms of c-Myc-mediated transcriptional repression of growth arrest genes[J].Exp Cell Res,2003,283:17-21.

