同時培養(yǎng)法與吸附法微生物固定化對比
山 丹,馬 放,張 斯,王 晨,3
(1.哈爾濱工業(yè)大學城市水資源與水環(huán)境國家重點實驗室,150090哈爾濱;2.中日友好環(huán)境保護中心,100029北京;3.中國國際工程咨詢公司,100044北京)
微生物固定化技術是指將微生物通過一定的技術手段(如利用載體材料、包埋物質(zhì)或合理控制水力條件等)保持在反應器內(nèi).菌絲球是由霉菌的自絮凝現(xiàn)象產(chǎn)生的具有一定機械強度和大小的球體,它除了具有生物活性良好、沉降速度快、易于固液分離等優(yōu)點外,吸附和降解效能近來也被廣泛關注[1-4].目前,國外主要注重對菌絲球基礎理論和結構方面的研究,國內(nèi)的研究則大多是面向應用的[5-7].菌絲球在工業(yè)廢水處理方面的研究起步比較晚,目前還沒有實際應用的例子,實驗室研究也只涉及到對重金屬廢水和印染廢水的吸附[8-13].應用菌絲球作為載體是最新的研究方向,文獻[14]以曲霉形成的菌絲球吸附并固定產(chǎn)氫細菌——產(chǎn)酸克雷伯氏菌進行連續(xù)流產(chǎn)氫,解決了產(chǎn)氫菌流失和產(chǎn)氫速率降低的問題,實現(xiàn)了霉菌和功能菌的生態(tài)位分離,將各自的功能有機地結合到了一起.但是,考慮到采用吸附法向菌絲球上固定化微生物的方法操作步驟繁瑣、耗時、固定微生物量有限、形成的混合菌絲球內(nèi)部微生物分布不均勻,勢必影響固定化微生物的活性和整個球體的傳質(zhì)效果.本實驗為菌絲球這種新型生物質(zhì)載體提出了一種新的固定化方法——同時培養(yǎng)法,并以高效低溫苯胺降解細菌JH-9作為研究對象,對同時培養(yǎng)和吸附兩種固定化方法作了對比研究,為混合菌絲球的實際應用提供了有力的理論基礎.
1 實驗
1.1 實驗材料
1.1.1 儀器和試劑
用于本試驗的設備主要為8037—SGS超型全自動壓力蒸汽滅菌器、ZHWY—2112B型雙層全溫度恒溫振蕩器、紫外分光光度儀(UNICAMHEλIOS)、CX31型顯微鏡、電子天平(ALC-210.4)、顯微數(shù)碼成像系統(tǒng)、垂直流超凈工作臺、鼓風干燥箱、石蠟切片機.
1.1.2 菌種來源
1.2 實驗方法
1.2.1 單純霉菌菌絲球的培養(yǎng)
配置液體培養(yǎng)基,121℃,滅菌20 min,接種孢子懸液,于160 r/min、37℃的搖床中培養(yǎng)24 h.
1)菌絲球生長培養(yǎng)基成分.蔗糖30 g,NH4Cl 0.5 g,K2HPO3·H2O 0.1 g,MgSO4·7H2O 0.1 g,F(xiàn)eSO4·7H2O 0.1 g,H2O 1 000 mL.
2)孢子懸液的配置.用無菌的生理鹽水沖洗長有曲霉菌的斜面固體培養(yǎng)基的表面,用接種環(huán)輕刮斜面,直至菌體被完全沖洗下來.輕輕震蕩試管,使懸液中的孢子呈均勻分散狀態(tài).用可見分光光度計在波長620 nm下測其吸光度(A).
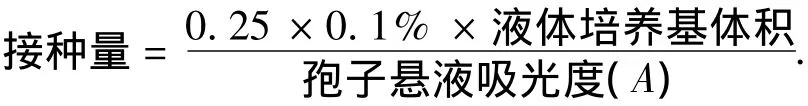
3)菌絲碎片的制備.用量筒取球齡4 d的菌絲球,靜置30 min.使菌絲球充分沉降,量取量筒底部沉降下來的菌絲球150 mL,用無菌水稀釋至300 mL倒入粉碎機中1 800 r/min,粉碎30 s,制成混合均勻的菌絲片段懸液.
1.2.2 混合菌絲球培養(yǎng)方案
取低溫條件下的JH-9培養(yǎng)液在12 000 r/min下離心5 min,然后棄離心上清液,用磷酸鹽緩沖溶液清洗離心管底部的菌體,在上述條件下再次離心,如此操作兩次.洗菌后將離心管底部的菌體取出,用適量無菌水配成均勻菌懸液.按照菌絲球片段繁殖和孢子繁殖這兩種不同的繁殖方法,分別采取同時和先后接種的方法培養(yǎng)混合菌絲球,并以不接種JH-9細菌的單純菌絲球作為對照(具體實驗設計方案見表1).
煤全部燒光了;煤桶空了;煤鏟也沒有用了;火爐里透出寒氣,灌得滿屋冰涼。窗外的樹木呆立在嚴霜中;天空成了一面銀灰色的盾牌,擋住向蒼天求助的人。我得弄些煤來燒;我可不能活活凍死;我的背后是冷酷的火爐,我的面前是同樣冷酷的天空,因此我必須快馬加鞭,在它們之間奔馳,在它們之間向煤店老板要求幫助。

表1 混和菌絲球培養(yǎng)方案
1.2.3 菌絲球直徑的測定
隨機選取10個菌絲球,用濾紙吸去菌絲球外表面水分.吸取的水分應適量,保證菌絲球不因失去過多水分而變形.然后以游標卡尺量取直徑數(shù)值.菌絲球直徑表示為10個菌絲球直徑的平均值.
1.2.4 成球堆積體積測定方法
將250 mL三角瓶中的菌絲球培養(yǎng)液倒入一個200 mL量筒中,靜置10 min,讀取菌絲球沉降體積作為成球堆積體積.
1.2.5 菌絲球形態(tài)觀察
將接種后的液體培養(yǎng)基置于160 r/min,37℃搖床培養(yǎng),當菌絲球培養(yǎng)到直徑1~2 cm時,將菌絲球接入培養(yǎng)皿中用數(shù)碼照相機拍照觀察外觀形態(tài),而后將菌絲球切開用掃描電子顯微鏡觀察其微觀菌絲形態(tài)和混合菌絲球生態(tài)構成.
1.3 實驗過程
1.3.1 不同固定化方法對混合球成球速度的影響
將霉菌Y3和菌株JH-9分別以同時接種培養(yǎng)(向培養(yǎng)液中同時接種Y3和JH-9)和吸附法培養(yǎng)(在培養(yǎng)液中先接種Y3待培養(yǎng)48 h菌絲球形成時向培養(yǎng)液中接種JH-9)的方式形成混合菌絲球,兩種接種方式中霉菌Y3初始的接種量相等,而工程菌JH-9的初始接種量分別為5、10、20 mL(母液細菌量1.2×109/mL).每隔8 h測定培養(yǎng)液的吸光度A.
1.3.2 不同固定化方法對混合菌絲球成球堆積體積的影響
按照1.3.1中所述的兩種方法進行固定化,培養(yǎng)混合菌絲球.當培養(yǎng)液的吸光度值A降為0時,將培養(yǎng)液中混合菌絲球移至量筒,靜止沉降30 min后測量全部菌絲球堆積體積,本實驗以單純霉菌菌絲球作對照.
1.3.3 不同培養(yǎng)方法對混合菌絲球成球大小的影響
按照1.3.1所述的兩種方法進行固定化,培養(yǎng)混合菌絲球.當培養(yǎng)液的吸光度值A降為0時,隨機各取不同固定化方法形成的混合菌絲球10個,分別測量其直徑d的大小,取其平均值作為菌絲球的大小(這里所指成球大小即菌絲球的直徑d).
1.3.4 不同培養(yǎng)法對混合菌絲球總質(zhì)量和相對密度的影響
按照1.3.1中所述的兩種方法進行固定化,培養(yǎng)混合菌絲球.當培養(yǎng)液的吸光度值A降為0時,將不同固定化方法形成的全部混合菌絲球從三角瓶中取出,去除多余水分(吸取量控制在不使菌絲球變形為宜)后放至已恒重的蒸發(fā)皿中,置于烘箱,95℃烘干至恒質(zhì)量,讀取皿和球的總質(zhì)量,去掉空皿質(zhì)量得到混合菌絲球的總質(zhì)量.成球總相對密度定義為成球總質(zhì)量除以成球堆積體積.
1.3.5 混合菌絲球內(nèi)部形態(tài)觀察
采用同時培養(yǎng)法和吸附法培養(yǎng)混合菌絲球,隨機取兩種混合菌絲球各1個,切開后在掃描電子顯微鏡下觀察其內(nèi)部形態(tài)結構,同時以沒有固定化細菌的單純霉菌菌絲球內(nèi)部形態(tài)結構作對比.
2 結果分析
2.1 不同固定化方法對混合菌絲球成球速度的影響
將霉菌Y3和功能菌JH-9分別以同時培養(yǎng)(向培養(yǎng)液中同時接種Y3和JH-9)和吸附法培養(yǎng)(在培養(yǎng)液中先接種Y3待培養(yǎng)48 h菌絲球形成時向培養(yǎng)液中接種JH-9)的方式形成菌絲球,兩種接種方式中霉菌Y3初始的接種量相等,而功能菌JH-9的初始接種量分別為5、10、20 mL(母液細菌量1.2×109/mL).每隔8 h測定培養(yǎng)液的吸光度A.如圖1、2所示,不論同時培養(yǎng)法還是吸附法,培養(yǎng)液的吸光度值自接種時起一直持續(xù)降低,最后降為0.不同接種量的同時培養(yǎng)法培養(yǎng)液吸光度值都在72 h降為0.而吸附法只有接種5 mL菌液的培養(yǎng)液在培養(yǎng)72 h時吸光度值降為0.同時培養(yǎng)法固定化細菌的時間比先后接種法要短.將培養(yǎng)液吸光度降為0視為混合菌絲球成球完全,以單位時間內(nèi)培養(yǎng)液吸光度值A減少量V來表示混合菌絲球的成球速度,將以上數(shù)據(jù)重新整理,以混合菌絲球成球速度成圖,結果如圖3所示.
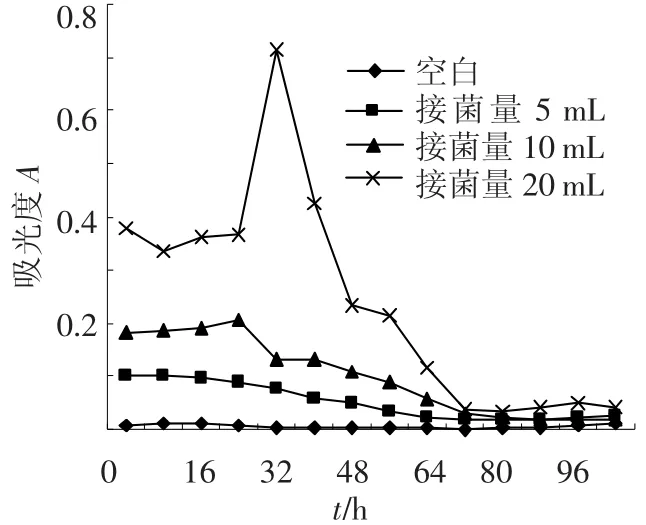
圖1 同時培養(yǎng)法不同接種量對成球的影響

圖2 吸附法不同接種量對成球的影響
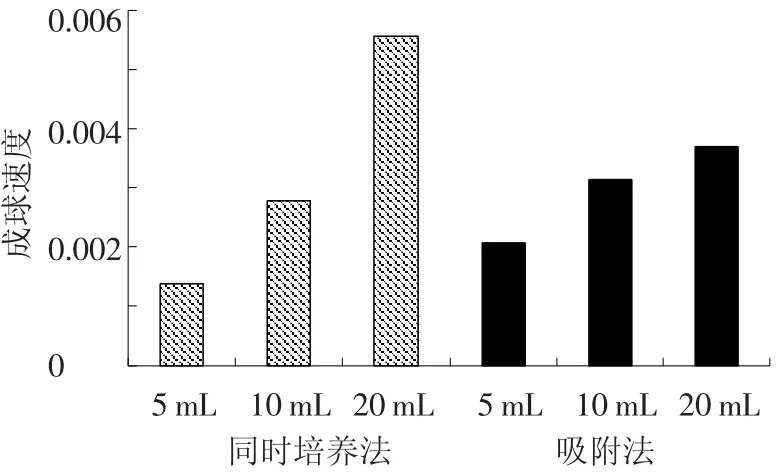
圖3 不同固定化方法對混合菌絲球成球速度的影響
由圖3可以看出,隨著JH-9接種量的增加混合菌絲球的成球速度逐漸提高,即霉菌數(shù)量一定時,混合菌絲球的成球速度與功能菌的接種量成正比.JH-9接種5 mL時,同時培養(yǎng)法成球速度小于先后接種培養(yǎng)法;JH-9接種10 mL時,同時培養(yǎng)法與吸附法成球速度基本相等;JH-9接種20 mL時,同時培養(yǎng)法成球速度明顯大于吸附法.這說明在相同的培養(yǎng)條件下同時培養(yǎng)法能夠以更快的速度固定化更多的細菌,其單位時間內(nèi)固定化細菌量更多.
2.2 不同固定化方法對混合菌絲球成球堆積體積的影響
當培養(yǎng)液吸光度降為0以后,將培養(yǎng)液中混合菌絲球取出以量筒測量全部菌絲球堆積體積,以單純霉菌菌絲球作對照,結果如圖4所示.可以看出,隨著JH-9接菌量的增多,最終形成混合菌絲球的體積也增多,即混合菌絲球的堆積體積與功能菌的接種量成正比.同時培養(yǎng)法比吸附法所形成的混合菌絲球堆積體積略大一些.
2.3 不同固定化方法對混合菌絲球成球大小的影響
隨機各取不同固定化方法形成的混合菌絲球10個,分別測量其直徑大小,再取平均值作為菌絲球的平均大小.不同固定化方法形成的混合菌絲球成球大小如圖5所示,可以看出,相同接種量的條件下,同時培養(yǎng)法形成的混合菌絲球直徑比吸附法的小,且成球總數(shù)量多.接種方法相同時,混合菌絲球的大小隨著接種細菌數(shù)量的增多而變大.

圖4 不同固定化方法對混合菌絲球成球堆積體積的影響
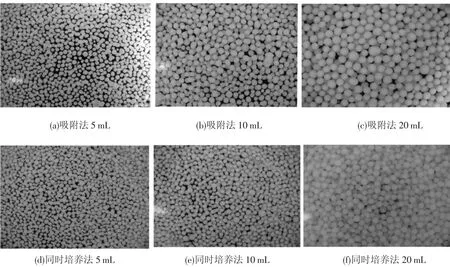
圖5 不同固定化方法對混合菌絲球成球大小的影響
2.4 不同固定化方法對混合菌絲球總質(zhì)量和總相對密度的影響
將不同固定化方法形成的全部混合菌絲球從三角瓶中取出,盡量去除多余水分后放到已經(jīng)恒重的蒸發(fā)皿中,吸取量控制在不使菌絲球變形為宜,將處理好的菌球置于烘箱內(nèi),95℃烘干至恒質(zhì)量,讀取皿和球的總質(zhì)量,去掉空皿質(zhì)量得到混合菌絲球的總質(zhì)量.以成球總質(zhì)量除以成球堆積體積即定義為成球總相對密度.
由圖6可以看出,當細菌接種量相同時,同時培養(yǎng)法形成的混合菌絲球的總質(zhì)量和總相對密度都要小于吸附法形成的混合菌絲球;而相同固定化方法,隨著細菌接種量的增加形成混合菌絲球的總質(zhì)量和總相對密度卻減少.
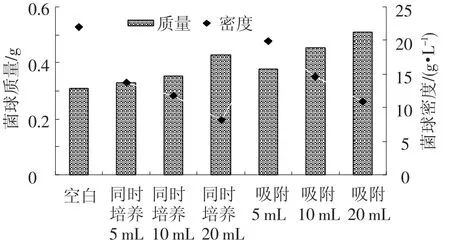
圖6 不同固定化方法對混合菌絲球成球總質(zhì)量和密度的影響
2.5 不同固定化方法對混合菌絲球內(nèi)部形態(tài)的影響
分別采用同時培養(yǎng)法和吸附法培養(yǎng)混合菌絲球,隨機取兩種混合菌絲球各1個,切開后在掃描電子顯微鏡下觀察其內(nèi)部形態(tài)結構,同時以沒有固定化細菌的單純霉菌菌絲球內(nèi)部形態(tài)結構作對比,結果如圖7所示.可以看出:圖7(a)中采用吸附固定化方法形成的混合菌絲球內(nèi)部的細菌只固著在菌絲交叉形成平臺的地方,而在沒有交叉的菌絲上就沒有細菌存在;而圖7(c)中采用同時培養(yǎng)固定化方法形成的混合菌絲球內(nèi)部,細菌是非常均勻地排列生長在每一根菌絲上,無論菌絲交聯(lián)與否,而且單位面積上固定化生長的細菌數(shù)量也明顯多于圖7(a)的混合菌絲球.而且,圖7(c)中細菌均勻排列,很少出現(xiàn)堆積和分層的現(xiàn)象,不影響菌絲球內(nèi)部的能量和氧的供給,不會影響菌絲球對內(nèi)部細菌的傳質(zhì),這樣被固定的細菌就能夠保持較高的活性,更有利于在水處理工藝中的應用.

圖7 不同固定化方法形成的混合菌絲球內(nèi)部形態(tài)結構的掃描電子顯微鏡照片
3 結論
1)相同接種量的條件下,同時培養(yǎng)法固定化細菌所用的固定化時間縮短,而且在單位時間內(nèi)可固定化細菌量更多.同時培養(yǎng)法與吸附法所形成的混合菌絲球相比,其堆積體積更大,成球總數(shù)量更多,球體直徑較小,總質(zhì)量和總相對密度也較小.
2)當采用同一種固定化方法時,混合菌絲球的堆積體積、成球大小與功能菌的接種量成正比;而形成混合菌絲球的總質(zhì)量和總相對密度卻與功能菌的接種量成反比.
3)同時培養(yǎng)法形成的混合菌絲球內(nèi)部細菌非常均勻地排列生長在每一根菌絲上,無論菌絲交聯(lián)與否;而吸附法形成的混合菌絲球內(nèi)部,細菌只存在于多條菌絲交叉形成平臺的地方.所以,新型微生物固定化方法可能會有效解決傳統(tǒng)方法的傳質(zhì)效率低、固定生物量低、成本高等問題,具有較大的開發(fā)潛力和應用價值.
[1]張一竹,王清棋,劉劍書等.橘青霉菌絲球形成條件及其處理廢水的應用[J].氨基酸和生物資源,2003,25(1):44-46.
[2]袁麗梅,張書軍,楊敏,等.應用氣升式反應器培養(yǎng)草酸青霉菌菌絲球的研究[J].微生物學報,2004,44(3):39-395.
[3]BIZUKOJC M,LEDAKOWICZ S.Physiological,morphological and kinetic aspects of lovastatin biosynthesis by aspergillus terreus[J].Journal of Biotechnology,2009,4:647-664.
[4]SARASWATHY A,HALLBERG R.Mycelial pellet formation by penicillium ochrochloron species due to exposure to pyrene[J].Microbiological Research,2005,160(4):375-383.
[5]WUCHERPFENNIG T,KIEP K A,DRIOUCH H,et al.Morphology and rheology in filamentous cultivations[J].Advances in Applied Microbiology,2010,72:89-136.
[6]HILLE A.Effective diffusivities and mass fluxes in fungal biopellets[J].Biotechnology and Bioengineering,2009,103:1202-1213.
[7]姜紹通,吳學鳳,潘麗軍,等.米根霉菌絲球半連續(xù)發(fā)酵產(chǎn)乳酸的工藝研究[J].農(nóng)業(yè)機械學報,2009,40(11):150-155.
[8]曹曉婷,熊小京,鄭天凌,等.黑曲霉菌絲球對直接耐曬翠藍FBL的脫色特性[J].華僑大學學報:自然科學版,2008,29(1):34-37.
[9]范天黎,席宇姚,東升,等.土曲霉M11菌絲球對結晶紫的吸附脫色研究[J].化學與生物工程,2010,27(3):77-79.
[10]肖繼波,胡用有.煙曲霉菌吸附染料的解析及其機理[J].環(huán)境科學與技術,2008,31(5):18-22.
[11]劉桂萍,陳曉霞.霉菌Dh-B1菌絲球吸附鉛離子的研究[J].沈陽化工大學學報,2008,22(3):218-221.
[12]吳涓,鐘升,李玉成.黃孢原毛平革菌對Pb2+的生物吸附特性及吸附機理[J].環(huán)境科學研究,2010,23(6):754-761.
[13]王慕華,徐宏英,蘇檳楠.黑曲霉菌絲球還原水中六價鉻的研究[J].科學技術與工程,2010,10(26):6472-6477.
[14]黃錦麗,龍敏南,傅雅婕,等.產(chǎn)酸克雷伯氏菌吸附固定及其產(chǎn)氫研究[J].廈門大學學報,2005,44(5):710-713.

